壳聚糖、ε-聚赖氨酸及山梨酸钾对杨梅的保鲜效果研究
◎ 吴 超,王江琴
(贵州师范学院 生物科学学院,贵州 贵阳 550018)
杨梅(Myrica rubra(Lour.)S. et Zucc.)又名龙睛、朱红,属杨梅科杨梅属小乔木或灌木植物,为我国特色水果,原产于我国东南地区[1]。杨梅果实富含人体所需的维生素和氨基酸,色泽艳丽,甜酸可口,号称“开胃第一果”[2],深受消费者喜爱。同时,杨梅具有很高的药用价值,含有抑制肿瘤细胞生长的抗癌物质,其叶、仁、果实、树皮均可作药材[3]。
然而,由于杨梅果实采收成熟期集中在5~7月,处于高温多雨季节,加之没有外果皮,肉柱柔嫩,极易受损,采后生理代谢旺盛,致使果实衰老加速且对病原微生物的抵抗力下降而极不耐贮运,如不加任何处理,常温货架期仅2~4 d,有“一日采收、二日变色、三日变味”的说法[4]。杨梅鲜销仅占40%,这一弊端限制了杨梅的远销和大规模生产种植[5]。目前尚未从根本上解决杨梅的保鲜贮运问题[6],杨梅采后保鲜成为制约产业发展的一个技术瓶颈,当务之急是解决杨梅的保鲜问题,开发高效、安全、广谱的天然防腐保鲜剂成为食品科学研究与应用的一个热点[7]。本研究以杨梅果实为试验材料,在冷藏(4 ℃)条件下,结合PET+PE复合膜包装(不抽真空),采用正交试验法优化壳聚糖、ε-聚赖氨酸及山梨酸钾对蓝莓的复合涂膜配方,初步研究其对蓝莓的保鲜效果,为延长杨梅贮藏保鲜期提供参考。
1 材料和方法
1.1 材料
杨梅,采自贵阳市乌当区阿栗杨梅园。壳聚糖,广州馨之味食品配料商城;ε-聚赖氨酸,浙江新银象生物工程有限公司;山梨酸钾,宁波王龙科技股份有限公司,均为食品添加剂;盐酸、抗坏血酸、氢氧化钠、乙醇和醋酸均为分析纯;食品包装袋(PET+PE复合,0.16 mm)。
1.2 仪器设备
HTP-312型电子天平,上海花潮电器有限公司;DZF-4000真空包装机,浙江鼎业机械设备有限公司;HH-8电子恒温水浴锅,上海梅香仪器有限公司;HY-TD型手持折光仪,杭州恒仪仪表科技有限公司;DHG-9240A型电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;UV-8000型紫外可见分光光度计,上海元析仪器有限公司。
1.3 试验方法
1.3.1 单因素试验
为便于试验设计和开展,正式试验前,在常温(无包装、包装)、冷藏(4 ℃,无包装、包装)条件下对杨梅的保藏情况进行初步试验。
分别称取并配制壳聚糖(0%、0.5%、1%、1.5%、2%和2.5%)、山梨酸钾(0%、0.1%、0.2%、0.3%、0.4%和0.5%)及ε-聚赖氨酸(0 g·kg-1、0.01 g·kg-1、0.02 g·kg-1、0.03 g·kg-1、0.04 g·kg-1和0.05 g·kg-1),分别对杨梅进行各浓度梯度(0%或0 g·kg-1试验组为对照组)保鲜涂膜处理浸泡2 min,分别存入常温(无包装、包装)与4 ℃冷藏(无包装、包装)保藏,观测杨梅在贮藏过程中的变化,主要采用感官评价,初步得出单因素试验时各自浓度梯度中的较好的保鲜剂浓度。
1.3.2 正交试验
基于单因素试验结果,选择壳聚糖、ε-聚赖氨酸及山梨酸钾为正交试验设计的因素,进行L9(33)正交试验,因素水平表见表1。
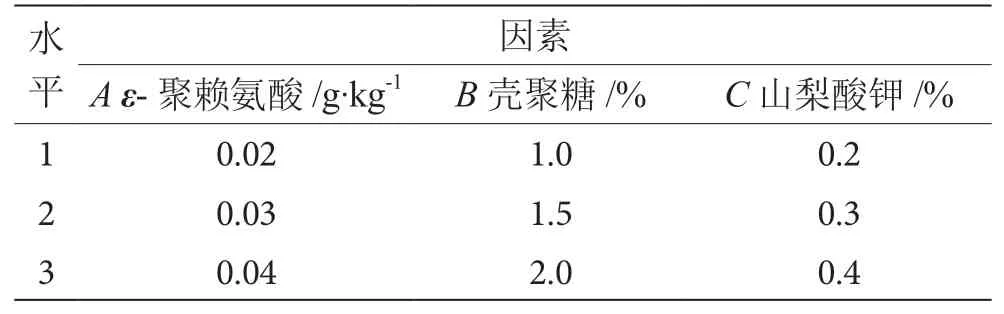
表1 正交试验因素水平表
1.3.3 指标测定
(1)感官评价。直观观测果实颜色、开裂、气味、长霉等现象。
(2)还原糖测定。依据《食品安全国家标准 食品中还原糖的测定》(GB 5009.7—2016)采用酸碱直接滴定法。
(3)可滴定酸测定。依据《食品中总酸的测定》(GB/T 12456—2008 GB 5009.239—2016)采用酸碱滴定法。
(4)可溶性固形物含量测定。使用HY-TD型手持折光仪测定。
1.3.4 数据分析
主要利用软件Statistica 17、Excel软件进行统计分析处理。
2 结果与分析
2.1 单因素试验
试验过程中,将经各单因素处理的杨梅分别置于常温和冷藏(4 ℃)条件下,通过感官评价对比经不同处理在包装或不包装时杨梅在贮藏过程中的变化,如图1~图8。
常温条件下,图1是无袋包装保藏的杨梅,其在保藏1 d后就开始出现部分开裂与被霉菌感染现象,图2是其保藏第3 d,杨梅基本被霉菌感染并开裂。图3为采用袋装杨梅样品组,在保藏3 d后,并无霉菌感染迹象,也无开裂状况,但在第6 d开始出现如图4所示的少量汁液流出及胀袋现象。通过杨梅在常温保藏下感官评价得出,有袋包装相对于无袋包装的保鲜方式可以延长杨梅的保鲜时间。

图1 常温无袋包装保藏1 d的杨梅图

图2 常温无袋包装保藏3 d的杨梅图

图3 常温袋装保藏3 d的杨梅图

图4 常温袋装保藏6 d的杨梅图
在冷藏(4 ℃)条件下,图5为单因素试验中的冷藏无袋包装保藏的杨梅,在其保藏2 d后,并未出现常温保藏时的开裂及长霉现象,在保藏6 d后,如图6所示,杨梅开始出现开裂和长霉现象。图7为冷藏采用袋装保藏杨梅组,保藏3 d后无明显变化,在冷藏保藏6 d后(图8),杨梅未出现失重、发霉、开裂及袋胀气现象,保藏效果较好于冷藏无袋组以及常温有袋组、常温无袋组。

图5 冷藏无袋包装保藏2 d的杨梅图

图6 冷藏无袋包装保藏6 d的杨梅图

图7 冷藏袋装保藏3 d的杨梅图

图8 冷藏袋装保藏6 d的杨梅图
通过对杨梅在常温和冷藏条件下的单因素试验(感官评价)得出:有袋包装较无袋包装的保鲜方式效果更好,杨梅在冷藏条件下的保鲜效果要好于其常温条件下的保鲜效果。经感官评价,对本单因素试验来说,壳聚糖各浓度梯度保鲜效果较好的是1%、1.5%、2%;ε-聚赖氨酸各浓度梯度保鲜效果较好的是0.02 g·kg-1、0.03 g·kg-1、0.04 g·kg-1;山梨酸钾各浓度梯度保鲜效果较好的是0.2%、0.3%、0.4%。
2.2 正交试验
基于单因素试验得出的试验结果,在冷藏(4 ℃)条件下较常温条件下具有更长的保鲜期,因而,本正交试验选择在冷藏(4 ℃)条件下进行。将在单因素中试验筛选出3种保鲜剂中各自较佳的3个浓度进行L9(33)正交试验,在贮藏过程中测定其腐烂率的变化,在贮藏43 d以后,其中对照组和3号杨梅试验组腐烂率超过2/3,超过此腐烂率的杨梅实验组即停止测定,故选定分析数据为贮藏第43 d的数据,结果如下。
2.2.1 杨梅还原糖含量的变化
在冷藏(4 ℃)条件下,如图9所示,杨梅的还原糖含量随着杨梅保藏天数的不断增加,在6月5日至6月20日,全部试验样品还原糖含量总体呈现上升趋势,而空白样品的还原糖含量上升速度最快,其次是9、5、8和7号试验组,还原糖含量上升速度最慢的分别是1、6和3号试验组;在贮藏14 d后,对照组还原糖含量呈现明显下降趋势,期间呈现增长速度相对稳定的是9、5、8和7号试验组,3号试验组在贮藏28 d后还原糖含量开始急速下降。

图9 冷藏(4 ℃)杨梅还原糖含量的变化图
如表2所示,在冷藏保藏下的杨梅试验组中,因数A的T1、T2和T33个数值中,T3最大,T2次之,T1最小,即T3>T2>T1,意味着因数A中的3个浓度中,0.04 g·kg-1的ε-聚赖氨酸浓度在杨梅保藏期间的还原糖变化相对稳定,保鲜效果要较好于浓度0.02 g·kg-1和0.03 g·kg-1的ε-聚赖氨酸;因素B的T1、T2和T33个数值中,T2最大,T1次之,T3最小,即T2>T1>T3,意味着因数B中的3个浓度中1.5%壳聚糖浓度在杨梅保藏期间的还原糖变化相对稳定,保鲜效果要较好于浓度1%和2%的壳聚糖;因素C的T1、T2和T33个数值中,T1最大,T2次之,T3最小,即T1>T2>T3,意味着因素C的3个浓度中0.2%山梨酸钾浓度在杨梅保藏期间的还原糖变化相对稳定,保鲜效果要较好于浓度0.3%和0.4%的山梨酸钾。

表2 冷藏(4 ℃)杨梅第43 d的还原糖含量正交结果分析表
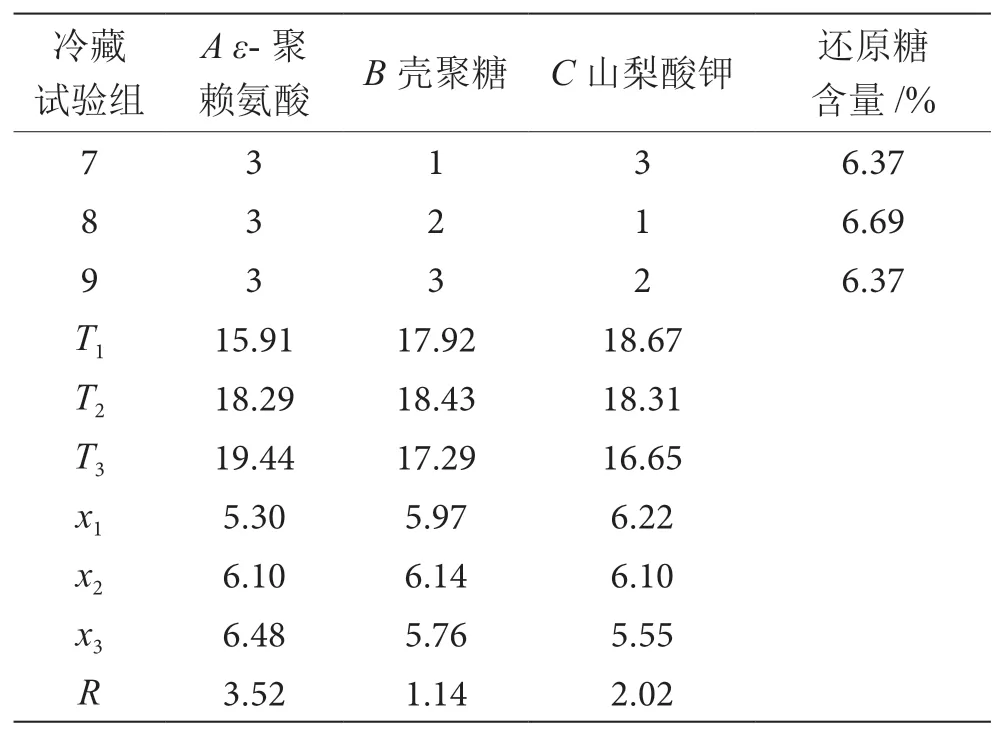
(续表2)
在R分析中,ε-聚赖氨酸这一列最大,为3.52,其次是山梨酸钾,为2.02,而壳聚糖最小为1.14,说明当ε-聚赖氨酸组合的水平变动时,还原糖含量随之发生了较大的变动,而壳聚糖的水平变动时,虽还原糖含量也随之发生变动,但变动的幅度相对较小,由此根据R值大小,得出在杨梅保鲜过程中对还原糖含量影响的主次顺序是A>C>B,故ε-聚赖氨酸对杨梅还原糖的保鲜效果起到重要作用,且较好的保鲜浓度配方为A3B2C1(ε-聚赖氨酸:0.04 g·kg-1;壳聚糖:1.5%;山梨酸钾:0.2%)。
2.2.2 杨梅可滴定酸含量变化
在冷藏(4 ℃)条件下,杨梅在保藏过程中可滴定酸含量如图10所示,前期增加,后期逐步降低,空白对照组变化起伏相对较大,而复合保鲜剂处理各试验组相对较平稳。
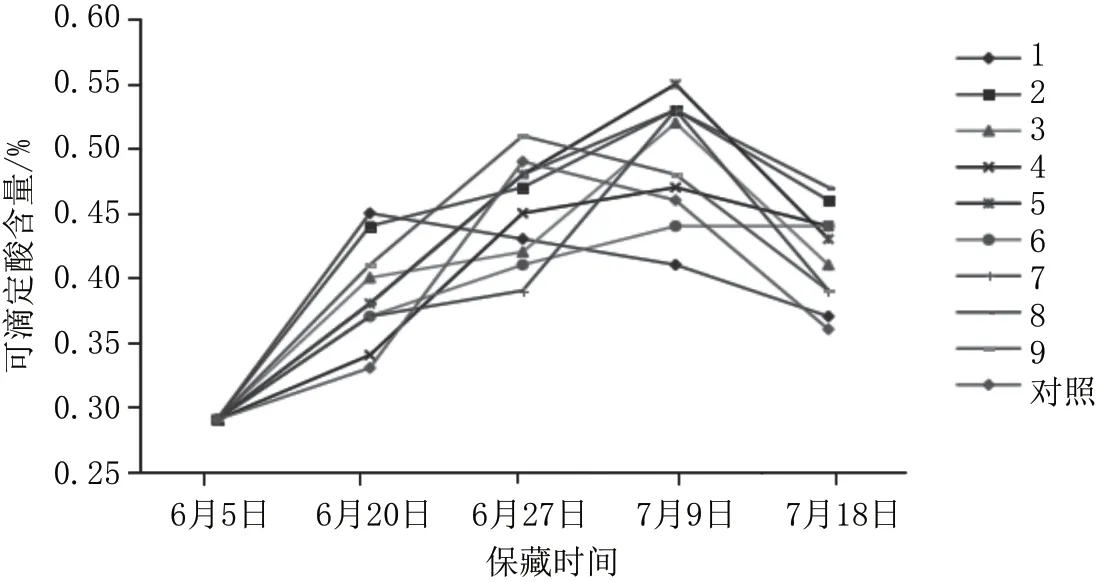
图10 冷藏(4 ℃)杨梅可滴定酸含量的变化图
如表3显示,在冷藏(4 ℃)条件下的杨梅试验组中,因数A的T1、T2和T33个数值中,T2最大,T3次之,T1最小,即T2>T3>T1,意味着因数A中的3个浓度中,0.03 g·kg-1ε-聚赖氨酸浓度在杨梅保藏期间的可滴定酸变化相对稳定,保鲜效果要较好于浓度0.02 g·kg-1和0.04 g·kg-1的ε-聚赖氨酸;因素B的T1、T2和T33个数值中,T2最大,T3次之,T1最小,即T2>T3>T1,意味着因数B中的3个浓度中1.5%壳聚糖浓度在杨梅保藏期间的可滴定酸变化相对稳定,保鲜效果要较好于浓度1%和2%的壳聚糖;因素C的T1、T2和T33个数值中,T2最大,T1次之,T3最小,即T2>T1>T3,意味着因素C3个浓度中的0.3%山梨酸钾浓度在杨梅保藏期间的可滴定酸变化相对稳定,保鲜效果要较好于浓度0.2%和0.4%的山梨酸钾。

表3 冷藏(4 ℃)杨梅第43 d的可滴定酸含量正交结果分析表
在R分析中,壳聚糖这一列最大,为0.15%,其次是ε-聚赖氨酸,为0.07%,而山梨酸钾最小为0.06%,说明当壳聚糖组合的水平变动时,可滴定酸含量随之发生了较大的变动,而山梨酸钾的水平变动时,虽可滴定酸含量也随之发生变动,但变动的幅度相对较小,由此根据R值大小,得出在杨梅保鲜过程中对可滴定酸含量影响的主次顺序是B>A>C,故壳聚糖对杨梅可滴定酸的保鲜效果起到最关键作用,且较好的保鲜浓度配方为A2B2C2(ε-聚赖氨酸:0.03g·kg-1;壳聚糖:1.5%;山梨酸钾:0.3%)。经对组合(A2B2C2)进行验证,该组合可滴定酸含量较本正交试验组中较优组(A3B2C1,可滴定酸含量最高)高出4个百分点,可滴定酸含量的变化幅度更小。
2.2.3 杨梅可溶性固形物含量的变化
在冷藏(4 ℃)条件下,测定杨梅可溶性固形物含量的变化,如图11所示,6号试验组的固形物含量变化比较不稳定,变化最为快速,上升最快下降最快的是冷藏储存的对照组,其次下降最快的分别是3号、1号、7号、5号、4号试验组,相对较稳定的为8号、2号和9号试验组。

图11 冷藏(4 ℃)杨梅可溶性固形物含的变化图
如表4显示,在冷藏保藏下的杨梅试验组中,因数A的T1、T2和T33个数值中,T3最大,T2次之,T1最小,即T3>T2>T1,意味着因数A的3个浓度中,0.04 g·kg-1ε-聚赖氨酸浓度在杨梅保藏期间的固形物含量变化相对稳定,保鲜效果要较好于浓度0.02 g·kg-1和0.03 g·kg-1的ε-聚赖氨酸;因素B的T1、T2和T33个数值中,T2最大,T3次之,T1最小,即T2>T3>T1,意味着因数B的3个浓度中1.5%壳聚糖浓度在杨梅保藏期间的固形物含量变化相对稳定,保鲜效果要较好于浓度1%和2%的壳聚糖;因素C的T1、T2和T33个数值中,T2最大,T1次之,T3最小,即T2>T1>T3,意味着因素C的3个浓度中0.3%山梨酸钾浓度在杨梅保藏期间的固形物变化相对稳定,保鲜效果要较好于浓度0.2%和0.4%的山梨酸钾。

表4 冷藏(4 ℃)杨梅第43 d的固形物含量正交结果分析表
在R分析中,山梨酸钾这一列最大,为1.74%,其次是壳聚糖,为1.64%,而ε-聚赖氨酸最小为1.63%,说明当山梨酸钾组合的水平变动时,固形物含量随之发生了较大的变动,而ε-聚赖氨酸的水平变动时,虽固形物含量也随之发生变动,但变动的幅度相对较小,由此根据R值大小,得出在杨梅保鲜过程中对固形物含量影响的主次顺序是C>B>A,故山梨酸钾对杨梅固形物的保鲜效果起到重要作用,且较好的保鲜浓度配方为A3B2C2(ε-聚赖氨酸:0.04g·kg-1;壳聚糖:1.5%;山梨酸钾:0.3%)。经对组合(A3B2C2)进行验证,该组合可溶性固形物含量较本正交试验组中较优组(A3B3C2,可溶性固形物含量最高)高出2个百分点,可溶性固形物含量的变化相对更稳定。
综上,从杨梅在贮藏过程中还原糖、可滴定酸、可溶性固形物含量的变化来看,正交试验结果并不完全一致,因而选择评价指标显得特别重要。在本试验中,壳聚糖浓度表现出一致性,均显示较好保鲜浓度(B2)为1.5%;而ε-聚赖氨酸则在还原糖、可溶性固形物方面显示较好保鲜浓度(A3)为0.04 g·kg-1;山梨酸钾则在可滴定酸、可溶性固形物含量指标上显示较好保鲜浓度(C2)为0.3%。综合试验组A3B2C1、A2B2C2、A3B2C2(此三组分别为以还原糖、可滴定酸、可溶性固形物为评价指标时的较优组合)对还原糖、可滴定酸、可溶性固形物含量的变化的影响分析对比,较好的复合涂膜保鲜浓度配方为A3B2C2(ε-聚赖氨酸:0.04 g·kg-1;壳聚糖:1.5%;山梨酸钾:0.3%)。
3 结语
本研究以杨梅为试材,探究壳聚糖、ε-聚赖氨酸和山梨酸钾复合涂膜对杨梅的最佳保鲜效果组合。在4℃条件下,结合PET+PE复合膜包装(不抽真空),运用正交试验法优化,具有较好保鲜鲜果的壳聚糖、ε-聚赖氨酸和山梨酸钾复合涂膜的最佳浓度配比为:1.5%壳聚糖、0.04 g·kg-1ε-聚赖氨酸、0.3%山梨酸钾。
本试验虽然通过综合分析对比得出复合涂膜的最佳浓度配比,但仍需进一步结合杨梅主要理化指标进行深入研究和验证,以得出更加优化的ε-聚赖氨酸、壳聚糖和山梨酸钾复合涂膜保鲜组合,以取得更好的保鲜效果。

