山药及麸炒山药拉曼指纹图谱分析
彭 艳,张丽颖,金 阳,杨 钊,陆兔林,金传山,都述虎*
(1.南京医科大学药学院,江苏 南京 211166;2.九州天润中药产业有限公司,湖北 武汉 430040;3.南京中医药大学药学院,江苏 南京 210046;4.安徽中医药大学药学院,安徽 合肥 230012)
山药为薯蓣科植物薯蓣DioscoreaoppositaThunb.的干燥根茎,记载于《山海经》《神农本草经》《图经本草》《本草纲目》《植物名实图考》等中医药典籍中[1]。山药味甘,性平,归脾、肺、肾经,具有补脾养胃、生津益肺、补肾涩精的功效。2020年版《中国药典》记载的山药饮片主要有生山药和麸炒山药,其鉴定仅局限在性状、显微和薄层色谱鉴别,主要是针对山药的真伪鉴别,但对于不同产地山药之间的差异,特别是对山药炮制前后的化学成分变化研究甚少,给山药质量控制带来了很大的困难。因此,发展一种快速简便的分析方法,对山药质量标准提升具有重要意义。
拉曼光谱是一种散射光谱,通过散射峰的位置和强度得到分子振动、转动方面的信息,并应用于分子结构研究。随着拉曼光谱技术发展,拉曼光谱的应用已经越来越广泛,作为一种现代光学检测分析技术被2020年版《中国药典》四部通则收录。近几年来,拉曼光谱以其操作简便、精细如“指纹”的分辨能力和不受水分干扰等优点成功应用于中药材的无损定性鉴别[2-7]。本实验对不同产地的山药饮片及其麸炒前后的拉曼指纹图谱进行分析,以期为麸炒前后山药的质量控制提供新途径。
1 材料
DXR激光共聚焦拉曼光谱仪(美国赛默飞公司)。山药对照药材(批号121137-201606)购自中国食品药品检定研究院;可溶性淀粉(分析纯,批号20191213)购自国药集团化学试剂有限公司。山药及麸炒山药选片、统片(产地河南)由湖北麻城九州中药发展有限公司提供,其余山药饮片购自河南、河北、广西及安徽,见表1。山药片经南京医科大学药学院陈立娜教授鉴定为薯蓣科植物薯蓣DioscoreaoppositaThunb.的干燥根茎切制而成。
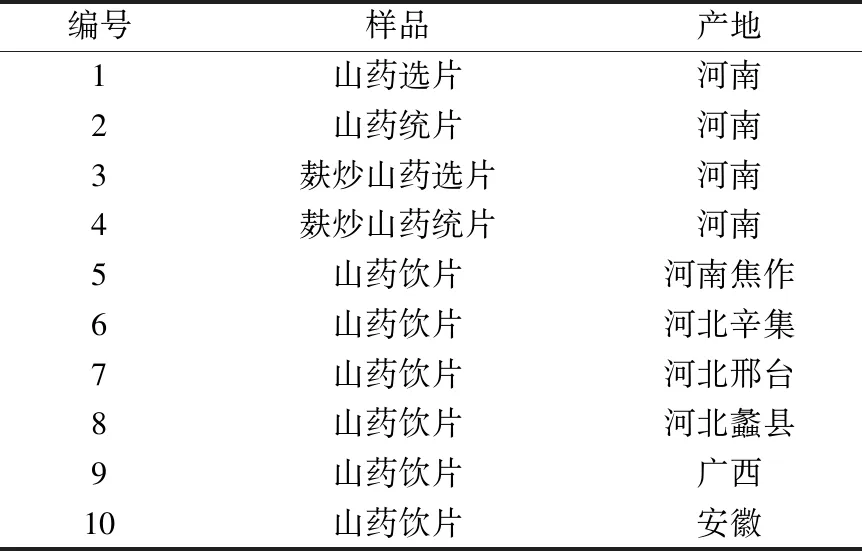
表1 样品信息Tab.1 Information of samples
2 方法与结果
2.1 拉曼光谱条件 扫描范围2 000~400 cm-1;10倍物镜;激光功率24 mW,激发波长780 nm;狭缝光阑50 μm,曝光时间10 s,累积10次。
2.2 测定方法 检测时将样品平面置于载玻片上,使其位于拉曼光谱仪载物台的物镜下测定,按采集参数随机采集样品的拉曼光谱,计算平均光谱用于分析比较。
2.3 拉曼光谱条件优化 为获得最佳山药拉曼光谱图,分别对拉曼光谱仪的激发波长、光阑类型、激光功率、曝光时间和累积次数进行实验条件的优化。
2.3.1 激发波长选择 取山药对照药材颗粒适量,固定激光功率24 mW,狭缝光阑25 μm,曝光时间2 s,累积10次,按“2.2”项下方法分别在532、633、780 nm激发波长下进行检测。结果显示,780 nm激发波长下山药对照药材的基线噪音最小,峰形最好,因此使用该波段激发光进行测定,能够有效避免荧光对样品拉曼信号的影响。故选择780 nm为最佳激发波长。
2.3.2 光阑类型选择 取山药对照药材颗粒适量,固定激光功率24 mW,激发波长780 nm,曝光时间2 s,累积10次,按“2.2”项下测定方法,分别在针孔光阑(25、50 μm)和狭缝光阑(25、50 μm)下进行检测。测定结果显示拉曼光谱仪的光阑类型对山药光谱影响较大,狭缝光阑下光谱的分辨率明显高于针孔光阑,且随着狭缝宽度增大,光谱强度增强。因此本实验中最后选择50 μm狭缝光阑进行后续的实验。
2.3.3 激光功率选择 取山药对照药材颗粒适量,固定激发波长780 nm,光阑50 μm,曝光时间2 s,累积10次,按“2.2”项下测定方法,分别在8、16、24 mW激光功率下进行检测。结果显示激光功率越大,拉曼峰强度越强,因此后续实验激光功率选择24 mW。
2.3.4 曝光时间选择 取山药对照药材颗粒适量,固定激光功率24 mW激发波长780 nm,光阑50 μm,累积10次,按“2.2”项下测定方法,分别曝光2、5、10 s对其进行检测。结果显示光谱采集时的曝光时间越长,拉曼峰强度越强,信噪比值越大,当积分时间为10 s时山药对照药材的拉曼特征峰峰形最好,基线噪音较小,再提高曝光时间,谱图没有明显改善,且损害激光器的使用寿命,因此后续实验曝光时间选择10 s。
2.3.5 累积次数选择 取山药对照药材颗粒适量,固定激光功率24 mW激发波长780 nm,光阑50 μm,曝光时间10 s,按“2.2”项下测定方法,分别累积2、5、10次进行检测。结果显示随着累积次数的增加,山药对照药材的拉曼光谱图基线噪音会越来越小,但累积次数过多会严重影响实验时间,损害仪器寿命,综合考量确定累积次数为10次。
2.4 山药拉曼峰归属 取山药对照药材颗粒适量,在“2.1”“2.2”项条件下进行检测,选取6个不同点进行扫描,得到的山药拉曼光谱峰形、峰强度均相对稳定,见图1。在山药对照药材拉曼光谱中,478、866、941、1 460 cm-1处出现明显的特征峰;440、523、577、616、713、770、1 050、1 082、1 126、1 263、1 339、1 380 cm-1处出现较明显的拉曼峰。这些拉曼峰反映了山药拉曼光谱的指纹特性。和可溶性淀粉比较,发现山药对照药材与可溶性淀粉的拉曼特征峰峰形相似,见图2。
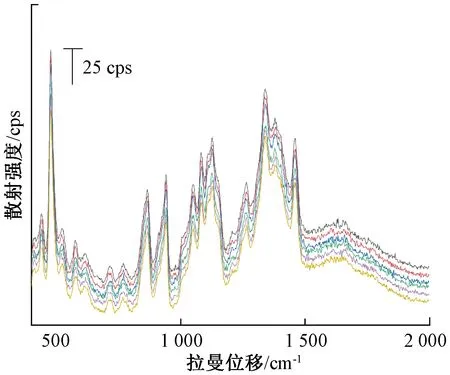
图1 山药对照药材拉曼光谱 (n=6)Fig.1 Raman spectra of Chinese yam for control (n=6)
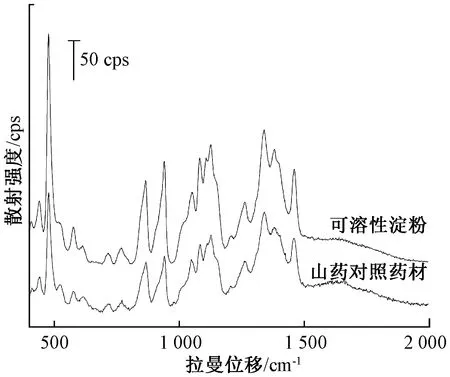
图2 山药对照药材与可溶性淀粉拉曼光谱比较Fig.2 Comparison of Raman spectra between Chinese yam for control and soluble starch
查阅文献[8-10],可知800~400 cm-1处的振动是由于糖苷环骨架的弯曲振动所造成,其中478 cm-1处的峰是由吡喃糖环的骨架振动引起,常作为直链淀粉与支链淀粉即淀粉多糖特征峰,另外其峰强度反映了多糖的聚合程度;770 cm-1处的峰是由N-甲基甲酰胺的C-C伸缩振动引起(可能有尿囊素);1 200~800 cm-1处的振动是C-O和C-C键的特征伸缩振动以及糖苷键中C-O-C的弯曲振动,其中866 cm-1处的峰来源于C-O-C环和C-H弯曲振动,941 cm-1处的振动是由于直链淀粉α-1,4糖苷键的C-O-C的弯曲振动引起。1 500~1 200 cm-1处的振动源于氢原子的耦合,其中1 263 cm-1处与CH2OH侧链相关,1 339 cm-1处为C-O-H弯曲振动,1 380 cm-1为CH2、C-H和C-O-H的弯曲振动,1 460 cm-1处为CH2的弯曲振动。实验所获得的山药拉曼光谱峰信号,显示了山药中淀粉的指纹特性[8-11]。山药对照药材拉曼光谱特征峰振动模式归属,见表2。
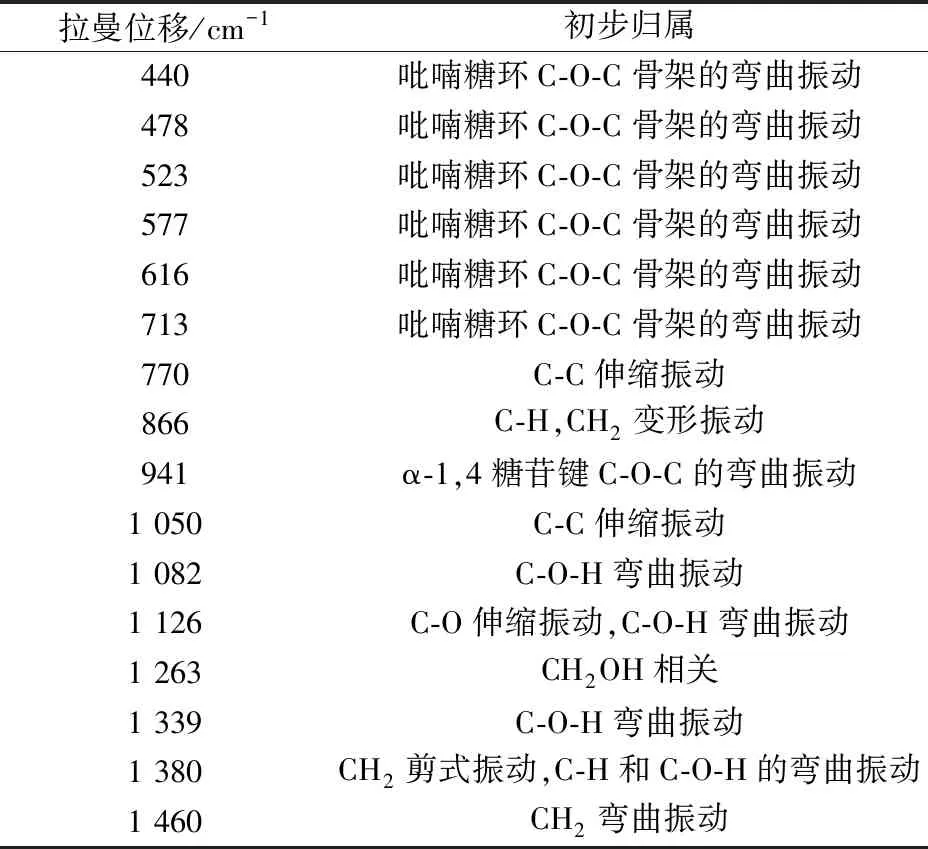
表2 拉曼光谱谱峰位置及归属Tab.2 Positions and their assignments of Raman peaks for Chinese yam for control
2.5 拉曼显微成像分析 取山药选片1片置于样品台,在“2.2”项条件下进行面扫描,X轴步距为2 000 μm,Y轴步距为3 500 μm,共40个扫描点。以478 cm-1处特征峰强度绘制mapping图,结果见图3,扫描范围内山药选片表面各检测点的峰强度均一性较好,后续实验可在样品表面随机采样收集光谱信息。
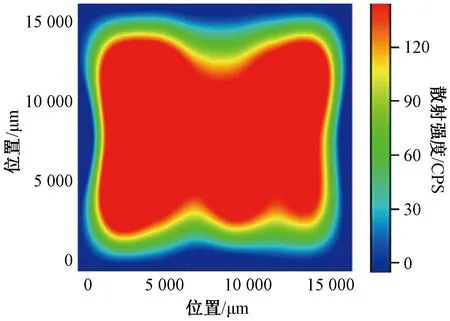
图3 478 cm-1处山药选片面扫描图Fig.3 Raman mapping image of selected Chinese yam with Raman band at 478 cm-1
2.6 重复性试验 分别取山药选片5片,在“2.1”“2.2”项条件下,分别在5个片子中心表面进行拉曼检测,5组山药特征峰强度的RSD小于4.0%,拉曼位移RSD小于0.1%。
2.7 不同产地山药拉曼光谱分析 在“2.1”“2.2”项条件下,分别对河南、河北、广西、安徽不同产地的山药饮片进行拉曼光谱检测,得到拉曼光谱图。图4显示,所有山药样品在400~1 500 cm-1的光谱范围内均出现了明显的指纹特征峰,不同产地的山药饮片指纹图谱比较基本一致,且不同产地山药拉曼光谱峰差异不大,较难区分。为进一步扩大山药拉曼光谱之间的差异,对各产地山药拉曼光谱进行一阶导数和二阶导数转化处理,见图5~6。综上结果提示,仅凭拉曼光谱很难区分不同产地山药的差异。

图4 不同产地山药与可溶性淀粉的拉曼光谱Fig.4 Raman spectra of Chinese yam from different areas and soluble starch
图5 不同产地山药的拉曼光谱一阶导数转换Fig.5 First derivative transformations of Raman spectra of Chinese yam from different areas
图6 不同产地山药的拉曼光谱二阶导数转换Fig.6 Second derivative transformations of Raman spectra of Chinese yam from different areas
2.8 判别分析 采用TQ Analyst软件(7.2.2.161版本)对河南、河北、广西、安徽四个产地的山药饮片拉曼光谱数据进行判别分析,以马氏距离单位计算各样品与各类中心之间的距离,并根据样品与中心距离的远近做出判别,以确定样品属于哪一个类别。距离值越接近零,则匹配越好。采用全模型法,选择山药拉曼光谱指纹区间400~1 500 cm-1,对不同产地山药进行判别分析,每个产地的山药饮片取10个样本量,分析图中,横坐标为样本距离河南组的马氏距离,纵坐标为样本距离广西组的马氏距离,见图7。结果显示,广西山药样本单独聚为一类,能够很好地与河南、河北和安徽山药区分开来。即通过判别分析可以有效区分广西山药和其他3个产地山药。
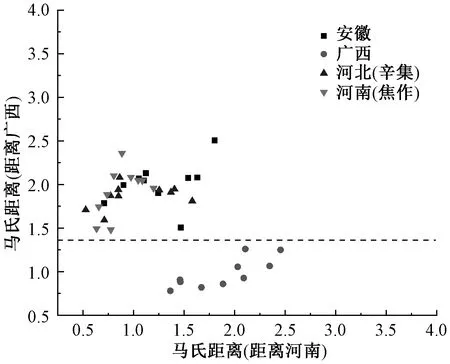
图7 不同产地山药判别分析结果Fig.7 Results of discriminant analysis for Chinese yam from different areas
2.9 麸炒山药拉曼光谱分析 取麸炒山药饮片,对其表面和截面进行拉曼光谱检测,结果见图8~9,麸炒山药饮片表面拉曼光谱荧光背景较强,478 cm-1处的特征峰是直链淀粉与支链淀粉多糖成分的有效标志,强度显著降低,在468、491 cm-1处出现2个新的拉曼散射峰,分别为葡萄糖吡喃糖环的骨架振动。为进一步分析478 cm-1处特征峰强度麸炒前后的变化,分别取山药及麸炒山药饮品各6片,进行拉曼光谱扫描,并根据其峰强度进行计算,结果显示山药麸炒前后峰强度降低约80%,见表3,与文献[11]报道的总淀粉含量降低值接近,提示山药在麸炒过程中,饮片表面的淀粉多糖发生了降解,多糖转化为葡萄糖[12-13],即表明山药麸炒前后表面多糖含量及单糖组成存在差异。同时将麸炒山药饮片切开取截面平扫,麸炒山药截面拉曼光谱图和同批生山药拉曼光谱图相比,峰位移和峰强度没有太多变化,可见麸炒山药内部淀粉含量没有变化。
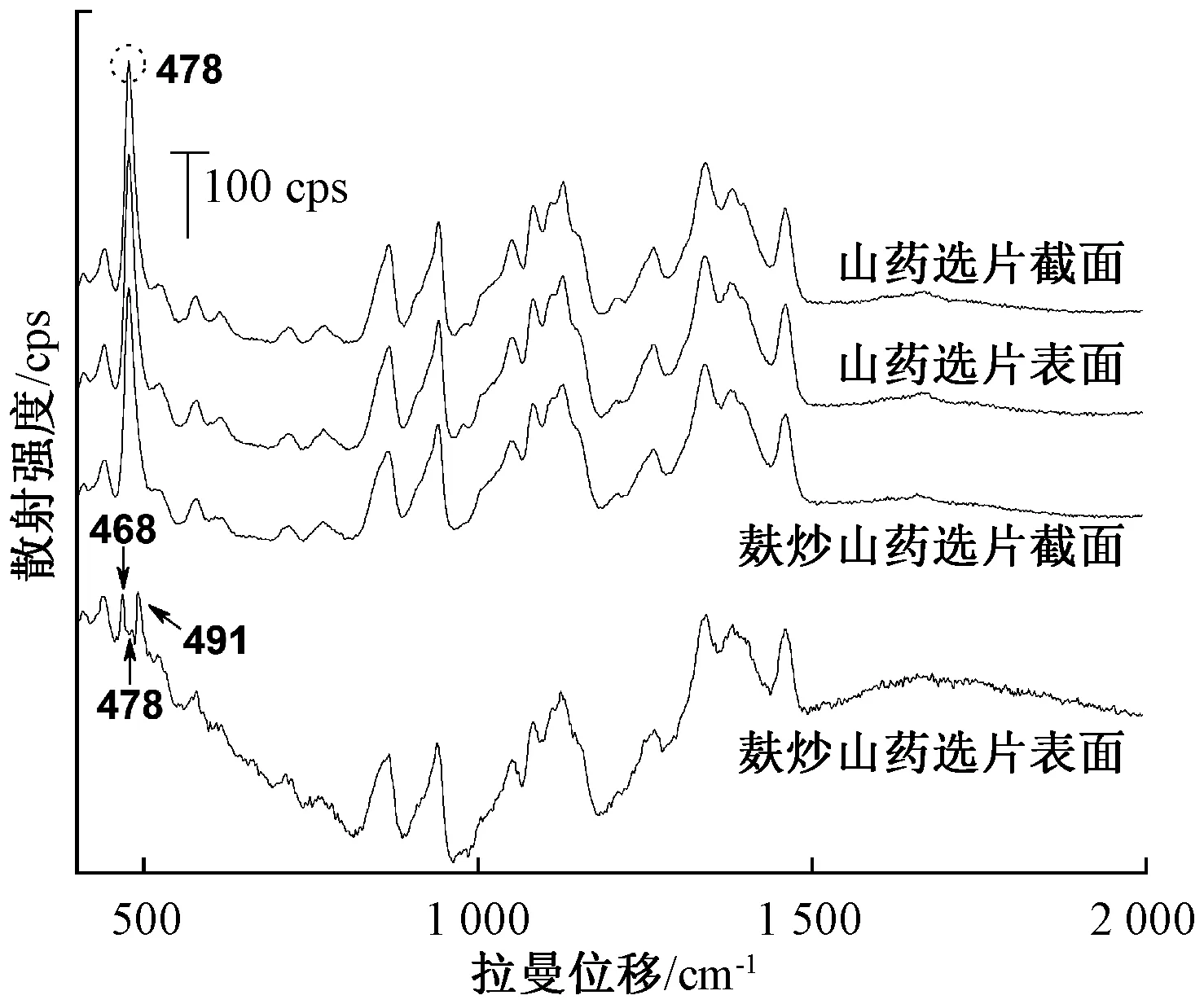
图8 山药选片和麸炒山药选片表面与截面拉曼光谱比较Fig.8 Comparison of Raman spectra obtained on surface and cross-section of selected Chinese yam and Chinese yam stir-fried with bran
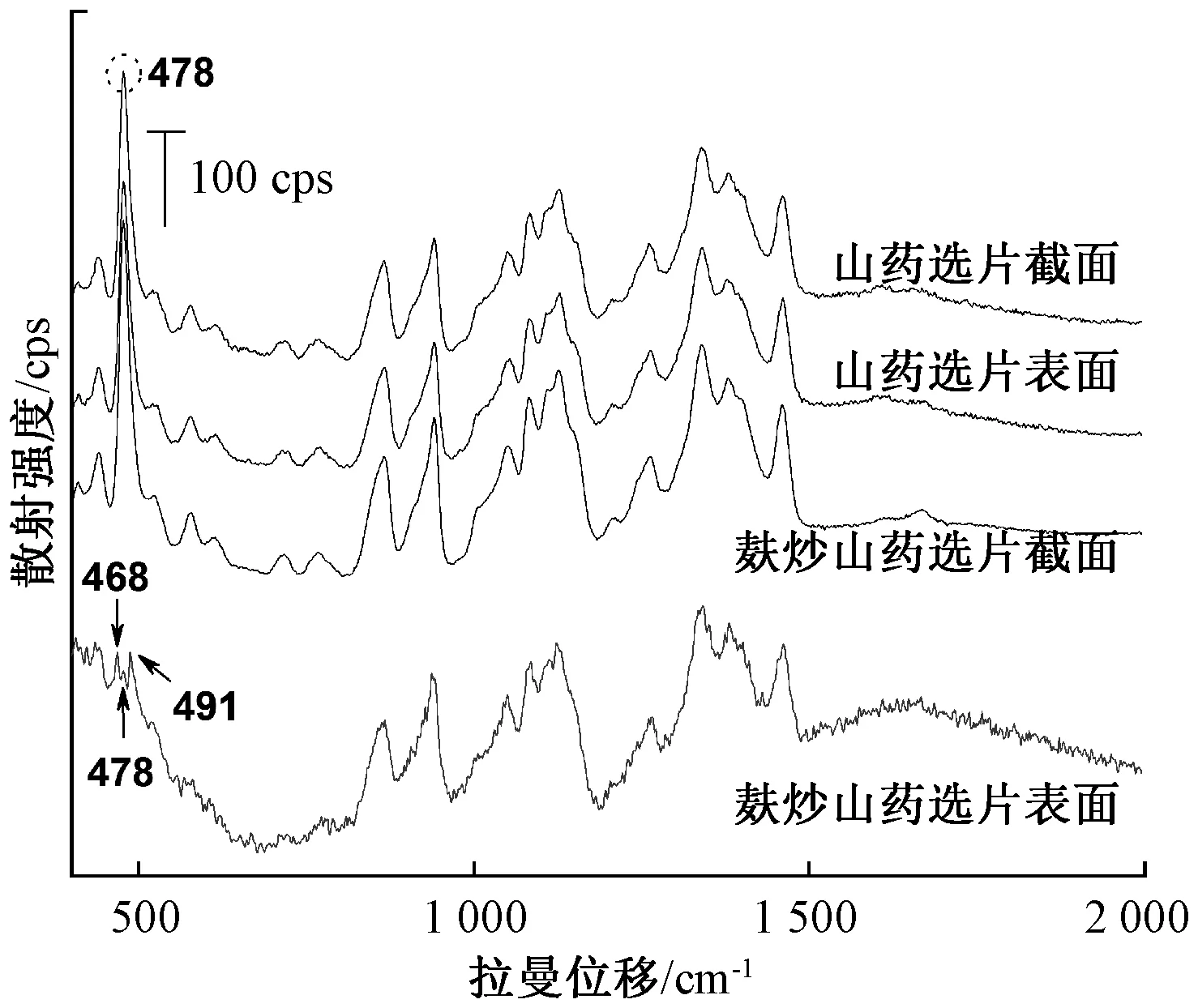
图9 山药统片和麸炒山药统片表面与截面拉曼光谱比较Fig.9 Comparison of Raman spectra obtained on surface and cross-section of common Chinese yam and Chinese yam stir-fried with bran
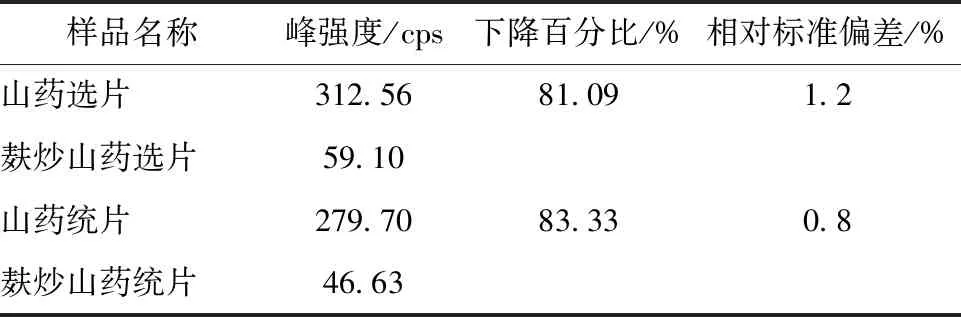
表3 山药与麸炒山药饮片478 cm-1处特征峰强度分析结果(n=6)Tab.3 Analysis results of characteristic peak intensity at 478 cm-1 for Chinese yam and Chinese yam stir-fried with bran(n=6)
3 讨论
本研究对各产地的山药拉曼光谱图分别进行一阶导数、二阶导数转换处理,很难区分不同产地山药的差异。进一步对1 500~400 cm-1指纹区间的峰进行判别分析,可以直观区分广西山药和其他3个产地(河南、河北、安徽)的山药,可能是由于广西和其他3个产地的地域相差较远,气候、地质特点不同。
山药经过麸炒后,在800~400、2 000~1 500 cm-1区域内图谱的背景强度显著升高,这可能是因为山药在麦麸炮制过程中,山药中的氨基化合物(如氨基酸)和还原糖(如葡萄糖)在常温或加热时发生聚合/缩合反应[14](美拉德反应),生成类黑精等褐色物质,使麸炒山药饮片表面颜色加深,干扰了拉曼光谱的测定。另一方面,478 cm-1处的拉曼峰常作为淀粉多糖特征峰,其峰强度反映了多糖的聚合程度,麸炒山药表面478 cm-1处拉曼特征峰的降低,提示山药在麸炒过程中,饮片表面的淀粉多糖发生了降解,且根据峰强度下降程度,初步得知麸炒表面淀粉降解约80%。478 cm-1处拉曼峰的强度变化,可作为山药饮片麸炒过程中的动态变化,以期为麸炒炮制工艺提供动态监测数据。然而麸炒山药饮片的截面却没有出现峰强度的降低,可见麸炒过程中淀粉的一系列反应只存在于表面。
4 结论
本研究对山药的拉曼光谱进行方法学研究,建立了山药拉曼指纹图谱的分析方法,分别对8批山药片特征图谱进行分析,拉曼谱中出现在478、866、941、1 460 cm-1处的强峰,可认为是山药片的特征峰。此外,发现山药与可溶性淀粉的拉曼指纹图谱基本一致,验证了山药根茎部的主要成分是淀粉。关于山药的拉曼光谱研究虽有文献报道[15],但对其炮制后物料性质及主要成分变化的研究甚少。研究表明,山药麸炒前后物料性质存在显著差异,这为两者的质量标准研究提供了依据。该方法不需要任何样品前处理,具有速度快、无损及无污染等特点,是绿色的分析方法,以期为山药及麸炒山药饮片的质量评价标准的制订提供参考。

