腹腔镜经胃腔保留贲门的GIST微创手术治疗
罗云,王伟,罗思静,熊文俊,郑燕生,李金,崔梓铭,朱晓峰,罗立杰
1.广州中医药大学附属北碚中医院外一科,重庆 400700;2.广东省中医院胃肠外科,广东 广州 510120
胃间质瘤在胃肠道间质瘤(gastrointestinal stromal tumor,GIST)中占50%~60%,其中以胃中上部最为多见,R0手术切除是治疗GIST最主要及最有效的治疗方式[1-2]。常见的手术方式有开腹、腹腔镜、内镜下切除术,以及内镜腹腔镜联合切除术。近年来腹腔镜手术的微创性、安全性和有效性得到了越来越多人的认可[3],但对于特殊部位——贲门附近的间质瘤而言,在使病人获益最大化的前提下,合理地选择手术方式对外科医生来说是一个非常棘手的问题。腹腔镜下近端胃大部切除术保证了肿瘤R0切除,可能导致术后反流性食管炎等消化道功能并发症,严重影响术后病人的生活质量。同时,由于贲门附近的GIST暴露及定位比较困难, 不当的腹腔镜楔形切除术很容易造成贲门损伤、狭窄,甚至肿瘤残留的可能[4]。由于GIST起源于固有肌层,生长方式具有不同类型,内镜手术存在完整切除的困难,以及术中肿瘤破裂、穿孔、出血、种植等风险,国内指南建议内镜治疗慎重应用,不作为常规推荐[5-6]。所以贲门部位的间质瘤应当慎重选择手术方式,避免相关的并发症发生。本文对于贲门的间质瘤,应用腹腔镜经胃腔切除(laparoscopic intragastric resection,LIGR)并保留贲门的微创个体化手术治疗,取得了良好的效果,现报告如下。
资料与方法
一、一般资料
回顾性分析2019年2月至2020年6月广东省中医院胃肠外科行LIGR贲门周围GIST 3例的临床资料,病人均为女性,年龄38~61岁,术前诊断措施包括胃镜、超声内镜及腹部增强CT等,见图1。肿瘤均位于胃近端贲门及附近,呈腔内生长型,术前检查及术中探查均无肿瘤破损、出血及转移。本研究经医院伦理委员会审批通过(批件号:ZE2020-298-1),所有病人或授权家属均签署手术知情同意书,手术操作均由同一外科医师组操作。具体临床资料见表1。

表1 腹腔镜经胃腔切除(LIGR)保留贲门的胃肠道间质瘤微创手术病人的临床特征
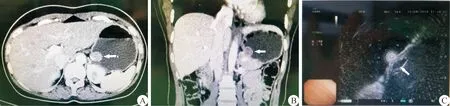
图1 CT影像及内镜超声检查 A.CT显示贲门口处胃腔内肿瘤(箭头所示);B.CT显示贲门周围胃腔内肿瘤(箭头所示);C.内镜超声提示贲门周围固有肌层隆起病灶(箭头所示)
二、手术操作
麻醉成功后,取仰卧分腿位,常规消毒、铺巾,扶镜手站在病人两腿之间,主刀站于病人左侧位。首先于脐上缘偏左侧戳孔1.0 cm,建立观察孔,置入腔镜,探查腹腔内未见异常。然后,分别于左侧肋下缘腋前线、剑突下戳孔0.5 cm、0.5 cm,建立主、副操作孔,在胃体中部分别靠近胃小弯、胃大弯侧悬吊胃壁(图2A),于悬吊周围,用带内芯戳卡直接穿入胃腔,建立胃腔内主、副操作孔(图2B),在胃体远端悬吊胃前壁,胃壁开口约0.8 cm,置入腔镜观察孔(图2C),即完成胃腔内的腹腔手术布孔(图2D)。
于胃腔内,在胃管导引下,距离贲门下缘约0.5 cm,沿肿瘤边缘约0.5 cm处,逐步切除肿瘤(图2E、F),保留贲门周围正常组织,安全顺利地R0切除肿瘤,用3-0倒刺线缝合手术创面(图2H),胃腔内置入标本袋,用标本袋取出GIST(图2I),最后缝合胃腔手术孔(图2J),结束手术。
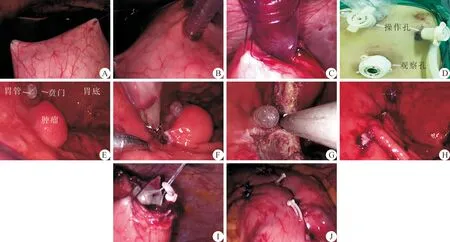
图2 腹腔镜经胃腔切除(LIGR)保留贲门的胃肠道间质瘤(GIST)手术步骤 A.进入腹腔后悬吊胃壁;B.建立主副操作孔;C.置入腔镜观察孔;D.完成胃腔腹腔手术布孔;E.贲门边缘的GIST;F.沿GIST边缘切除肿瘤;G.GIST顺利R0切除;H.缝合手术创面;I.用标本袋取出GIST;J.缝合胃腔手术孔
结 果
手术顺利完成,手术时间为120~180 min,术中出血量为10~80 mL,术后检查肿瘤标本,肉眼见肿瘤完整切除,环周切缘未见肿瘤残留,病人麻醉复苏后返回普通病房。术后第一天开始流质饮食及下床活动。术后病理及免疫组织化学检查均提示:胃肠道间质瘤,镜下见环周切缘阴性,瘤体完整,无破损,无出血坏死,核分裂<5个/50HPF,低危风险度。病人恢复顺利,术后4~6 d出院。病人GIST为低危风险度,术后未进行分子靶向治疗,随访6~22个月,病人无相关并发症,肿瘤无复发或转移,手术结果及预后见表1。
讨 论
一、LIGR对贲门周围GIST治疗的微创化
目前,国内外指南对可切除GIST的外科手术的基本原则主要包括:(1)完整R0切除肿瘤;(2)避免肿瘤破裂;(3)不推荐常规淋巴结清扫;(4)使用“标本袋”取出肿瘤等[7]。在保证手术基本原则的前提下,手术微创化,创伤最小化,减少手术并发症,使病人获益最大化,这也是手术医生不断努力追求的目标。随着腔镜及内镜技术的发展,对于胃体和胃窦的GIST,腹腔镜、内镜及双镜联合切除术均具有一定的微创性、安全性与有效性,但是对于胃贲门及其附近的GIST,由于空间操作受限,技术难度增加时,上述手术方法可能切除更多的胃组织,不能保留贲门,容易造成反流性食管炎或胃腔狭窄,甚至导致肿瘤破裂及切缘阳性等并发症。外科医师应根据肿瘤的大小、位置、生长方式合理选择手术方式,在R0切除的同时,应尽最大可能地保存残胃和贲门的功能,本研究取得了良好的效果。LIGR早在1995年被Ohashi[8]提出用于治疗早期胃部肿瘤,LIGR是将腔镜手术器械穿刺入胃腔,在胃腔内进行腹腔镜手术,然后将切除肿瘤用“取物袋”经穿刺孔取出,最后在腹腔镜下闭合胃穿刺孔。Privette等[9]认为LIGR是适用于胃食管结合部的腔内GIST的微创化手术。LIGR降低了腔镜手术对不利部位胃GIST 的难度,同时并没有没有增加术后残留及局部复发的风险,并降低了手术的并发症[10-12]。
二、LIGR的术前评估及适应证
LIGR由于自身特点,主要适用于贲门周围部位的肿瘤切除,它也存在一定的缺陷,不适用于远端胃幽门、胃前壁的GIST。所以术前应充分评估GIST, 术前充分完善胃镜、CT及超声内镜检查,明确GIST生长部位在贲门及其附近,LIGR手术的适应证:肿瘤生长方式以内生型为主,肿瘤无破溃、出血,为中、低危险度,未发现肿瘤转移,无腹部手术史及严重腹腔粘连。同时,腹腔镜具有放大的优势,只要能保证切缘阴性的R0切除,我们认为距瘤缘仅有0.5 cm就可以达到手术切除的要求。关于GIST的大小,对于≤2 cm的胃小间质瘤,中国临床肿瘤学会(CSCO)胃肠间质瘤指南推荐腹腔镜或内镜切除。而对于>2 cm且<5 cm的胃间质瘤,尤其是胃食管结合部等特殊部位间质瘤,我们认为LIGR手术可以达到很好的治疗效果。而指南不推荐肿瘤直径>5 cm 使用腹腔镜手术[5],但是对于胃黏膜下肿瘤,相关文献报道[13-14]在肿瘤直径>5 cm情况下腔镜手术具有良好的安全性与有效性,对于GIST 大小的手术适用方面仍需要进一步大样本数据验证研究。
三、LIGR的手术方法
LIGR的手术方法如下:(1)手术位置:病人取仰卧分腿位,扶镜手站于病人两腿之间,主刀站在病人左侧位。(2)戳孔选择:观察孔位于脐上缘偏左侧戳孔,主、副操作孔分别于左侧肋下缘腋前线、剑突下戳孔。(3)胃腔内手术布孔:在胃体中部分别靠近胃小弯、胃大弯侧悬吊胃壁,于悬吊周围,用带内芯戳卡直接穿入胃腔,建立主、副操作孔,在胃体远端悬吊胃前壁置入腔镜观察孔。(4)肿瘤切除:确定肿瘤后用超声刀沿肿瘤边沿约0.5 cm 处将胃黏膜切开,同时在贲门口附件置入胃管引导进行LIGR,避免贲门损伤、狭窄,保证肿瘤R0切除,术中避免肿瘤挤压、破损,切除后用可吸收线缝合胃壁。(5)肿瘤取出:扩大观察孔处胃壁切口,用标本袋取出肿瘤。(6)缝合:腹腔镜下缝合穿刺处胃壁,膈下放置负压引流管,再缝合腹壁,结束手术。
四、LIGR的优势性
近年来,腹腔镜与内镜整合为一体的双镜联合切除术,被证实应用于局部GIST手术是安全、高效、微创的[15-16]。虽然腹腔镜手术因微创化优势广泛应用于GIST 的治疗,但也存在一定的不足,包括缺乏精细的触觉反馈,腔内型生长或流体较小时无法精确定位。内镜下对于≤2 cm的内生型GIST有一定优势,但是对于较大或不同类型的GIST,容易导致破损、穿孔、出血等并发症发生。双镜联合技术进行定位、监测、互补或联合切除可以克服以上困难和不足,提高手术疗效,保证手术安全。对于贲门附近的GIST, 双镜联合下也存在局限性,容易导致贲门狭窄或贲门缺失,而LIGR可以最大程度地保留贲门,比双镜联合具有更多优势:(1)胃腔内定位准确,保证肿瘤的R0切除;(2)可以进行胃腔、腹腔缝合,减少穿孔、出血等并发症;(3)最大限度地保留正常的胃组织,降低贲门狭窄,提高保留贲门的可能性;(4)利用腹腔镜代替胃镜,常规的腹腔镜下操作及缝合更加简单、方便、微创化[12]。
五、LIGR的问题与展望
综上所述,对于贲门周围的内生型GIST,LIGR是一种安全、有效、合理、微创的手术方式。可以最大限度地保留正常的胃组织,提高保留贲门的可能性,降低贲门狭窄、穿孔、出血等并发症,LIGR具有在临床中推广应用的潜在价值。但是还需设计大样本量、前瞻性随机对照研究,进一步验证LIGR的手术治疗价值。随着GIST多种治疗模式的建立、手术微创化的发展以及LIGR研究数据的不断完善,相信LIGR手术不仅在贲门GIST 治疗中的应用会获得越来越多的支持,而且可以应用于特殊部位的早期肿瘤病人,使更多的病人最大化受益。

