胰十二指肠切除术前胆道引流病人术后胰瘘及腹腔感染的危险因素分析
杨翼飞,伏旭,毛谅,仇毓东
南京大学医学院附属鼓楼医院肝胆胰中心,江苏 南京 210008
胰十二指肠切除术(pancreaticoduodenectomy,PD)是治疗远端胆管、壶腹部以及胰头周围良恶性肿瘤最有效的方法。胰瘘和腹腔感染是PD术后最常见且危害极大的并发症[1-3]。既往大量研究证实,PD术前胆道引流增加了术后胰瘘和腹腔感染的发生率[4-6]。本研究通过回顾性分析,探讨了PD术前胆道引流与术后出现胰瘘、腹腔感染等并发症的相关危险因素,以期在PD围术期采取有针对性的诊断和治疗措施,控制相关风险因素,降低并发症的发生率。
资料与方法
一、研究对象及纳入排除标准
本研究纳入2018年6月至2020年12月南京大学医学院附属鼓楼医院肝胆胰中心连续收治的86例PD术前行胆道引流的病例,对其临床资料进行回顾性对比分析。根据术后是否出现胰瘘和腹腔感染,分为胰瘘组和非胰瘘组;感染组和非感染组。
纳入标准:(1)年龄>18岁;(2)因远端胆管、壶腹部及胰头良恶性肿瘤行PD术;(3)术前因胆道梗阻行胆道引流;(4)术前至少留取1次胆汁行细菌学检测;(5)临床资料完整。排除标准:(1)术中联合肝脏、结肠等脏器切除;(2)术前行放化疗;(3)合并远处转移或其他部位恶性肿瘤。本研究经南京大学医学院附属鼓楼医院伦理委员会批准(2021-271-01),病人及家属均签署知情同意书。
二、手术方法及围术期管理
本组病例术前胆道引流指征[7-8]:(1)总胆红素≥258 μmol/L;(2)合并急性胆管炎;(3)一般情况差,严重营养不良需长期营养支持。经内镜鼻胆管引流(endoscopic nasobiliary drainage,ENBD)为首选胆道引流方式。常规每周至少留取1次胆汁进行细菌涂片及培养检查。外引流胆汁均通过口服或鼻肠管回输以维持肠肝循环。
本组病例均行根治性PD,术中以Child法进行消化道重建,依次完成胰肠(导管对黏膜,前后壁间断的端侧吻合)、胆肠(前后壁连续缝合)、胃肠吻合(毕Ⅱ式吻合)。术中根据主胰管直径常规放置不可吸收胰管内支撑管。手术结束时于胰肠吻合口前、后方各放置1根凹槽负压引流管。
本组病例均于术前30 min开始应用预防性抗生素至术后48 h。术前胆汁培养阳性但未合并急性胆管炎或术前胆管炎得到有效控制的病例,根据胆汁的药敏结果选择合适的抗生素[9]。其余选择头孢曲松钠作为预防性抗生素[10],生长抑素类似物常规应用至术后7 d。术后1 d、3 d、5 d、7 d常规行抽血化验及留取腹腔引流液检测淀粉酶、细菌涂片、腹水培养,后续间隔3~5 d复查细菌培养等。术后1周行腹部增强CT检查,明确手术区域有无动脉瘤、腹腔积液或感染等,酌情依次拔除腹腔引流管。
术后出现腹腔感染者,根据细菌涂片及培养结果使用治疗性抗生素,若培养结果未出,根据术前胆汁培养结果使用治疗性抗生素;若术前胆汁培养阴性,经验性使用头孢哌酮钠舒巴坦钠(3 g,静滴,Q8h),同时复查腹部超声或CT,保持引流通畅,必要时首选超声引导穿刺引流。术后出现胰瘘病人,保持引流通畅,若连续3 d腹腔引流量小于50 mL,同时复查腹部影像学证实存在无法引流的积液,则行超声引导下腹腔穿刺引流,若引流液出现细菌,及时使用治疗性抗生素。未培养出细菌病人,若怀疑合并感染,即经验性使用抗生素头孢哌酮钠舒巴坦钠(3 g,静滴,Q8h),增加腹水送检频率,后期根据培养结果调整抗菌方案。
三、观察指标及评价标准
观察指标:(1)术前情况:年龄、性别、体质量指数(body mass index,BMI)、术前胆管炎、术前胆汁细菌培养结果、术前血清白细胞计数、C反应蛋白(C-reactive protein,CRP)等实验室检查;(2)术中及术后情况:术中血管重建、胰腺质地、胰管直径、手术时间、术中出血量、术中输血量,术后病理诊断、术后第1天血清白细胞计数及CRP水平,术后胰瘘、腹腔感染的发生情况。
评价标准:(1)胰瘘[11]:参照国际胰腺外科研究组(ISGPS)标准,术后≥3 d任意的腹水引流液中淀粉酶浓度高于正常血清淀粉酶浓度上限3倍以上,并导致临床决策改变或需介入及手术治疗者定义为胰瘘,生化漏已经不属于胰瘘,本研究中胰瘘指的是B/C级胰瘘。(2)腹腔感染[12-13]:符合下列标准之一即可诊断:①术后出现全身感染症状(发热、血清白细胞计数高于正常值上限),并伴有腹胀、腹部压痛、反跳痛及肌紧张等腹膜炎体征;②腹腔引流液或穿刺引流液为脓性液体,细菌学培养结果呈阳性;③B超、CT等影像学检查显示或再次手术证实腹腔内存在渗出或包裹性脓肿等。
四、统计学方法
结 果
一、临床资料
本组86例中男性53例,女性33例;中位年龄为64岁,年龄范围为23~82岁。在术后并发症方面,最常见的是胰瘘和腹腔感染,各有37例,其中25例病人合并有胰瘘及腹腔感染;其次是胃排空障碍25例,乳糜瘘15例,腹腔出血9例,胆瘘3例,切口感染3例;Clavien-Dindo≥Ⅲ级[14]的严重并发症23例。在细菌培养方面,59例术前胆汁培养阳性,其中常见的致病菌包括:肺炎克雷伯杆菌(20例),粪肠球菌(10例),阴沟肠杆菌(5例),屎肠球菌(4例)等。
二、PD术前胆道引流与术后胰瘘的相关危险因素分析
单因素分析结果显示:与非胰瘘组比较,胰瘘组术前血清白细胞计数、术后第1天血清白细胞计数、术后第1天CRP水平、术前胆汁中肺炎克雷伯杆菌的检出率有所升高,差异有统计学意义(P<0.05),见表1。多因素分析结果显示:术前胆汁培养检出肺炎克雷伯杆菌、术后第1天血清白细胞计数升高是出现术后胰瘘的独立危险因素,见表2。术后第1天血清白细胞计数的最佳截断值为10.9×109/L,此时敏感度为0.838,特异度为0.551。

表1 胆道引流病人胰十二指肠切除术后发生与未发生胰瘘的相关资料单因素分析

表2 影响胆道引流病人胰十二指肠切除术后发生胰瘘的多因素分析
三、PD术前胆道引流与术后腹腔感染的相关危险因素分析
单因素分析显示:与非感染组比较,感染组病人术后第1天血清白细胞计数水平显著高于非感染组(P<0.05);感染组中术前胆汁的肺炎克雷伯杆菌、铜绿假单胞菌的检出率有所增加,但差异没有统计学意义(P>0.05),见表3。多因素分析结果显示:术前胆汁培养检出肺炎克雷伯杆菌、术后第1天血清白细胞计数升高是出现术后腹腔感染的独立危险因素,见表4。术后第1天血清白细胞计数的最佳截断值为15.8×109/L,此时敏感度为0.486,特异度为0.918。

表3 胆道引流病人胰十二指肠切除术后发生腹腔感染的相关资料单因素分析
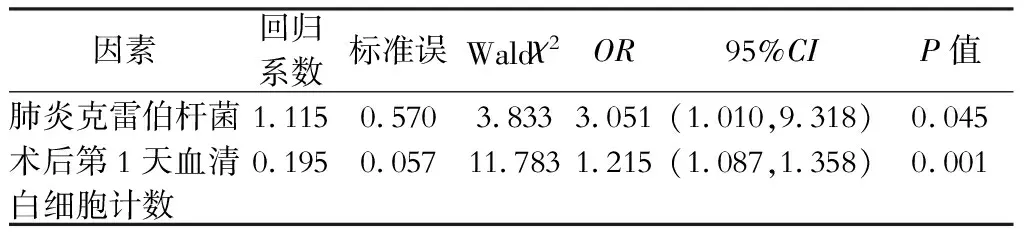
表4 影响胆道引流病人胰十二指肠切除术后发生胰瘘的多因素分析
四、PD术前胆道引流与术后胰瘘合并腹腔感染的相关危险因素分析
单因素分析显示:与对照组比较,胰瘘合并感染组病人术前血清白细胞计数、术后第1天血清白细胞计数、术前胆汁中的肺炎克雷伯杆菌、铜绿假单胞菌检出率显著高于非感染组(P<0.05),见表5;多因素分析结果显示:术后第1天血清白细胞计数、术前胆汁培养检出肺炎克雷伯杆菌是出现术后出现胰瘘合并腹腔感染的独立危险因素,见表6。术后第1天血清白细胞计数的最佳截断值为11.0×109/L,此时敏感度为0.920,特异度为0.461。

表5 胆道引流病人胰十二脂肠切除术后发生胰瘘合并腹腔感染的相关资料单因素分析
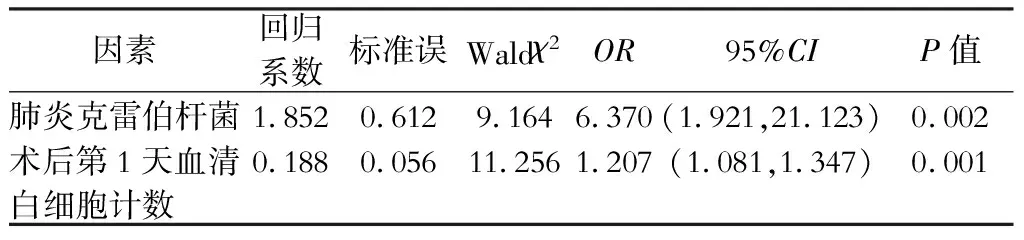
表6 影响胆道引流病人胰十二指肠切除术后发生胰瘘合并腹腔感染的多因素分析
讨 论
PD是治疗远端胆管、十二指肠、胰头及壶腹部良恶性病变最为积极有效的手段。但是,PD技术难度大,术后并发症发生率高,其中以胰瘘与腹腔感染最为多见。文献报道胰瘘的发生率为10%~27%[2,15],腹腔感染的发生率为25%~39%[16-18]。胰瘘、腹腔感染的发生将导致住院时间延长、术后辅助治疗推迟、住院费用增加等。长期的临床实践表明,术前胆道引流可以通过改善肝功能,维持胆汁肠肝循环,恢复肠道菌群组成从而降低术后感染等并发症的风险[19]。但近年来,越来越多的研究发现PD术前胆道引流增加了术后腹腔感染等并发症的发生率[8,20-21]。因此,分析和研究PD术前胆道引流与术后并发胰瘘、腹腔感染的相关危险因素,有助于对高危病人进行早期识别并积极干预,最终改善PD的临床效果。
本研究首先对2018年6月至2020年12月南京大学医学院附属鼓楼医院肝胆胰中心连续收治的86例PD术前行胆道引流病例的临床资料进行了总结,发现本组病例术后胰瘘的发生率为43.0%,腹腔感染的发生率为43.0%,胰瘘合并腹腔感染的发生率为29.1%,均高于既往研究结果[2,16]。分析原因考虑本研究所纳入的均是PD术前行胆道引流病例,而既往研究往往将包括未行PD术前胆道引流的病例一并纳入,这也使本研究更具有针对性。临床上常规采用的内镜逆行胰胆管造影(ERCP)等胆道引流操作,不同程度地影响了Oddi括约肌的正常结构与功能,可能使消化液反流进入胆道并形成细菌定植,增加胆汁感染的风险。文献[21-23]报道上述操作可能直接导致术后腹腔感染的发生,诱发胰瘘的进展。胰腺质地、胰管直径均被普遍认为是PD术后胰瘘的危险因素[11],而在本研究中两者均与术后胰瘘的发生无直接相关。分析其原因考虑本研究所纳入的样本量偏小,且胰腺癌病人只占20.9%。而胰腺癌或慢性胰腺炎常伴有胰腺质地变硬、胰管扩张等改变,胰腺外分泌功能降低,行胰肠吻合时难度降低,术后胰瘘、腹腔感染发生率较低。
本研究对86例PD术前胆道引流病例的实验室检查资料进行了回顾性分析,发现术前胆汁培养检出肺炎克雷伯杆菌、术后第1天血清白细胞计数升高是术后出现腹腔感染、胰瘘以及胰瘘合并腹腔感染的独立危险因素。国内多项研究均证实血清白细胞计数在腹腔感染、胰瘘的预测中具有价值[24-25]。Pitiakoudis等[26]对215例梗阻性黄疸病例进行回顾性分析时发现:高龄(>70岁)、恶性肿瘤、白细胞计数>15×109/L、发热(>38.5 ℃)、红细胞比容≤0.30、肌酐>1.3 mg/dL(114.9 μmol/L)、白蛋白<3 g/dL(30 g/L),以及血清碱性磷酸酶>100 U/L是PD术后胰瘘、腹腔感染等并发症的相关危险因素。还指出同时存在7个及以上危险因素的病人,术后死亡率高达100%。一项纳入158例行胰体尾联合脾脏切除病例的研究发现[27],术后第3天血清白细胞计数>16×109/L或血清白细胞计数较术前升高9×109/L与术后并发症显著相关。白细胞在人体免疫中发挥重要作用,参与了体内多种病理生理过程,其异常升高在一定程度上反应了全身及腹腔内的炎症状态,是临床上常用的诊断感染的指标,因此应用白细胞计数这一炎性指标在早期预测术后胰瘘、腹腔感染可能有着重要的价值。目前白细胞等炎症指标预测胰瘘的机制尚未完全明确,推测与胰瘘腐蚀吻合口周围组织引起严重的局部或全身炎症反应,同时导致肠道菌群移位,诱发早期腹腔感染,均可引起炎症指标的升高[25]。胰瘘与腹腔感染可互为因果,并互相影响。当PD术后出现胰瘘时,胰液可在腹腔内的积聚,刺激并腐蚀周围组织,是并发感染的高危因素。同时,病人术后的免疫力下降、肠道细菌移位均是诱发腹腔感染的直接或间接因素。当出现腹腔感染时,胰液中的胰蛋白酶原可被细菌产生的磷脂酶以及脂多糖所激活,胰酶的激活会导致周围组织的腐蚀并进一步促进腹腔感染的进展和扩散[28-31]。
纳入本研究的病例中,肺炎克雷伯杆菌检出率最高(20/86,23.3%)。多因素分析表明,肺炎克雷伯杆菌是PD术前胆道引流病人并发胰瘘、腹腔感染的独立危险因素。根据CHINET中国细菌耐药性监测网的数据显示[32-33],肺炎克雷伯杆菌的临床检出率以及耐药率呈逐年升高趋势,当前已成为胆道感染的主要致病菌之一。国外有研究发现[34],PD术后胰瘘的病例,肺炎克雷伯杆菌在胰液、胆汁、粪便中的检出率均显著增加。Okano等[35]的研究发现,PD术前胆道引流病例的胆汁中肺炎克雷伯杆菌的检出率达26.6%,如果术前出现细菌性胆汁将显著增加PD术后胰瘘以及感染性并发症的发生率。脂多糖作为肺炎克雷伯杆菌的毒力因素之一,能够激活胰液中的胰蛋白酶原,从而促进PD术后胰瘘的发生发展。同时其具有获得多种抗生素耐药性基因的能力,产生水解β-内酰胺类物质的酶,这导致其对大部分β-内酰胺类抗生素耐药,使得预防性抗生素效果不佳[36],诱使腹腔感染的发生与扩散。因此建议PD术前胆道引流时,应常规留取胆汁行细菌培养,以指导后续抗生素使用。
目前,国内外关于PD术前胆道引流病人术后出现胰瘘及腹腔感染危险因素的研究相对较少。因此,本研究搜集了相关病例的临床和实验室资料进行了回顾性分析,揭示了PD术前胆道引流病人术后发生胰瘘、腹腔感染的危险因素。其中,术前胆汁培养检出肺炎克雷伯杆菌对于胰瘘、腹腔感染的发生至关重要。结合本中心的临床经验,笔者认为:(1)应充分认识术前胆道引流的PD病例,术后胰瘘、腹腔感染的发生率高于常规PD的临床特征,因此围术期应提高警惕,加强监控。(2)应常规留取术前胆道引流的胆汁,监测其中病原菌的变化。我们的经验是将外引流胆汁予以回输以维持肠肝循环,保护肠道黏膜屏障,防止出现肠道菌群移位及肠源性感染。(3)若病人术前胆汁培养呈阴性,可考虑三代头孢作为预防性抗生素;当胆汁培养呈阳性,则应根据药敏结果选用敏感抗生素。(4)术中应重视精细化操作,避免胆汁等消化液污染腹腔;术后密切监测体温、血清白细胞计数,以及相关感染指标。同时连续、主动性留取腹腔引流液送细菌学检查,监测其培养结果及变化;一旦出现胰瘘或腹腔感染,应积极复查CT、超声等腹部影像学,通畅引流;在获得确定性细菌学结果前,积极地经验性使用广谱抗生素,以后根据相关引流液药敏结果调整抗生素使用,以达到最佳治疗效果。
综上,PD术前胆道引流病人术后并发胰瘘、腹腔感染的概率较高。术前胆汁培养检出肺炎克雷伯杆菌、术后第1天血清白细胞计数升高是PD术前胆道引流术后并发胰瘘及腹腔感染的独立危险因素。本研究结果为早期识别高危病例,采取有针对性的诊断和治疗措施提供了有价值的临床依据。

