结直肠恶性息肉的病理诊断要点
汪春年,方虹斐,周晓军
结直肠息肉是较为常见的疾病,大多数息肉为腺瘤。在结肠镜检查中,腺瘤的发病率为24%~48%。大部分结直肠癌是由腺瘤发展而来,随着结肠镜技术的发展,越来越多的结直肠肿瘤在早期得到诊治。结直肠肿瘤内镜切除标本的精准病理评估,尤其是恶性息肉的精准评估,对患者的后续治疗、预后起至关重要的作用。本文现就近年恶性息肉病理诊断中的相关问题作一综述。
1 恶性息肉的概念及形态
恶性息肉常表现为有蒂或无蒂的息肉样病变,根据肿瘤的TNM分期即为pT1期息肉状早期结直肠癌[1]。恶性息肉的组织学形态,一般是在高级别腺瘤的背景上(如肿瘤细胞出现细胞核复层排列、细胞质黏蛋白的丢失、核染色质增粗、泡状核,核仁明显,腺体出现不规则分支、出芽和筛状结构等),局部发展为浸润性癌,浸润至肠壁的黏膜下层或息肉头部/颈部黏膜下间质内。恶性息肉、腺瘤癌变及早期结直肠癌间的差异详见表1。欧洲国家在结直肠癌早期筛查项目中发现,pT1期早期结直肠癌约占17%,局部切除术后发展为进展期癌的风险为0.6%[2]。

表1 恶性息肉、腺瘤癌变及早期结直肠癌的差异
2 恶性息肉病理学评估内容
恶性息肉的组织学类型和癌的范围对临床的后续治疗、随访具有重要影响。恶性息肉的诊断需要肿瘤细胞穿透黏膜肌进入黏膜下层。除了确定恶性息肉的诊断外,报告浸润性癌成分的大小、有无淋巴管血管的侵犯、肿瘤分化程度、肿瘤出芽情况、癌距切缘的距离、肿瘤细胞进入黏膜下层的深度,以及错配修复蛋白和BRAF有无突变等非常重要。在大体描述中应该注明息肉的完整性,因为在息肉破碎的情况下,对切缘的评估、浸润程度的评估可能不准确。研究发现,恶性息肉一些病理特征与淋巴结受累、复发和转移的风险有良好的相关性[3]。
2.1 病变类型恶性息肉组织学类型均以早期胃癌的标准进行分类[4],即以病变的高度及形状为标准,将恶性息肉分为:隆起型(0~Ⅰ型)、浅表型(0~Ⅱ型);0~Ⅰ型又分为有蒂型(0~Ⅰp型)、亚蒂型(0~Ⅰsp型)和无蒂型(0~Ⅰs型);0~Ⅱ型又分为浅表隆起型(0~Ⅱa型)、浅表平坦型(0~Ⅱb型)、浅表凹陷型(0~Ⅱc型)。随着结直肠肿瘤诊断学的进展以及结直肠肿瘤治疗技术的不断改进,仅以病变高度及形状为标准的分类,已难以作为选择治疗方案的证据。新分类在原来的基础上增加了侧方发育型(laterally spreading tumor, LST)。LST 是指直径大于10.0 mm,以侧方发育为主的肿瘤;其中表面没有颗粒及结节者称为非颗粒型LST肿瘤,反之则称为颗粒型LST肿瘤[4]。
2.2 血管、淋巴管侵犯正常情况下,黏膜下浅层及黏膜肌层可见淋巴管,淋巴管很少延伸到黏膜固有层(或仅少量存在隐窝的基底部),故黏膜内癌一般不会发生淋巴结转移。腔内缺乏红细胞的内皮细胞衬覆的管腔内如有肿瘤细胞,可视为淋巴管侵犯。D2-40是淋巴管较为特异的标志物。静脉侵犯与淋巴结转移及预后相关,在不确定的情况下,可予以弹力纤维染色协助判断静脉侵犯。脉管侵犯有时难以与组织收缩间隙鉴别,可辅以CD31、CD34等内皮细胞标志物鉴别。
2.3 水平切缘和垂直切缘关于切缘阳性的定义目前尚未达成共识,不同学派间存在三种观点:肿瘤距切缘距离小于1 mm、肿瘤距切缘距离小于2 mm、切缘电灼伤处见肿瘤。因此,建议在报告中注明肿瘤距切缘距离的具体数值,以供临床参考。破碎的内镜切除标本伴水平切缘阳性,原位复发的危险性增加,6个月后可进行内镜随访监测。
2.4 肿瘤出芽其定义为在肿瘤的浸润前缘出现单个瘤细胞或小于5个细胞的肿瘤细胞簇。肿瘤芽的评估是在热点区域,计数1个中倍视野(0.785 mm2)中肿瘤芽的数目。根据肿瘤芽的数目,分为3级,分别为G1:<5个;G2:5~9个;G3:≥10个。研究发现高级别肿瘤出芽是结直肠癌、恶性息肉淋巴结转移的重要预测因子[5]。
2.5 浸润深度Haggitt等[6]将有蒂恶性息肉的侵袭程度分为1~4级。1级:浸润性腺癌局限于息肉头部;2级:颈部受累;3级:茎部见腺癌细胞;4级:腺癌细胞浸润到邻近肠壁黏膜下层。根据黏膜下浸润的深度,将无蒂腺瘤的黏膜下浸润程度分为三个等级:当黏膜下层浸润不足1/3为sm1;超过2/3为sm3;sm2为中间阶段,肿瘤浸润至中间1/3[6-7]。无蒂恶性息肉的病理诊断报告中,有明确黏膜肌时,浸润深度从黏膜肌下缘测量至黏膜下肿瘤浸润最深处;黏膜肌不明确时,从肿瘤表面测量至浸润最深处[8]。
2.6 低分化肿瘤巢其是指肿瘤间质内≥5个癌细胞形成的癌巢,且无腺管样结构。目前,低分化肿瘤巢的评估也缺乏统一的分级标准,一般是在热点区域,计数1个中倍视野(0.785 mm2)中低分化肿瘤巢的数目[9-11]。根据低分化肿瘤巢的数目分为3级,分别为G1:<5个;G2:5~9个;G3:≥10个。低分化肿瘤巢的级别越高,淋巴结转移率越高;低分化肿瘤巢级别与患者预后呈明显的相关性[9-11]。
3 恶性息肉诊断中的误区
恶性息肉诊断中最大的陷阱是黏膜肌层下方腺体假浸润/错位(pseudoinvasion/epithelial misplacement, PEM),导致恶性息肉的误诊和过诊。伴PEM的息肉多为大而有蒂的病变,通常位于乙状结肠,较少出现在直肠[12-13]。一般认为是息肉柄扭曲时黏膜内上皮向黏膜下层疝出而引起的,常伴出血、含铁血黄素沉积[14]。内镜下较难鉴别腺瘤伴PEM或伴浸润性癌,由于伴PEM的腺瘤不会引起远处转移,故在病理诊断时要将两者进行鉴别[15]。
PEM的病理特征:腺体细胞学形态与表面腺瘤上皮形态相似,常与正常腺体混合,无恶性细胞学特征;黏膜下上皮巢边界清楚,可含有固有层成分;常见出血及含铁血黄素沉积;间质一般无促纤维反应(图1);可伴边缘规则的无细胞黏液池(图2A);通过连续切片可以发现PEM上皮与表面上皮在三维空间中是相连续的。部分病例黏膜下可见囊肿形成,囊内充满丰富的黏蛋白,囊肿周围有纤维肉芽组织及不规则的纤维分隔。腺瘤性上皮通常位于黏液池的边缘,而不是漂浮在黏液池内,这些特征可与黏液腺癌鉴别(图2B)。浸润性癌的上皮常伴高级别异型增生和间质促纤维反应;可伴黏液池形成,但通常这些黏液池显示不规则的边界,黏液池内常见孤立的异常细胞(图2C)。
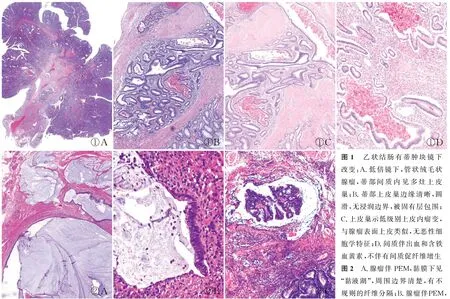
①A①B①C①D②A②B②C图1 乙状结肠有蒂肿块镜下改变:A.低倍镜下,管状绒毛状腺瘤,蒂部间质内见多灶上皮巢;B.蒂部上皮巢边缘清晰,圆滑,无浸润边界,被固有层包围;C.上皮巢示低级别上皮内瘤变,与腺瘤表面上皮类似,无恶性细胞学特征;D.间质伴出血和含铁血黄素,不伴有间质促纤维增生图2 A.腺瘤伴PEM,黏膜下见“黏液湖”,周围边界清楚,有不规则的纤维分隔;B.腺瘤伴PEM,腺瘤上皮位于黏液池的边缘,而不是漂浮在黏液池内,可与黏液腺癌鉴别;C.黏液腺癌,黏液湖内见异型腺体,为真性浸润
PEM也可见于其他病变,如Peutz-Jeghers息肉、增生性息肉、黏膜脱垂、憩室、气孔等[16-18]。无蒂锯齿状病变(无蒂锯齿状腺瘤/息肉)中,上皮成分可通过淋巴腺复合体进入黏膜下,易误诊为浸润(图3)。
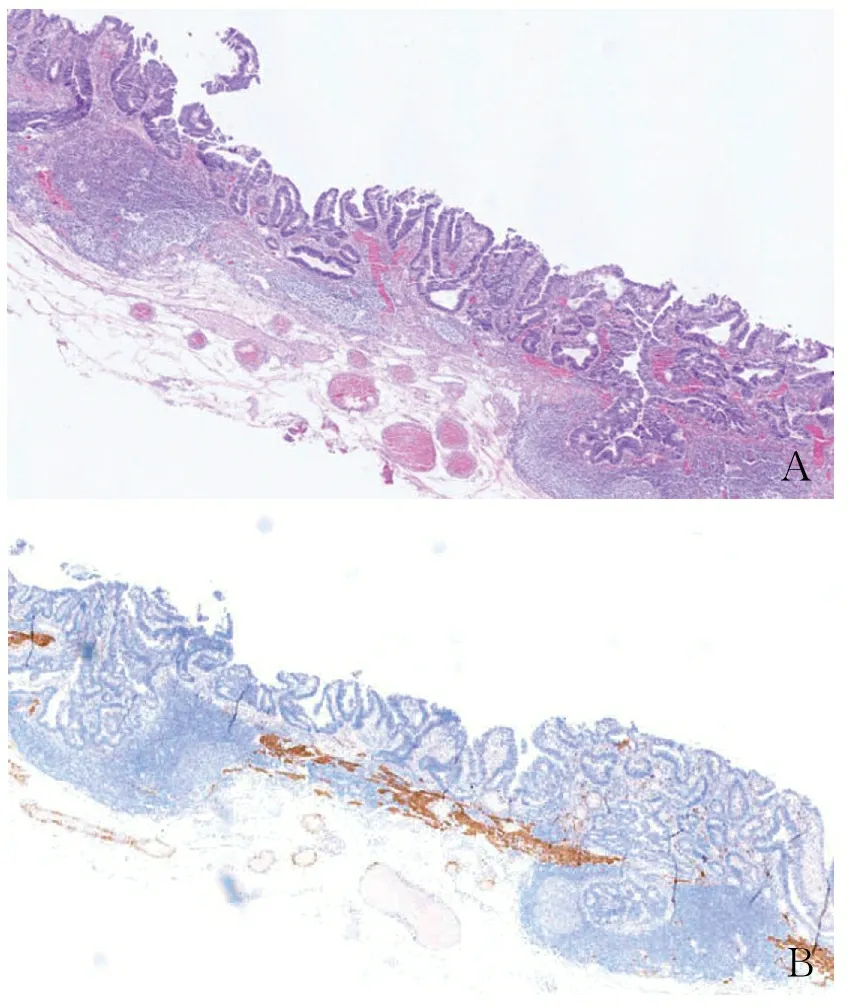
AB
有研究发现,免疫组化标记MMP-1、p53、Ⅳ型胶原蛋白和E-cadherin有助于鉴别PEM和浸润性癌[14-15]。但在少数情况下并不特别有用[15],主要还是要依赖于形态学的判断。
4 总结
结直肠恶性息肉病理报告除了需明确恶性息肉的组织学类型外,还应注意描写与预后不良相关的病理学特征,如浸润性癌成分的大小、淋巴管血管侵犯情况、肿瘤分化程度、肿瘤芽分级、低分化肿瘤巢分级、肿瘤浸润至黏膜下层的深度,以及微卫星不稳定性、BRAF相关基因的检测情况等,对临床治疗具有重要的指导意义。少数良性息肉状病变也可以伴发PEM,当PEM的腺上皮伴有高级别异型增生时,较难与浸润性癌鉴别,可借助连续切片、免疫组化检测等进行鉴别,必要时请多个专科病理专家共同探讨。

