弥漫大B细胞淋巴瘤中C-MYC、BCL-2和BCL-6基因异常与临床病理意义
常玉清,方建晨,冯蔚鹰,陈海仁,丁 祺,冯砺锦,葛 荣
弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)是常见的非霍奇金淋巴瘤(non-Hodgkin lymphoma, NHL),约占我国成人淋巴瘤的40%。依据其免疫组化和基因特征,将其分为GCB型和non-GCB型[1]。70%的DLBCL患者可通过实用蒽环类药物化疗获得缓解,但只有50%~60%的患者可实现长期无瘤生存,不同患者对药物反应差异较大[2]。近年,随着基因技术的不断发展,研究者发现某些基因的异常表达对DLBCL的发生、发展、预后等具有重要影响。FISH检测C-MYC基因易位同时伴BCL-2或BCL-6基因易位的DLBCL称为双重打击淋巴瘤(double-hit lymphomas, DHL),三种易位同时发生则称为三重打击淋巴瘤(triple-hit lymphomas, THL)[3]。如果仅检测蛋白过度表达而无基因易位,则称为双表达淋巴瘤(double-expressor lymphoma, DEL)。DLBCL中DHL和THL恶性程度更高,预后更差[4]。本研究采用免疫组化染色及FISH检测205例DLBCL中C-MYC、BCL-2和BCL-6蛋白表达和基因易位情况,探讨三者与DLBCL临床病理特征的关系,为患者治疗和预后评估提供依据。
1 材料与方法
1.1 临床资料收集2011年11月~2020年4月上海市静安区市北医院病理科、上海交通大学附属仁济医院病理科、宁波市临床病理诊断中心及上海同济大学附属第十人民院病理科确诊的205例DLBCL,均符合WHO(2016)造血和淋巴组织肿瘤分类的诊断标准,有完整的病理资料。本实验经医院伦理委员会审批,患者均知情同意。
1.2 免疫组化及原位杂交标本均经10%中性福尔马林固定,脱水,石蜡包埋,3 μm厚连续切片,分别行HE及免疫组化EnVision法染色及EBER原位杂交。采用罗氏Benchmark XT Ventanna全自动免疫组化仪染色,抗体C-MYC、BCL-2、BCL-6均购自DAKO公司。阳性率以阳性细胞占肿瘤细胞百分比计算,所有切片均由两名高年资病理医师共同阅片。肿瘤组织中C-MYC阳性细胞数≥40%、BCL-2阳性细胞数≥50%、BCL-6阳性细胞数≥30%为染色阳性[5]。
1.3 FISH法根据HE染色选择肿瘤区域,采用双色荧光原位杂交检测。C-MYC、BCL-2和BCL-6双色分离探针,均购自美国Vysis公司,实验步骤严格按试剂盒说明书进行。使用Zeiss Axioimager荧光显微镜在高倍视野(100×)记录至少100个肿瘤细胞核信号。探针均由红色荧光探针和绿色荧光探针两部分组成,正常细胞显示2个黄色融合信号或紧邻的2个红绿信号,基因易位显示1个黄色信号和1红1绿分离信号,当分离信号比例>10%时判为阳性,同一细胞核内黄色融合信号≥3个为基因多拷贝。
1.4 统计学分析采用SPSS 20.0软件进行统计学分析;等级资料采用秩和检验与χ2检验,当不满足χ2检验条件时,采用Fisher确切概率法比较临床病理特征的计数资料。应用Kaplan-Meier法分析患者的生存曲线,采用Log-rank检验比较各组间的生存率是否存在差异。以P<0.05为差异有统计学意义。
2 结果
2.1 临床特征205例DLBCL中男性106例,女性99例,男女比为1.07 ∶1。患者发病年龄18~93岁,中位年龄60岁,平均49.6岁;<60岁者99例,≥60岁者106例。有随访资料者171例,随访时间8~107个月,死亡48例,病死率为28.1%。
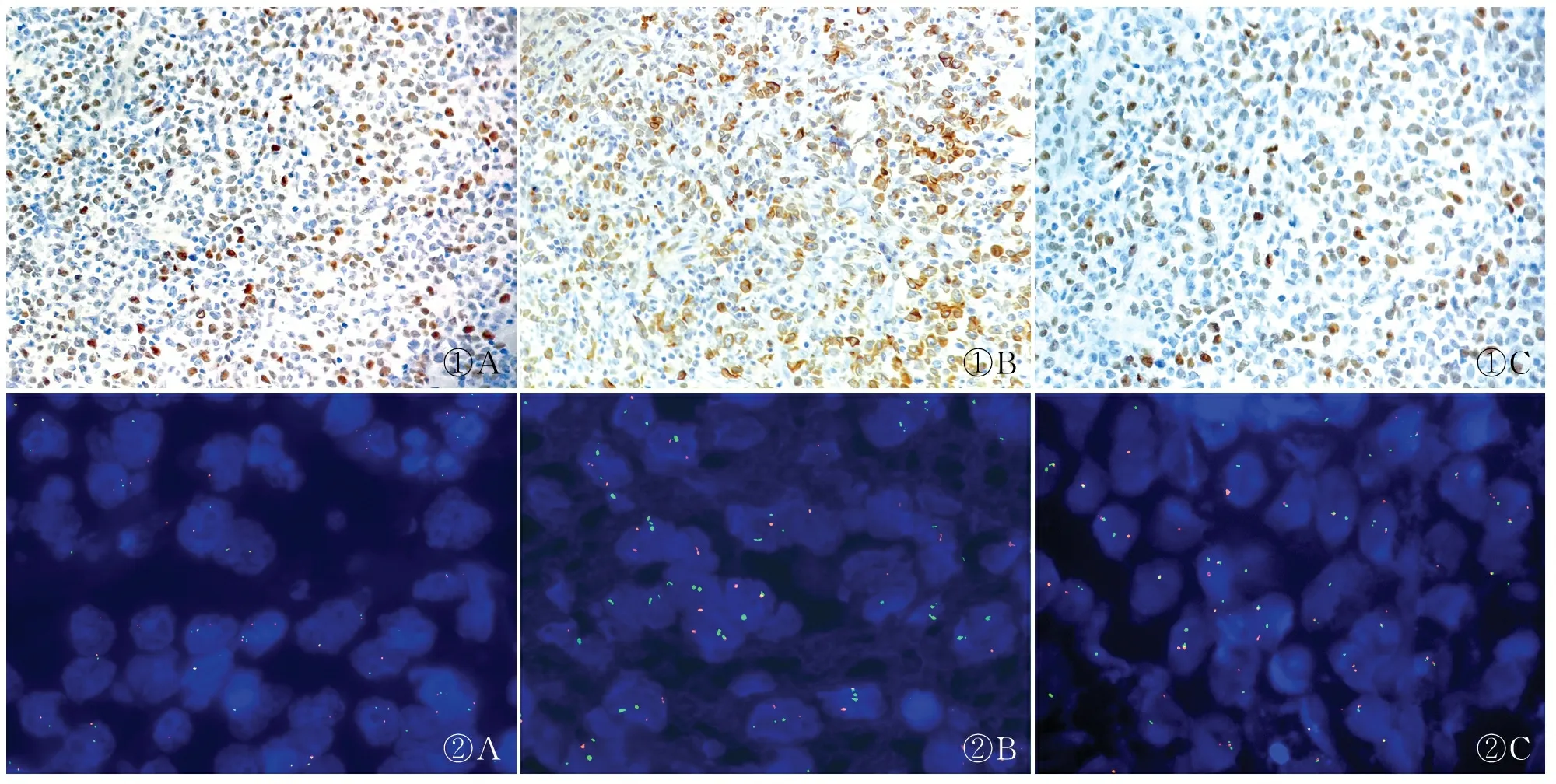
2.2 免疫表型及原位杂交C-MYC和BCL-6阳性染色定位于细胞核内,BCL-2阳性染色定位于胞质及胞膜(图1)。本组按Hans分型有76例GCB型(37.1%),129例non-GCB型(62.9%)。根据C-MYC与BCL-2的表达,将患者分为双表达组91例(44.4%)及普通组114例(55.6%)。双表达组GCB型患者比例为28.5%(26/91)低于普通组的43.8%(50/114),差异有统计学意义(P<0.05)。本组DHL和THL合计5例(2.44%,5/205),2例为DHL、3例为THL,与普通组相比差异有统计学意义(P<0.05);两组患者年龄及性别差异均无统计学意义(表1)。EBER原位杂交阳性位于细胞核内,呈棕褐色、棕黄色或浅黄色。本组病例EBER原位杂交均阴性。

表1 DLBCL中双表达组与普通组临床资料比较
2.3 C-MYC基因易位检测本组205例DLBCL中有204例行C-MYC基因易位检测,其中19例(9.3%)检测有C-MYC易位(图2A);其中双表达组17例,普通组2例。GCB型中C-MYC易位占12.0%(9/75),non-GCB型中C-MYC易位占7.8%(10/129),差异无统计学意义。C-MYC易位患者中男性7例(7/106,6.6%),女性12例(12/98,12.2%);<60岁者9例(9/102,8.8%),≥60岁者10例(10/102,9.8%),不同年龄和性别组的C-MYC易位差异无统计学意义(表2)。上述结果表明C-MYC易位与分组有关(P<0.001),与Hans分型、年龄和性别无明显相关性(P>0.05)。

表2 C-MYC基因易位情况比较
2.4 BCL-2基因易位检测本组有182例患者接受BCL-2基因易位检测,发现16例BCL-2易位(图2B),其中双表达组12例,普通组4例,两组间差异有统计学意义(P=0.017);GCB型患者12例(12/70,17.1%),non-GCB型4例(4/112,3.6%),两组之间差异有统计学意义(P=0.02,表3)。男性7例(7/96,7.3%),女性9例(9/86,10.5%);<60岁者7例(7/89,7.9%),≥60岁者9例(9/93,9.7%),BCL-2基因易位的年龄及性别差异均无统计学意义。
①A①B①C②A②B②C

表3 BCL-2基因易位情况比较
2.5 BCL-6基因易位检测本组179例患者接受BCL-6基因易位检测,有54例(30.16%)检测到BCL-6易位(图2C)。其中双表达组29例,普通组26例;GCB型患者17例(17/70,24.3%),non-GCB型37例(37/109,33.9%),两组之间的差异无统计学意义(P=0.186,表4)。BCL-6易位男性26例,女性28例;<60岁者26例,≥60岁者28例;BCL-6易位在年龄及性别间的差异均无统计学意义(P>0.05,表4)。

表4 BCL-6基因易位情况比较
2.6 DHL或THL的临床病理特征本组有2例DHL、3例THL,年龄37~67岁,平均58.4岁,中位年龄65岁,占所有患者的2.44%(5/205)。5例患者中GCB组有4例,包括1例DHL(BCL-2+C-MYC)和3例THL;non-GCB组有1例DHL(BCL-2+C-MYC)。其中1例患者C-MYC基因拷贝数>3,其余4例基因拷贝数均<3。但因可统计拷贝数的样本较少,无统计学意义。
2.7 DLBCL临床病理特征与肿瘤基因易位、患者预后的关系本组结果显示:肿瘤分型与患者预后明显相关,GCB型的预后明显好于non-GCB型(P<0.01,图3A);与<60岁者相比,年龄≥60者生存率明显降低,差异有统计学意义(P<0.01,图3B)。双表达组及DHL/THL组总体预后低于普通组(图3C、D);而患者性别及C-MYC、BCL-6、BCL-2基因易位与预后无相关性(图3E~H)。
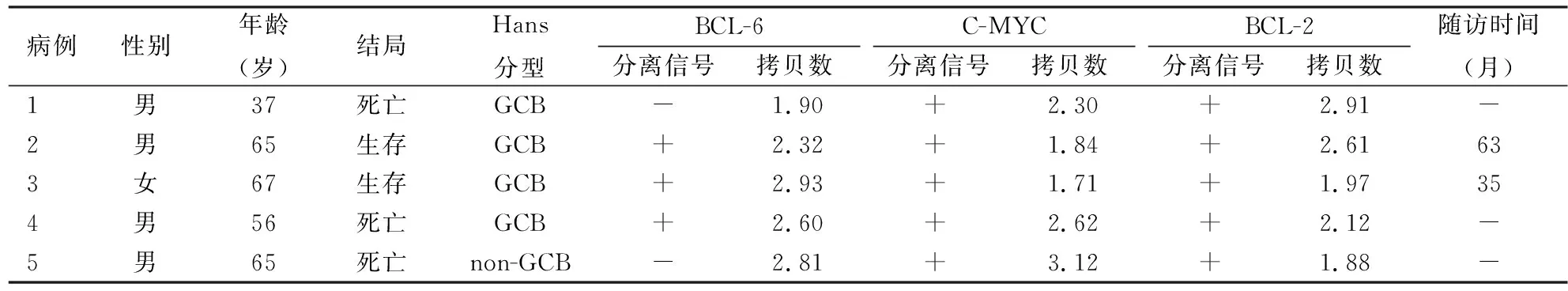
表5 DHL或THL的临床病理特征
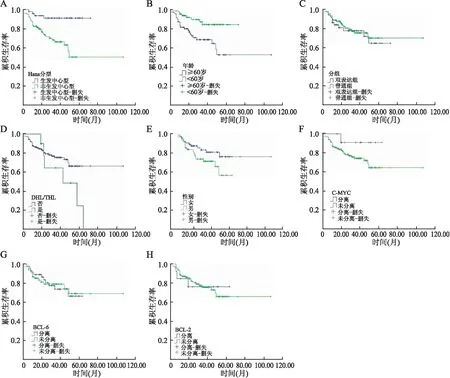
图3 A.Hans分型与患者生存期的关系;B.患者年龄与生存期的关系;C.患者分组与生存期的关系;D.DHL/THL与患者生存期的关系;E.患者性别与患者生存期的关系;F.C-MYC基因易位与患者生存期的关系;G.BCL-6基因易位与患者生存期的关系;H.BCL-2基因易位与患者生存期的关系
3 讨论
DLBCL是成人常见的淋巴瘤,约占新发NHL的1/4[6]。近年全球NHL发病率每年以2%~4%的速度增长[7],其中以DLBCL多见。DLBCL异质性强,具有复杂的基因改变,C-MYC、BCL-2及BCL-6基因改变对治疗及预后具有重要影响[8]。
C-MYC是一类转录调节因子,能够调节参与DNA损伤和修复有关的基因表达,并参与细胞从G1到S期进程和细胞末端分化,其基因一旦发生重排或扩增,对细胞功能具有重要影响,能够促进肿瘤性转变[8]。在淋巴瘤中,常见的MYC基因改变是t(8; 14)(q24; q32),最初作为Burkitt淋巴瘤的特异性标志,有文献报道发现10%~15%的DLBCL也可发生MYC基因改变[9]。C-MYC基因与DLBCL的高侵袭性密切相关,这些患者用传统方案治疗效果不理想,预后较差[10]。本组共检测出19例C-MYC基因异位,阳性率约9.3%,与文献报道相似[9]。C-MYC基因异位与Hans分型及患者年龄、性别等均无相关性,本组C-MYC基因易位患者预后较好,可能与样本量和随访时间较短有关。
BCL-2有抑制细胞凋亡的作用,其过表达使细胞抵抗正常凋亡,从而具有致瘤作用[11]。在80%~90%的滤泡性淋巴瘤(follicular lymphoma, FL)中可见BCL-2易位,FL中t(14;18)(q32;q21)/IgH-BCL-2具有特异性[12]。研究发现,15%~20%的DLBCL患者也有类似基因改变,其在GCB型DLBCL中更为常见[9]。BCL-2重排的预后意义一直有争议,有报道认为该基因易位与患者预后无关[5],而也有研究者认为BCL-2易位患者预后较差[13]。BCL-6属于抗细胞凋亡家族,其主要功能是转录抑制作用[14]。BCL-6基因突变和染色体易位是肿瘤发生的基础,异常表达BCL-6可直接调节细胞分化、增殖和凋亡,促进肿瘤生长导致生发中心衍生的B细胞发生恶性转化[15]。BCL-6易位t(3q27)占DLBCL的35%[16]。本组有182例患者进行BCL-2基因检测,阳性率为8.8%(16/182),其中GCB型患者阳性率为17.1%(12/70),明显高于non-GCB型患者(4/112,3.6%),这与Chen等[17]研究结果一致。本组BCL-2基因易位与患者年龄、性别及预后无相关性;而BCL-6基因易位阳性率为30.16%(54/179),其与肿瘤Hans分型、性别、年龄及预后均未发现相关性。
WHO(2016)淋巴瘤分类定义高级别B细胞淋巴瘤具有C-MYC和BCL-2和(或)BCL-6基因重排时,被称为DHL和THL[18];少数高级别B细胞淋巴瘤没有双重/三重打击,以及不宜归入DLBCL非特指型或Burkitt淋巴瘤范畴,被定义为高级别B细胞淋巴瘤非特指型[19]。DHL/THL是具有高度侵袭性、核型复杂以及一系列病理形态学特征的少见肿瘤,恶性程度高,预后差,对常规治疗方案不敏感,使用标准化疗方案R-CHOP(环磷酰胺、阿霉素、长春新碱、泼尼松和利妥昔单抗化疗)治疗后,预后较差[20]。因此,正确诊断DHL/THL对制定合适的治疗方案十分重要。
FISH检测是DHL/THL诊断的金标准,但其耗时长、费用高,对实验室有特殊要求[21]。免疫组化检测蛋白的表达方便、快捷,且价格低廉。WHO(2016)淋巴瘤分类中,C-MYC和BCL-2双表达被认为是一个新的亚组,被定义为DEL,约占DLBCL的1/3[22-25]。Swerdlow[26]研究表明,70%~80%的DHL或THL也显示“双重表达”,但DEL并不等同于DHL,比DHL更常见。本组根据患者C-MYC及BCL-2蛋白表达,将患者分为双表达组和普通组,90%的DHL发生于双表达患者中,也进一步说明DEL与DHL的关系。本组DHL的发生率为4.8%,与Oliveira等[27]报道类似;且双表达组及DHL、THL组总预后低于普通组。
总之,C-MYC与BCL-2蛋白表达对其基因易位有提示作用,而BCL-6蛋白表达不能预测其基因易位情况;C-MYC、BCL-2及BCL-6基因易位(包括双重打击及三重打击)可作为DLBCL患者的预后指标。

