单形性亲上皮性肠道T细胞淋巴瘤16例临床病理学分析
张景航,薛 云,张延平,高子芬,黄 欣,李 敏,苏 蔚
(1.新乡医学院第一附属医院病理科,河南 卫辉 453100;2.新乡市淋巴造血肿瘤诊断重点实验室,河南 卫辉 453100;3.郑州大学第一附属医院病理科,河南 郑州 450000;4.北京大学第三医院病理科,北京 100191)
单形性亲上皮性肠道T细胞淋巴瘤(monomorphic epitheliotropic intestinal T-cell lymphoma,MEITL)是肠道原发的由上皮内淋巴细胞恶性增殖引起的T细胞淋巴瘤,该病非常罕见,在所有胃肠道淋巴瘤中占比不到5.0%,在所有非霍奇金淋巴瘤中占比低于1.0%[1]。MEITL以前被归类为肠病相关T细胞淋巴瘤(enteropathy-associated T cell lymphoma,EATL),属于Ⅱ型EATL,以亚洲国家多见,肿瘤细胞形态单一,且缺乏肠病表现,随着对EATL认识的深入,目前认为Ⅱ型EATL是一种独立的疾病类型,2016年版造血及淋巴组织肿瘤世界卫生组织分类将其划分为一个独立的病种,并正式命名为MEITL[2]。MEITL作为一个新病种,目前病理科及临床医生对其了解不够深入,早期诊断困难,缺乏针对性治疗方案。本研究旨在通过对16例MEITL患者的临床病理学特点进行回顾性分析以及相关文献总结,进一步了解MEITL的临床病理学特点,为其早期诊治提供依据。
1 资料与方法
1.1 一般资料选择2004年1月至2017年12月新乡医学院第一附属医院和北京大学第三医院收治的 16例MEITL患者切除的肿瘤组织标本。其中男9例,女7例;年龄2~75岁,中位年龄54岁。病例纳入标准:符合2016年版淋巴造血系统世界卫生组织新分类标准中MEITL诊断标准。
1.2 试剂与仪器CD3、CD8、CD56、CD5、Ki-67抗体购自河南赛诺特生物技术有限公司,T细胞胞内抗原1(T cell intracelluar antigent 1,TIA-1)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、Granzyme B抗体购自北京中杉金桥生物技术有限公司,二氨基联苯胺(diamnobenzidine,DAB)购自河南赛诺特生物技术有限公司;BOND-MAX全自动免疫组化机购自德国Leica Biosystems徕卡公司,FFPE DNA提取试剂盒购自厦门艾德生物医药科技股份有限公司,聚合酶链反应(polymerase chain reaction,PCR)仪购自德国Eppendorf公司,3500 Dx一代测序仪购自美国ABI公司。
1.3 方法
1.3.1 苏木精-伊红 (hematoxylin-eosin,HE) 染色法观察组织病理学变化取石蜡包埋的组织块连续切片,厚4 μm。将组织切片依次经二甲苯脱蜡、梯度乙醇覆水,苏木精、伊红溶液依次染色,梯度乙醇脱水后,用中性树胶封片,晾干后置于显微镜下观察并拍照。
1.3.2 免疫组织化学检测将石蜡包埋肿瘤组织块进行切片, 厚 2 μm,应用防脱玻片进行裱片,经全自动免疫组织化学机进行免疫组织化学染色,选用的抗体有CD3、CD5、CD8、CD56、TIA-1、Bcl-2、Granzyme B及Ki-67,其中Ki-67阳性对照采用的是淋巴结组织,待染色结束后清洗去油,脱水透明后用中性树胶封片。结果判定采用双盲法,每张玻片随机选5个高倍视野,对应的着色部位上显示棕黄色为阳性,无染色则为阴性。
1.3.3 原位杂交检测将石蜡包埋肿瘤组织块进行切片,厚2.0 μm,脱蜡、无水乙醇水化后用胃蛋白酶消化,梯度乙醇脱水,室温干燥,加地高辛标记的EB病毒编码的小RNA(Epstein-Barr virus encoding microRNA,EBER)探针,4 ℃过夜;磷酸缓冲盐溶液(phosphate buffer saline,PBS)冲洗,加辣根过氧化物酶(horseradish peroxidase,HRP)标记抗地高辛抗体,37 ℃烤箱孵育30 min,PBS冲洗,DAB显色,流水冲洗后使用苏木精进行复染,应用可用盐酸乙醇分化,氨水返蓝,再行流水冲洗,梯度乙醇脱水后用中性树胶封片。采用鼻咽癌组织作为阳性对照,阳性结果判读为着色部位位于细胞核、呈现棕黄色。
1.3.4 T细胞受体(T cell receptor,TCR)基因重排检测首先使用核酸提取试剂盒提取所选16例患者肿瘤组织中的DNA,使用PCR仪进行基因扩增,将扩增后样本行基因重排检测;TCR beta检测片段为Vβ+Jβ1/2、Vβ+Jβ2、Dβ+Jβ1/2,分别对应有效检测范围为240~285、240~285、170~210(Dβ2)和285~325(Dβ1);TCRD检测片段为Vδ+Dδ+Jδ,对应有效检测范围为120~280;TCRG检测片段为Vγ1-8、Vγ10及Vγ9、Vγ11、+multipleJγ,对应有效检测范围分别为145~255(Vγ1-8+Jγ1.3/2.3)、80~220(Vγ9+Jγ1.3/2.3);阳性结果判读标准为样本在有效片段大小范围内峰值高于该区间第3高峰高度的3倍。
2 结果
2.1 MEITL患者的临床表现患者多伴有腹胀、腹痛、腹泻、发热、呕吐及纳差等体征,部分患者出现腹部肿块或肠穿孔,无特异性临床表现。13例发病部位位于小肠,1例位于升结肠近回盲部,1例位于降结肠,1例位于乙状结肠。
2.2 MEITL的组织病理学表现结果见图1。肿瘤细胞呈小至中等大,形态相对单一,细胞质淡染,核呈圆形或椭圆形,染色质较细腻、无明显核仁,个别病例核分裂象较多并可见坏死灶,背景炎症细胞较少,肠绒毛萎缩或表面溃疡形成,上皮内肿瘤性淋巴细胞浸润增多,可见“亲上皮现象”。
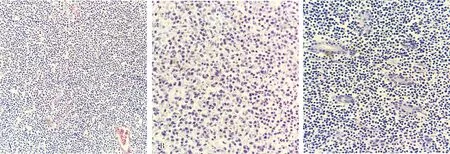
A:MEITL由弥漫一致的小圆细胞组成(×200);B:肿瘤组织局灶可见坏死,背景无炎症细胞(×400);C:“亲上皮现象”即上皮内肿瘤细胞浸润(×200)图1 MEITL的组织病理学形态(HE染色)Fig.1 Histopathological morphology of MEITL(HE straining)
2.3 免疫组织化学染色及原位杂交检测结果结果见图2。肿瘤细胞呈阳性表达的免疫组织化学标志物有CD3、CD8、CD56、TIA-1、Bcl-2,表达呈阴性的标志物有Granzyme B、CD5,Ki-67增殖指数50%~90%。肿瘤组织中EBER检测结果均显示阴性,提示无EB病毒感染。
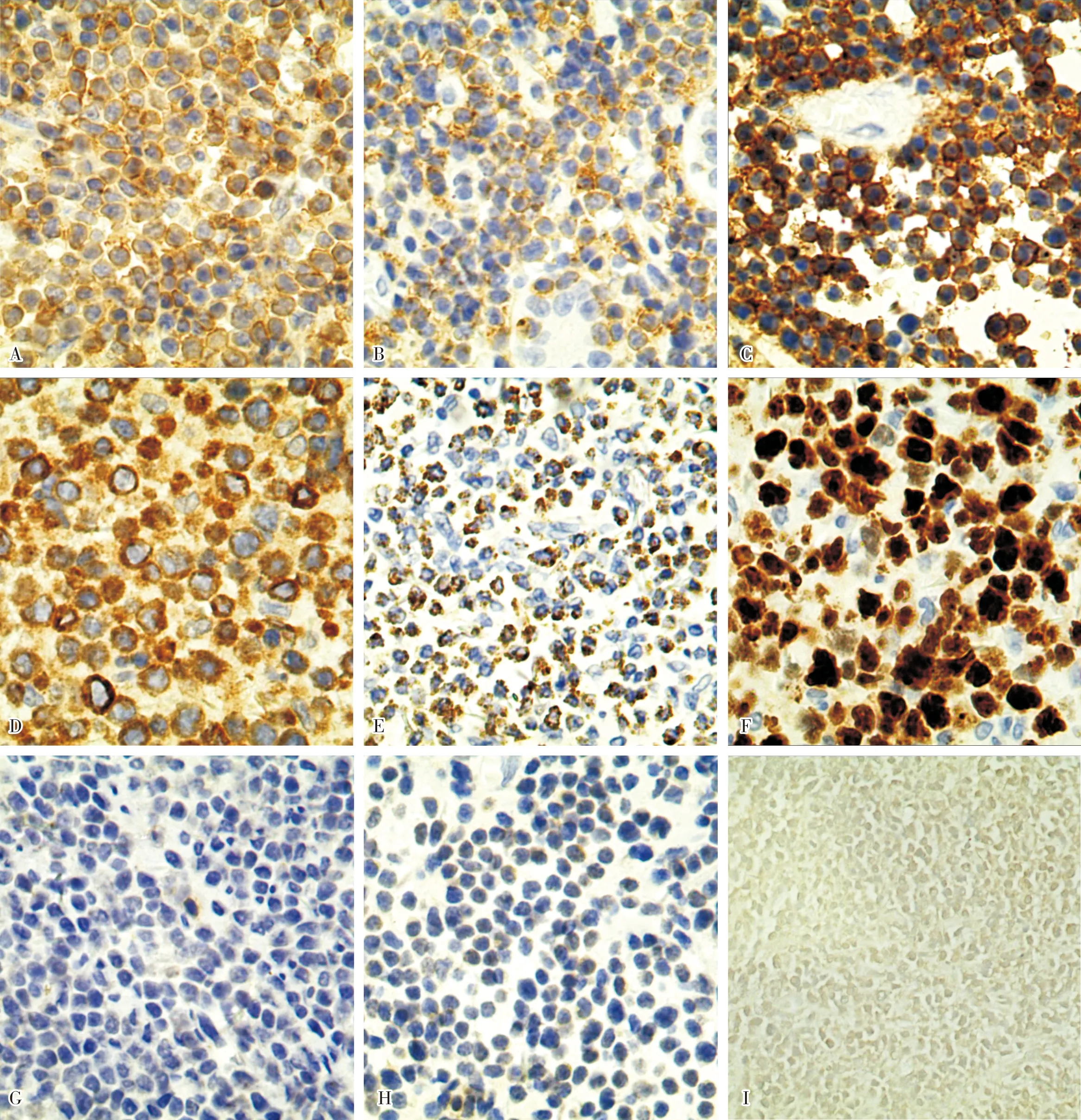
A:CD3+(EnVision,×400);B:CD8+(EnVision,×400);C:CD56+(EnVision,×400);D:TIA-1+(EnVision,×400);E:Bcl-2+(EnVision,×400);F:Ki-67+(EnVision,×400); G:Granzyme B-(EnVision,×400);H:CD5-(EnVision×400);I:EBER-(原位杂交,×200)。图2 MEITL免疫表型及原位杂交结果Fig.2 Immunophenotype and in situ hybridization results of MEITL
2.4 TCR基因重排检测结果16例MEITL TCR基因重排中阳性14例,显示γδT细胞重排;阴性2例,未检测出克隆性重排。
3 讨论
由于Ⅰ、Ⅱ型EATL在流行病学、临床病理特点、免疫表型及分子遗传学方面有各自的特点,故2016年版造血及淋巴组织肿瘤WHO新分类中将二者完全分开,Ⅱ型EATL归为MEITL,Ⅰ型EATL称为EATL[2]。EATL好发于北欧等肠病流行区,肿瘤发生前往往有肠病病史,肿瘤细胞形态相对多样,中等至大细胞,核圆性、空泡状或多角形,可有明显核仁,细胞质中等或丰富,多可见明显炎症细胞,以大量组织细胞及嗜酸性粒细胞;MEITL主要发生在亚洲和西班牙裔人群中[3],与乳糜泻、吸收障碍综合征以及结肠炎等肠病和其他危险因素无明显相关性[4];肿瘤细胞形态单一,核中等大、圆形、染色细腻,细胞质淡染,肠黏膜上皮内肿瘤细胞浸润显著,但缺乏炎症背景,坏死少见。MEITL发病率较低且早期诊断困难,预后较差[5-6]。
有文献报道,MEITL与肠病无明显相关性,男女比例约2:1[7];本研究中16例MEITL患者皆无肠病病史,发病中位年龄为54岁,男性多于女性(男9例,女7例),与既往研究结果大致相同。VAN VLIET等[8]报道,MEITL最常发生在小肠,特别是空肠和回肠,较少发生在结肠和胃,常转移至肠系膜淋巴结,也可扩散至肺、肝和中枢神经系统。本研究中13例发病部位位于小肠,3例位于结肠,发生在结肠者中1例有腹腔淋巴结转移,与VAN VLIET等[8]报道一致。本研究中MEITL患者多数有腹胀、腹痛、腹部肿块、腹泻、肠穿孔、发热、呕吐及纳差等体征,并无特异性临床表现;虽然MEITL与乳糜泻并无明显相关性,但有研究报道,在组织学证实的乳糜泻患者中也有确诊MEITL的病例[9],提示对非特异性的临床表现也不可轻忽,应尽可能完善相关检查以免漏诊。
本研究结果显示,肿瘤细胞呈形态较一致的中等大小圆形细胞,染色质细腻,细胞质淡染,未见明显核仁,肠绒毛萎缩,黏膜表面上皮腺体内可见明显增多的肿瘤性淋巴细胞浸润,均缺乏炎症背景改变,个别病例可见较多核分裂象及小灶坏死,肿瘤周边的正常肠黏膜也没有隐窝增生、固有层内浆细胞及淋巴细胞明显增多等肠病改变。有相关研究报道,MEITL肿瘤细胞免疫表型多为CD2+、CD3+、CD7+、CD8+、CD56+,CD4-、CD5-、CD30-[8-10],本研究中免疫组织化学检测结果显示,呈阳性表达的有CD3、CD8、CD56、TIA-1、Bcl-2,呈阴性表达的有CD5、Granzyme B,Ki-67增殖指数为50%~90%,邻近的黏膜上皮内浸润的淋巴细胞也具有与MEITL相同的免疫表型,即CD3、CD8、CD56阳性,EBER原位杂交结果显示无EB病毒感染,与文献[8-10]报道一致。
研究表明,大多数MEITL患者来源于γδT细胞,也有些例外的情况,比如TCR沉默或表达TCRαβ[2]。有文献报道,少数MEITL患者表达TCRαβ,且γδT细胞受体在其他类型T细胞淋巴瘤中也可表达,故不能依据TCR表达情况来鉴别肿瘤类型[11]。本研究中16例TCR基因重排检测结果中有2例阴性,即未检出克隆性重排,其余均为阳性,显示γδT细胞重排,与既往研究结论一致,推测检测阴性的原因是可能存在TCR沉默或肿瘤表达TCRαβ。
病理学上MEITL需要与以下疾病相鉴别:(1)胃肠道惰性T细胞增殖性疾病:最常见于小肠和结肠,但也可发生在胃肠道任何黏膜位置,镜下可见形态一致的小淋巴细胞浸润固有层,但黏膜腺体无破坏,免疫表型为CD5-、CD56-且Ki-67增殖指数极低;(2)外周T细胞淋巴瘤-非特殊型:是一种不能归为任何一个特定类型的成熟T细胞淋巴瘤,淋巴结内及结外均可发生,CD5+、CD8-、CD56-、TIA-1-,且肿瘤周边黏膜缺乏上皮内淋巴细胞增多改变;(3)结外自然杀伤(natural killer,NK)细胞/T细胞淋巴瘤-鼻型:该病肿瘤细胞形态可类似于MEITL,免疫表型也与之相似,但缺乏MEITL的“亲上皮现象”,常见血管中心浸润及血管破坏现象,且EBER+可鉴别,NK/T细胞淋巴瘤临床常有高热、穿孔等急腹症状,最常见于呼吸系统,较少累及胃肠道[12];(4)炎症性病变如克罗恩病:表现为肠管透壁性炎及非干酪性肉芽肿形成,病变呈跳跃式分布,浸润的炎症细胞以淋巴细胞为主,且呈多克隆性增生,此外还有多量浆细胞、单核细胞、嗜酸性粒细胞等,TCR重排阴性;(5)EATL:除肠病病史及细胞形态不同,EATL免疫表型为CD8-,且EATL常有1q和5q表型,MEITL更多以8q24(MYC)扩增为特征[13]。
综上所述,MEITL起病隐匿且临床表现无特异性,是一种罕见的高侵袭性淋巴瘤,早期诊断有助于预防并发症出现、提高治疗成功率,因此,应提高对该病的认识并进一步深入研究发病机制,对保守治疗无效又高度可疑的患者及时进行包括分子遗传学技术在内的全面检测,避免漏诊、误诊,以期能实施针对性的有效治疗。

