变异性浆细胞瘤异位1基因对高糖培养的大鼠心脏成纤维细胞的影响及其机制
白 杨,黄 婷,李真真,王 琰
(1.郑州市第七人民医院内分泌科,河南 郑州 450016;2.郑州市第七人民医院心内科,河南 郑州 450016)
糖尿病是一种常见的代谢障碍疾病,其发病率呈逐年增长的趋势,据世界流行病学统计,预计到2035年将有5.92亿人患糖尿病[1]。糖尿病心肌病(diabetic cardiomyopathy,DCM)是导致糖尿病患者死亡的主要原因之一[2]。有研究发现,高糖条件下,心脏成纤维细胞(cardiac fibroblast,CF)过度增殖、胶原纤维过量积聚是导致糖尿病患者心室重构、心肌肥厚及纤维化的重要机制[3]。因此,探讨CF增殖及胶原纤维化进程中的分子生物学机制,对防治DCM及缓解糖尿病心肌纤维化进程具有潜在的临床意义。高嘉梦等[4]研究发现,转化生长因子-β1(transforming growth factor-β1,TGF-β1)可使DCM患者CF中Ⅰ型胶原蛋白(type Ⅰ collagen,Col Ⅰ)、Ⅲ型胶原蛋白(type Ⅲ collagen,Col Ⅲ)产生和分泌增加,是诱导心肌向纤维化过程发展的重要细胞因子。有研究发现,微RNA(microRNA,miRNA)可通过不同机制调控心肌纤维化的发生、发展[5]。张伟峰等[6]研究证实,miRNA-93-5p可下调Col Ⅰ、Col Ⅲ表达并抑制心肌梗死小鼠CF的纤维化进程。但目前还不明确miR-93-5p与TGF-β1是否通过某种联系调控心肌纤维化进程。变异性浆细胞瘤异位1(plasma-cytoma variant translocation 1,PVT1)基因被发现于人类衰老的成纤维细胞中,其水平降低可触发增殖性CF的衰老凋亡[7],PVT1可能在CF增殖及纤维化过程中扮演重要角色。然而,目前关于PVT1在心脏纤维化进程中的调控机制研究较少。本研究旨在探讨PVT1基因表达对高糖培养的大鼠CF的影响及其作用机制,以期阐明CF增殖及纤维化进程中的复杂机制,为糖尿病心肌纤维化及DCM的治疗提供理论参考。
1 材料与方法
1.1 细胞、主要试剂与仪器大鼠永生化CF购自天津阿尔法生物科技有限公司;胎牛血清、达尔伯克改良伊格尔培养基(Dulbeco′s modified Eagle′s medium,DMEM)购自美国Gibco公司,Lipfeclamine 3000转染试剂盒购自美国Thermo Fisher公司,PVT1 小干扰RNA (small interfering RNA,siRNA)及其阴性对照(PVT1 siRNA NC)试剂购自美国System Biosciences公司,miR-93-5p inhibitor及其阴性对照试剂(miR-93-5p inhibitor NC)购自上海振誉生物科技有限公司,二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量检测试剂盒购自上海齐源生物科技有限公司,TGF-β1、Smad2/3、磷酸化Smad2/3(phosphorylation Smad2/3,p-Smad2/3)、Smad7、细胞周期抑制因子p21、Col Ⅰ、α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)抗体购自美国Abcam公司,天狼猩红染色试剂盒购自上海钰博生物科技有限公司,细胞周期检测试剂盒购自北京拜尔迪生物技术有限公司,逆转录试剂盒购自北京索莱宝生物科技有限公司;倒置显微镜购自埃克森(北京)科技有限公司,流式细胞仪购自上海佐明机械设备贸易有限公司,实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)仪购自大龙兴创实验仪器(北京)股份有限公司,化学发光成像分析系统购自上海信裕生物科技有限公司;PVT1、TGF-β1及miR-93-5p引物序列由大连宝生物工程公司合成。
1.2 实验方法
1.2.1 细胞培养取液氮中保存的CFs,常规复苏后,接种至含体积分数10%胎牛血清的DMEM中,于37 ℃、含体积分数5% CO2饱和湿度的细胞培养箱中传代培养至第3代后收集细胞进行后续实验。
1.2.2 细胞转染及分组收集对数生长期的CFs,胰蛋白酶消化后,用培养液重悬,以每孔5×104个细胞接种至96孔板中,并随机分为空白对照组、高糖组、PVT1 siRNA组、PVT1 siRNA NC组,每组设置6个复孔。空白对照组和高糖组细胞不进行转染,PVT1 siRNA组及PVT1 siRNA NC组细胞分别转染PVT1 siRNA、PVT1 siRNA NC,转染操作按照Lipfeclamine 3000转染试剂盒说明书进行。转染24 h 后,高糖组、PVT1 siRNA组、PVT1 siRNA NC组细胞用含25 mmol·L-1葡萄糖的DMEM培养,模拟高糖培养条件[8];空白对照组细胞不作处理。
另取对数生长期CFs,胰蛋白酶消化后,用培养液重悬,以每孔5×104个细胞接种至96孔板上,并随机分为未转染组、PVT1 siRNA+miR-93-5p inhibitor组、PVT1 siRNA+miR-93-5p NC组、PVT1 NC+miR-93-5p inhibitor组、PVT1 NC+miR-93-5p NC组,每组设置6个复孔。未转染组不进行转染,PVT1 siRNA+miR-93-5p inhibitor组细胞转染PVT1 siRNA和miR-93-5p inhibitor,PVT1 siRNA+miR-93-5p NC组细胞转染PVT1 siRNA和miR-93-5p NC,PVT1 NC+miR-93-5p inhibitor组细胞转染PVT1 NC和miR-93-5p inhibitor,PVT1 NC+miR-93-5p NC组细胞转染PVT1 NC和miR-93-5p NC,转染操作按照Lipfeclamine 3000转染试剂盒说明书进行。转染24 h 后,用含25 mmol·L-1葡萄糖的DMEM处理未转染组、PVT1 siRNA+miR-93-5p inhibitor组、PVT1 siRNA+miR-93-5p NC组、PVT1 NC+miR-93-5p inhibitor组、PVT1 NC+miR-93-5p NC组细胞,模拟高糖培养条件。
1.2.3 天狼猩红染色法观察4组细胞胶原纤维沉积情况高糖处理24 h后,取空白对照组、高糖组、PVT1 siRNA组、PVT1 siRNA NC组细胞,胰蛋白酶消化离心后,用磷酸盐缓冲溶液(phosphate buffered saline,PBS)洗涤细胞3次,加入40 g·L-1多聚甲醛室温固定15 min,PBS洗涤3次,加入体积分数0.5%的聚乙二醇辛基苯基醚处理20 min,滴加天狼猩红染液染色1 h,胶原纤维被染成粉红色,置于倒置显微镜下观察并拍照。
1.2.4 流式细胞术检测4组细胞细胞周期高糖处理24 h后,取空白对照组、高糖组、PVT1 siRNA组、PVT1 siRNA NC组细胞,胰蛋白酶消化离心后,用PBS洗涤细胞1次,加入预冷体积分数70%乙醇重悬细胞,4 ℃固定24 h,3 000 r·min-1离心10 min 收集各组细胞,按照细胞周期检测试剂盒说明书染色处理后,使用流式细胞仪检测各组细胞细胞周期分布。实验重复6次,取平均值。
1.2.5 qRT-PCR法检测4组细胞中PVT1、TGF-β1mRNA及miR-93-5p的表达收集高糖处理 24 h后的各组细胞,用TRIzol试剂盒提取总RNA,取1 μg RNA反转录合成单链cDNA后,将cDNA作为模板进行qRT-PCR。PVT1 上游引物序列为5′-GTCTTGGTGCTCTGTGTTC-3′,下游引物序列为5′-CCCGTTATTCTGTCCTTCT-3′; TGF-β1上游引物序列为5′-ACGCCTGAGTGGCTGTCTTTTGAC-3′,下游引物序列为5′-GGGCTGATCCCGTTGATTTCCACG-3′;miR-93-5p上游引物:5′-GCCATGTAAACATCTCGGACTG-3′,下游引物序列为5′-CAATGCGTGTGGTGGAGGAG-3′;内参甘油醛-3-磷酸脱氢酶(glyceralde hyde-3-phosphate dehydrogenase,GAPDH)上游引物序列为5′-CTTTGGTATCGTGGAAGGACTC-3′,下游引物序列为5′-GTAGAGGCAGGGATGATGTTCT-3′。反应体系(25.0 μL):SYBR Primix Ex Taq 12.5 μL,上下游引物各1.0 μL,cDNA 2.0 μL,ddH2O 8.5 μL。反应条件:95 ℃ 120 s(1个循环);95 ℃ 30 s、55~60 ℃ 30 s、72 ℃ 30 s(40个循环);72 ℃ 300 s(1个循环)。采用2-△△Ct法计算PVT1、TGF-β1mRNA及miR-93-5p相对表达量。实验重复6次,取平均值。
1.2.6 Western blot法检测4组细胞中TGF-β1、Smad2/3、p-Smad2/3、Smad7、p21、α-SMA、Col Ⅰ 蛋白表达收集高糖处理24 h后的各组细胞,加入细胞裂解液抽提总蛋白,使用BCA蛋白定量试剂盒测定蛋白浓度。取50 μg蛋白样品行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳分离,以半干法转至聚偏氟乙烯膜上,脱脂奶粉封闭2 h,加入TGF-β1、Smad2/3、p-Smad2/3、Smad7、p21、Col Ⅰ、α-SMA一抗(稀释度均为1:1 000),4 ℃孵育过夜,加入羊抗兔辣根过氧化物酶二抗(1:5 000),室温孵育1 h。化学发光法显影曝光后,应用化学发光成像分析系统拍照并分析各条带灰度值,以GAPDH为内参,以目的蛋白条带灰度值与GAPDH灰度值比值表示目的蛋白相对表达量。实验重复6次,取平均值。
1.2.7 Western blot法检测5组细胞中TGF-β1、Smad7、ColⅠ蛋白表达高糖处理后24 h,收集未转染组、PVT1 siRNA+miR-93-5p inhibitor组、PVT1 siRNA+miR-93-5p NC组、PVT1 NC+miR-93-5p inhibitor组、PVT1 NC+miR-93-5p NC组细胞,按“1.2.6 项”方法检测5组细胞中TGF-β1、Smad7、Col Ⅰ蛋白相对表达量。实验重复6次,取平均值。

2 结果
2.1 4组细胞胶原纤维沉积情况结果见图1。与空白对照组比较,高糖组细胞数量增多,红色胶原纤维沉积增加。与高糖组比较,PVT1 siRNA组细胞间隙变大,红色胶原纤维沉积减小;PVT1 siRNA NC组细胞红色胶原纤维沉积与高糖组相近。

A:空白对照组;B:高糖组;C:PVT1 siRNA组;D:PVT1 siRNA NC组。图1 4组细胞胶原纤维沉积情况(天狼猩红染色,×200)Fig.1 Collagen fiber deposition of cells in four groups (sirius red staining,× 200)
2.2 4组细胞细胞周期比较结果见表1和图2。高糖组、PVT1 siRNA组、PVT1 siRNA NC组G0+G1期细胞比例显著低于空白对照组,S+G2+M期细胞比例显著高于空白对照组,差异有统计学意义(P<0.05)。PVT1 siRNA组G0+G1期细胞比例显著高于高糖组,S+G2+M期细胞比例显著低于高糖组,差异有统计学意义(P<0.05)。PVT1 siRNA NC组G0+G1期细胞比例显著低于PVT1 siRNA组,S+G2+M期细胞比例显著高于PVT1 siRNA组,差异有统计学意义(P<0.05)。高糖组和PVT1 siRNA NC组G0+G1期细胞比例、S+G2+M期细胞比例比较差异无统计学意义(P>0.05)。

表1 4组细胞细胞周期比较Tab.1 Comparison of cell cycle among the four groups
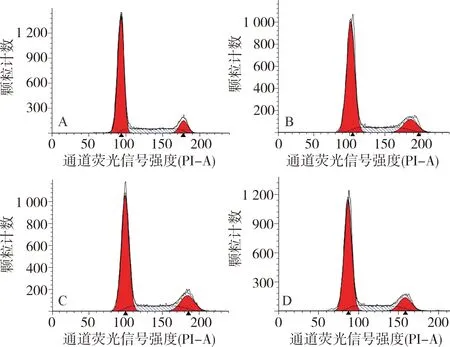
A:空白对照组;B:高糖组;C:PVT1 siRNA组;D:PVT1 siRNA NC组。图2 4组细胞细胞周期分布Fig.2 Distribution of cell cycle in the four groups
2.3 4组细胞中PVT1、TGF-β1mRNA及miR-93-5p相对表达量比较结果见表2。高糖组、PVT1 siRNA组、PVT1 siRNA NC组细胞中PVT1、TGF-β1mRNA相对表达量均显著高于空白对照组,miR-93-5p相对表达量显著低于空白对照组,差异有统计学意义(P<0.05)。PVT1 siRNA组细胞中PVT1、TGF-β1mRNA相对表达量显著低于高糖组,miR-93-5p相对表达量显著高于高糖组,差异有统计学意义(P<0.05)。PVT1 siRNA NC组细胞中PVT1、TGF-β1mRNA相对表达量均显著高于PVT1 siRNA组,miR-93-5p相对表达量显著低于PVT1 siRNA组,差异有统计学意义(P<0.05)。高糖组与PVT1 siRNA NC 组细胞PVT1、TGF-β1mRNA及miR-93-5p相对表达量比较差异无统计学意义(P>0.05)。

表2 4组细胞中PVT1、TGF-β1 mRNA及miR-93-5p相对表达量比较Tab.2 Comparison of relative expression of PVT1,TGF-β1 mRNA and miR-93-5p of cells among the four groups
2.4 4组细胞中α-SMA 、Col Ⅰ、p21、TGF-β1、Smad7 蛋白相对表达量及(p-Smad2/3)/(Smad2/3)比较结果见表3、图3和图4。高糖组、PVT1 siRNA组、PVT1 siRNA NC组细胞中α-SMA、Col Ⅰ、TGF-β1蛋白相对表达量及(p-Smad2/3)/(Smad2/3)显著高于空白对照组,p21、Smad7蛋白相对表达量显著低于空白对照组,差异有统计学意义(P<0.05)。PVT1 siRNA组细胞中α-SMA、Col Ⅰ、TGF-β1蛋白相对表达量及(p-Smad2/3)/(Smad2/3)显著低于高糖组,p21、Smad7蛋白相对表达量显著高于高糖组,差异有统计学意义(P<0.05)。PVT1 siRNA NC组细胞中α-SMA、Col Ⅰ、TGF-β1蛋白相对表达量及(p-Smad2/3)/(Smad2/3)显著高于PVT1 siRNA组,p21、Smad7蛋白相对表达量显著低于PVT1 siRNA组,差异有统计学意义(P<0.05)。高糖组与PVT1 siRNA NC组细胞中α-SMA、Col Ⅰ、p21、TGF-β1、Smad7蛋白相对表达量及(p-Smad2/3)/(Smad2/3)比较差异无统计学意义(P>0.05)。

表3 4组细胞中α-SMA、Col Ⅰ、p21、TGF-β1、Smad7蛋白相对表达量及(p-Smad2/3)/(Smad2/3)比较Tab.3 Comparison of relative expression levels of α-SMA,Col Ⅰ,p21,TGF-β1,Smad7 protein and (p-Smad2/3)/(Smad2/3) of cells among the four groups
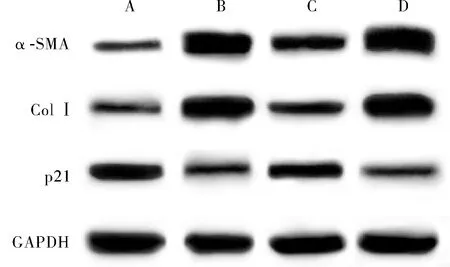
A:空白对照组;B:高糖组;C:PVT1 siRNA组;D:PVT1 siRNA NC组。图3 4组细胞中α-SMA、Col Ⅰ、p21蛋白表达Fig.3 Expression of α-SMA,Col Ⅰ and p21 protein of cells in the four groups

A:空白对照组;B:高糖组;C:PVT1 siRNA组;D:PVT1 siRNA NC组。图4 4组细胞中TGF-β1、p-Smad2/3、Smad2/3、Smad7蛋白表达Fig.4 Expression of TGF-β1,p-Smad2/3,Smad2/3 and Smad7 protein of cells in the four groups
2.5 5组细胞中TGF-β1、Smad7、Col Ⅰ蛋白相对表达量比较结果见表4和图5。PVT1 siRNA+miR-93-5p NC组细胞中TGF-β1、Col Ⅰ蛋白相对表达量显著低于未转染组,Smad7蛋白相对表达量显著高于未转染组,差异有统计学意义(P<0.05)。PVT1 NC+miR-93-5p inhibitor组细胞中TGF-β1、Col Ⅰ蛋白相对表达量显著高于未转染组,Smad7蛋白相对表达量显著低于未转染组,差异有统计学意义(P<0.05)。未转染组细胞中TGF-β1、Smad7、Col Ⅰ蛋白相对表达量与PVT1 NC+miR-93-5p NC组、PVT1 siRNA+miR-93-5p inhibitor组比较差异无统计学意义(P>0.05)。PVT1 NC+miR-93-5p inhibitor组、PVT1 siRNA+miR-93-5p inhibitor组、PVT1 NC+miR-93-5p NC组细胞中TGF-β1、ColⅠ蛋白相对表达量显著高于PVT1 siRNA +miR-93-5p NC组,Smad7蛋白相对表达量显著低于PVT1 siRNA+miR-93-5p NC组,差异有统计学意义(P<0.05)。PVT1 siRNA+miR-93-5p inhibitor组、PVT1 NC+miR-93-5p NC组细胞中TGF-β1、ColⅠ蛋白相对表达量显著低于PVT1 NC+miR-93-5p inhibitor组,Smad7蛋白相对表达量显著高于PVT1 NC+miR-93-5p inhibitor组,差异有统计学意义(P<0.05)。PVT1 siRNA+miR-93-5p inhibitor组与PVT1 NC+miR-93-5p NC组细胞中TGF-β1、Smad7、Col Ⅰ 蛋白相对表达量比较差异无统计学意义(P>0.05)。

表4 5组细胞中TGF-β1、Smad7、Col Ⅰ 蛋白相对表达量比较Tab.4 Comparison of relative expression levels of TGF-β1,Smad7 and Col Ⅰ protein of the cells among the five groups

A:未转染组;B:PVT1 NC+miR-93-5p NC组;C:PVT1 siRNA +miR-93-5p NC组;D:PVT1 NC+miR-93-5p inhibitor组;E:PVT1 siRNA+miR-93-5p inhibitor组。图5 5组细胞中TGF-β1、Smad7、Col Ⅰ蛋白表达Fig.5 Expression of TGF-β1,Smad7,Col Ⅰ protein of cells in the five groups
3 讨论
心肌纤维化是心肌重塑及慢性心力衰竭发生的主要原因,CF是心肌纤维化的最终效应细胞[9],高血糖条件下CF增殖可使细胞外基质降解受阻、胶原蛋白合成增加,从而导致心肌间质纤维化[10]。故探究CF纤维化的分子生物学机制,对抑制DCM的发展具有重要意义。
TGF-β1和Smad在CF增殖及纤维化过程中扮演重要角色[11]。有研究证实,细胞外TGF-β1可特异性识别Smad2/3使其磷酸化形成p-Smad2/3,并与Smad 4形成异三聚体复合物转运至细胞核中,从而促进纤维化相关靶基因如Col Ⅰ和Col Ⅲ的表达及沉积,导致心肌纤维化发生、发展[12-13]。α-SMA水平可反映胶原沉积及纤维化严重程度[14]。本研究中高糖组、PVT1 siRNA组、PVT1 siRNA NC组的CF用25 mmol·L-1葡萄糖高糖培养24 h后,细胞中胶原纤维沉积严重,TGF-β1mRNA、TGF-β1蛋白、Col Ⅰ蛋白、α-SMA蛋白相对表达量及(p-Smad2/3)/(Smad2/3)均显著高于空白对照组,提示TGF-β1/Smad通路参与CF的纤维化过程,但TGF-β1/Smad通路活化的基因调控机制还不甚明确。
miR-93-5p是近2 a来在心肌梗死患者中新发现的失调的miRNA之一[15]。miR-93-5p与TGF-β1之间可通过共同的靶标分子Smad7参与细胞纤维化进程[16]。已有研究证实,miR-93-5p与TGF-β1之间可通过共同的靶标分子Smad7来抑制肺癌细胞TGF-β1信号传导。LIANG等[17]研究证实,Smad7是TGF-β1信号通路的负反馈调节因子,TGF-β1不仅可抑制Smad7表达,还可通过募集Smad泛素连接酶蛋白2使TGF-β1配体泛素化降解,从而阻断TGF-β1/Smad促纤维化通路激活。本研究结果显示,高糖组、PVT1 siRNA组、PVT1 siRNA NC组细胞中miR-93-5p及Smad7蛋白相对表达量显著低于空白对照组,说明高糖诱导可使TGF-β1/Smad通路被激活的同时,伴随miR-93-5p表达及Smad7蛋白表达的降低,提示高糖诱导可抑制miR-93-5p/Smad7信号轴,导致TGF-β1/Smad促纤维化通路活化。但CF纤维化进程中的生物调控机制,不仅仅是靠单一的miRNA调节来完成的,还可能与其他因子有关,本研究对此进行继续探究。
PVT1是一种与CF衰老有关的调节因子[18]。有研究证实,PVT1是一种抗凋亡基因,沉默PVT1表达可促进CF的凋亡[7]。CAO等[19]通过体内体外实验证实,PVT1过表达可促进CF的增殖、胶原蛋白的产生及TGF-β1/Smad信号通路的激活,而沉默PVT1后则产生相反的作用,提示干预PVT1 mRNA表达,可能对抑制CF增殖及纤维化进程具有重要意义。本研究结果发现,高糖组、PVT1 siRNA组、PVT1 siRNA NC组细胞中PVT1 mRNA相对表达量均显著高于空白对照组,细胞有丝分裂阻滞期G0+G1期细胞比例显著低于空白对照组,细胞增长及有丝分裂期S+G2+M期细胞比例显著高于空白对照组,且细胞周期抑制因子p21相对表达量显著低于空白对照组,提示高糖诱导可促进PVT1表达,从而促进CF胶原纤维沉积及增殖分裂,可能与抑制miR-93-5p/Smad7信号轴表达,促进TGF-β1/Smad轴信号激活有关。为进一步验证这一推测,本研究在沉默PVT1的基础上抑制miR-93-5p表达,结果发现,PVT1 siRNA+miR-93-5p inhibitor组、PVT1 NC+miR-93-5p NC组细胞中TGF-β1、ColⅠ蛋白相对表达量显著低于PVT1 NC+miR-93-5p inhibitor组,Smad7蛋白相对表达量显著高于PVT1 NC+miR-93-5p inhibitor组;PVT1 siRNA+miR-93-5p inhibitor组与PVT1 NC+miR-93-5pNC组细胞中TGF-β1、Smad7、Col Ⅰ蛋白相对表达量比较差异无统计学意义,提示PVT1沉默可抑制TGF-β1/Smad通路激活,促进miR-93-5p/Smad7通路活化,进而发挥促纤维化作用。
综上所述,大鼠PVT1基因沉默可促进miR-93-5p/Smad7通路活化,抑制TGF-β1/Smad通路激活,进而抑制高糖诱导的CF纤维化进程,为阐明CF纤维化进程的机制提供一定参考。但本研究还存在一定的不足,PVT1与miR-93-5p之间的调控机制复杂,PVT1与miR-93-5p/Smad7-TGF-β1/Smad通路的靶向调控关系还有待进一步验证。

