许氏平鲉MyoD1s基因的鉴定及其调控成肌细胞分化功能的初步研究*
孔祥福,贺 艳,宋伟豪,孙敏敏
(中国海洋大学海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003)
MyoD1基因全称为成肌分化抗原基因(Myogenicdifferentiationantigen),具有诱导成纤维细胞和其他非骨骼肌细胞分化为骨骼肌细胞的能力[1]。由于MyoD1基因能将其他细胞重新编程成肌肉,以及它在早期肌肉细胞系中的表达,其通常被称为肌肉生成的主调节器[2]。具有bHLH 结构域的MyoD1蛋白可以特异地与肌肉特异基因启动子上的E-box(CANNTG)位点结合[3-4],并与其他转录调控因子共同调节肌球蛋白重链(MyHC,Myosinheavychain) 和肌动蛋白(α-Actin,alpha-Actin)等肌肉结构蛋白的表达[5-7]。在体内,从胚胎肌肉前体细胞的命运决定、增殖和分化,到个体出生后肌肉的发育成熟及创伤修复,都有MyoD1基因的参与[8]。MyoD1基因过表达会引起成纤维细胞细胞的肌源性分化[9],使非体节细胞向肌肉细胞转变[10]。MyoD1基因的表达可以启动肌源性程序,在完整的肌肉发育过程中起到了必不可少的作用。与此相反,MyoD1基因缺失会导致胚胎骨骼肌细胞形成终止[11-12],MyoD1基因敲除会破坏成肌细胞的分化能力[13-14]。
继哺乳动物之后,鱼类中的MyoD1基因也相继被克隆出来,其在不同鱼类中的表达模式大致是相同的。在多数鱼类中,MyoD1基因在各组织均有表达,在肌肉中的表达显著高于其他组织[15-18]。鱼类MyoD1基因的表达可能与运动相关的肌肉的发育[19]和个体的生长速度相关[17-20]。目前,关于鱼类MyoD1基因的功能验证主要在斑马鱼中开展,经济鱼类相关研究较少。MyoD1基因突变会引起斑马鱼颅骨肌肉组织严重减少、发育缺陷和仔鱼致死率升高。此外,MyoD1基因的突变还会延迟和减小斑马鱼胚胎早期体节发生,造成肌肉体积的减小和肌纤维数目的增加[21-24]。
许氏平鲉(Sebastesschlegelii)为卵胎生的岩礁性鱼类,其肉质鲜美,是一种重要的海产经济鱼类和增养殖优良品种。但许氏平鲉生长速度慢,肌肉生长是对其进行遗传改良最有价值的经济性状之一。为了更好地了解许氏平鲉MyoD1基因在肌肉生长调控中的作用,本研究鉴定了许氏平鲉MyoD1基因,检测了基因的时空表达情况,并利用小鼠C2C12细胞初步验证了其诱导成肌细胞分化的功能。本结果将为研究MyoD1基因在经济鱼类肌肉生长发育过程的调控作用提供重要参考。
1 材料与方法
1.1 材料和试剂
本研究中所用的1龄以下的许氏平鲉幼鱼购自于山东省青岛市青岛贝宝海洋科技有限公司,1龄及以上成鱼购自于山东省青岛市竹岔岛海上网箱。实验用鱼的生长状态健康良好。对许氏平鲉断椎处死,取出生后30天、60天、75天、90天、100天、180天、1龄、2龄、3龄、4龄鱼的肌肉、2.5龄成鱼的各组织,液氮速冻,-80 ℃保存,用于提RNA。另外,取部分肌肉,4%多聚甲醛(PFA)固定,用于肌肉组织的原位杂交实验。
实验所用的Trizol购买于Invitrogen公司;MLV 反转录体系、RNA 酶抑制剂 RRI、ScalⅠ 和XhoⅠ 内切酶购买于Takara公司;探针标记试剂盒DIG RNA Labeling Kit、抗体Fab-AP、显色液NBT/BCIP购买于Roche公司;
1.2 总RNA提取、cDNA第一链合成及基因组DNA的提取
按照Trizol法提取许氏平鲉各组织、不同发育时期肌肉组织总RNA,采用DNase I清除RNA中的DNA,使用RNA clean试剂盒去除RNA中蛋白,通过Nanodrop仪和琼脂糖凝胶电泳检测RNA的浓度和质量。cDNA第一链利用M-MLV反转录酶来合成,对合成的cDNA第一链进行β-actin基因检测,确定cDNA第一链是否可用。
采用酚-氯仿的方法提取许氏平鲉基因组DNA,利用Nanodrop仪和琼脂糖凝胶电泳检测DNA的浓度和质量。
1.3 MyoD1基因ORF序列和基因组DNA序列的获得
使用primer5,根据许氏平鲉基因组注释基因MyoD1(S.schlegelii_GLEAN_10020387)设计和优化引物。本研究中所用引物见表1。以MyoD1-fw、MyoD1-rv为引物,分别以上述合成的cDNA和基因组DNA为模板,进行PCR扩增获取MyoD1基因的ORF片段和基因组DNA序列。用Taq DNA 聚合酶对MyoD1基因片段进行扩增验证,PCR反应条件为:95 ℃,5 min;95 ℃,30 s,57 ℃,55 s(ORF)/3 min(DNA),72 ℃,30 s,30 cycles;72℃,5 min,4 ℃,∞。将PCR产物克隆至pMDTM19T载体,转化至DH5α 感受态细胞,对检测得到的阳性单克隆菌株进行测序,将测序结果与基因组数据进行比对分析。
1.4 MyoD1基因多重序列比对和系统进化分析
从NCBI和Ensembl网站下载其他物种的MyoD1氨基酸序列,同许氏平鲉的MyoD1-like氨基酸序列用 MUSCLE 进行比对,利用 Genedoc 软件进行氨基酸多序列比对。采用 Bio Edit 和 MEGA7.0 的邻接法(Neighbor-Joining,NJ)进行聚类分析构建进化树,Bootstrap的重复次数为5 000。各物种MyoD1氨基酸序列的 GenBank 数据库注册序列号见表2。

表1 PCR所用引物

表2 用于比对的氨基酸序列
1.5 实时荧光定量PCR
设计定量引物,扩增的片段长度为172 bp,并通过预实验确定引物的扩增产物单一。利用荧光定量PCR(qRT-PCR),对上述合成的cDNA中MyoD1s基因的表达情况进行定量分析。本实验中,内参基因为Rpl17基因,产物长度为109 bp,引物序列见表1。试剂为SYBR Green PCR Master Mix(TaKaRa公司)。qRT-PCR反应条件:95 ℃,2 min;95 ℃,15 s,60 ℃,45 s,40 cycles。
1.6 原位杂交
因MyoD1、MyoD1-like基因mRNA序列差别较小,原位探针无法区分两者,所以原位杂交结果为两个基因表达产物的混合。设计探针合成引物,探针长度为458 bp,SP6和T7启动子序列分别加在正向引物和反向引物的5’端。以肌肉cDNA为模板,用MyoD1s探针合成引物进行PCR扩增。随后,对PCR产物进行胶回收、连接、转化及测序。对测序正确的菌液提质粒。以质粒为模板,再次PCR扩增和胶回收。以胶回收产物(50 ng/μL)为模板,使用SP6/T7 RNA polymerase试剂盒(TaKaRa公司)分别合成正义、反义探针,使用Nanodrop仪检测原位探针的浓度,通过电泳检测探针的质量。参照Lin等[25]的步骤进行原位杂交。原位杂交结果经Nikon AZ100显微镜相机进行拍照。
1.7 MyoD1-like基因真核表达质粒的构建和细胞转染
设计MyoD1-like基因ORF全长引物,两端分别加上ORF序列中不存在的酶切位点XhoⅠ 和SalⅠ,5′端加保护碱基。PCR扩增,PCR产物胶回收,将胶回收产物和pEGFP-N1 空载质粒分别进行双酶切。酶切电泳检测后分别切下正确条带,胶回收。胶回收的目的基因与载体进行T4连接,然后转化及测序。对测序正确的菌液提取MyoD1-like-pEGFP-N1真核表达质粒。
根据脂质体2000 转染试剂(Invitrogen,USA)说明书的操作方法,分别将1 μg pEGFP-N1空载质粒和MyoD1-like-pEGFP-N1质粒转染到细胞密度为70%的小鼠C2C12细胞中。设置阴性对照(只加转染试剂)和空白对照。24 h后,倒置显微镜下观察转染是否成功;72 h后,倒置显微镜下观察细胞形态。
2 结果
2.1 许氏平鲉 MyoD1基因ORF序列的扩增
MyoD1基因的ORF长度为897 bp,编码298个氨基酸。此外,在MyoD1基因的ORF扩增过程中,MyoD1基因共扩增出两个片段。这两个基因序列分别命名为MyoD1和MyoD1-like。如图1所示,MyoD1和MyoD1-like序列存在19个bp的差异。
2.2 许氏平鲉MyoD1、MyoD1-like基因的确定及分析
2.2.1 MyoD1、MyoD1-like基因的确定 针对MyoD1基因扩增出的两个不同序列,我们进一步利用酶切法进行验证。将上述测序为MyoD1、MyoD1-like基因的菌株分别提取质粒。其中,MyoD1基因中无StuⅠ 内切酶酶切位点,带有MyoD1基因的质粒不能被StuⅠ 内切酶切开;而MyoD1-like基因中含有StuⅠ 内切酶的酶切位点,带有MyoD1-like基因的质粒可以被切开。酶切验证表明,MyoD1基因确实存在MyoD1和MyoD1-like两个基因序列(见图2)。
2.2.2 MyoD1、MyoD1-like基因的基因组DNA扩增 基因组中的MyoD1扩增结果显示,可以扩增出两条带,分别命名为条带a和条带b(见图3)。其中条带a的大小与预期MyoD1基因的基因组大小一致;条带b的大小与MyoD1转录本的大小一致。测序结果显示,条带a的序列和MyoD1的基因组序列完全匹配,含有完整的内含子和外显子序列。条带b的序列则和MyoD1-like的外显子序列完全匹配,代表MyoD1-like基因没有内含子。在基因组DNA水平,我们也进一步证明了MyoD1基因存在MyoD1和MyoD1-like两个亚型。
2.3 许氏平鲉MyoD1-like氨基酸的多重序列比对和系统进化分析
由图4可知MyoD1和MyoD1-like氨基酸序列仅存在两个位点不一致。MyoD1氨基酸序列在64位和((A)以基因组DNA为模板,PCR扩出两条带,分别命名为条带a和条带b。(B)MyoD1和MyoD1-like基因组结构示意图。条带a的序列和MyoD1的基因组序列完全匹配,含有完整的内含子和外显子序列。条带b的序列则和MyoD1-like的cDNA序列完全匹配,代表MyoD1-like基因没有内含子。(A) Two bands, named band a and band b, can be amplified using muscle genome DNA as template. (B) The sequence of band a was identical to the genomic sequence ofMyoD1, including two introns and three exons. The sequence of band b was identical to the mRNA sequence ofMyoD1-like, containing only exons.)
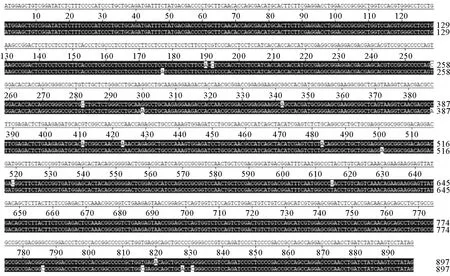
(MyoD1-like基因与MyoD1基因序列存在19 bp的差异。There is a 19 bp-difference between MyoD1-like and MyoD1 gene.)
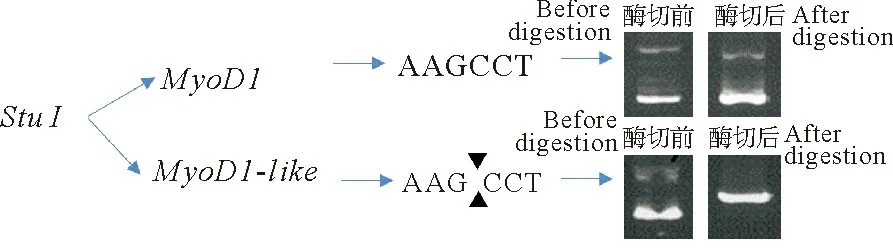
(MyoD1-like基因存在StuⅠ 的酶切位点,质粒可以被切开;而MyoD1基因不存在该酶切位点,不能被切开。MyoD1-like gene which has StuⅠ restriction site can be cut by endonuclease; while MyoD1 gene which does not have StuⅠ restriction site cannot be cut by endonuclease.)

图3 MyoD1基因在基因组中的扩增及其结构示意图
274位为丝氨酸和丙氨酸;MyoD1-like氨基酸序列在64位和274位都为苏氨酸。由于两者氨基酸序列差距较小,我们选择MyoD1-like氨基酸序列进行多重序列比对和系统进化分析。由图5多重序列比对结果显示,许氏平鲉MyoD1-like与其他硬骨鱼MyoD1氨基酸序列的一致性较高,与大黄鱼同源性高达90%,与金头鲷、半滑舌鳎和尼罗罗非鱼的同源性分别为 89%、88%、87%。MyoD1-like包含保守的bHLH结构域和HlixⅢ 结构域。系统进化分析显示,进化树分为两大支,许氏平鲉MyoD1-like氨基酸序列先与其他硬骨鱼的MyoD1聚类在一起,然后与哺乳、鸟类、两栖和爬行类的MyoD1聚类为一支。说明许氏平鲉MyoD1-like基因与其他硬骨鱼MyoD1基因亲缘关系较近。
2.4 许氏平鲉MyoD1s基因在成鱼各组织、肌肉发育不同时期表达量分析
2.4.1 成鱼各组织、肌肉发育不同时期表达量分析 通过已有的引物不能区分开MyoD1和MyoD1-like基因各自的表达情况,因此,图6所示结果为两者的混合。不同组织的表达分析结果表明,MyoD1s基因在各组织中均有表达,在肌肉中高表达,精巢和卵巢中表达量次之。MyoD1s基因在肌肉中的高表达,说明它们在肌肉发育调控过程中扮演了至关重要的角色。因此,我们进一步分析了其在不同发育时期肌肉中的表达量。
不同发育时期肌肉的表达分析表明,MyoD1s基因在35~90天之间表达量都较低,在100天时表达量相对于前期显著升高;100天到1龄表达量呈逐渐降低的趋势;在1龄之后表达量又逐渐升高,3龄和4龄时表达量最高。

(第一个框代表的bHLH结构域,第二个框代表HlixⅢ 结构域。bHLH 和HlixⅢ 结构域在许氏平鲉与其他物种之间相对保守。The first box represents the basis helix-loop-helix; The second box indicates the HelixⅢ domains. bHLH and HelixⅢ domains are conserved between Sebastes schlegeli and other species.)

图5 许氏平鲉MyoD1-like蛋白和其他物种MyoD1蛋白构建的邻接系统进化树
2.4.2 MyoD1、MyoD1-like基因在雌雄鱼肌肉中的表达比例 因MyoD1、MyoD1-like基因无法区分设计定量引物,本研究利用酶切的方式分析它们在成鱼肌肉中的表达比例。分别以成鱼雌性、雄性肌肉cDNA为模板,PCR扩增,连接,转化,提取质粒,酶切鉴别MyoD1和MyoD1-like基因的表达比例。MyoD1不能被StuⅠ 内切酶切开,而MyoD1-like可以被StuⅠ 内切酶切开。结果显示,雌性中,在29个质粒中有3个质粒未被StuⅠ 内切酶切开(MyoD1),26个质粒被StuⅠ 内切酶切开(MyoD1-like);雄性中,32个质粒全被StuⅠ 内切酶切开(MyoD1-like)。以上结果说明MyoD1-like是主要表达基因(见图7)。
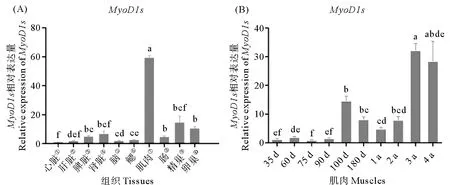
(①Heart;②Liver;③Spleen;④Kidney;⑤Brain;⑥Gill;⑦Muscle;⑧Intestine;⑨Testis;⑩Ovary。(A)MyoD1s基因在成鱼不同组织的表达模式。(B)MyoD1s基因在不同发育时期肌肉中的表达模式。数据显示为平均值± SEM (n =3)。(A) Expression profiles of MyoD1s gene in different adult tissues. (B) Expression profiles of MyoD1s gene in muscle of different developmental stages. Data are shown as mean ± SEM (n =3).)

((A)、(B)通过StuⅠ 内切酶分别检测雌鱼和雄鱼肌肉中MyoD1和MyoD1-like基因的表达比例。方框表示不能被被切开的基因(MyoD1)。每两个泳道为一组,单数泳道代表酶切前质粒,偶数泳道代表酶切后质粒。(A)、(B) The expression ratio of MyoD1 and MyoD1-like genes in female and male muscle was detected by StuⅠ endonuclease digestion. The box represents the band of MyoD1 that cannot be cut by endonuclease. Each two lanes are a group, singular lanes represent plasmids before digestion, and even lanes represent plasmids after digestion.)
2.5 许氏平鲉MyoD1s基因在肌肉发育不同时期的表达分布及比较
肌肉组织原位结果显示,MyoD1s基因的表达位置是肌纤维的边缘,位于肌纤维之间,即成肌细胞增殖、分化的位置。出生后100天肌肉组织中表达MyoD1s基因的细胞数目明显多于180天肌肉组织,这说明出生后100天肌肉的增殖分化能力要高于180天的肌肉(见图8)。
2.6 许氏平鲉MyoD1-like基因的过表达诱导成肌细胞系C2C12的分化
由结果2.4可知,肌肉中MyoD1-like基因的表达量远高于MyoD1基因,因此我们构建了MyoD1-like的真核表达质粒,并将许氏平鲉MyoD1-like-pEGFP-N1真核表达质粒转染至小鼠成肌细胞系C2C12细胞中。结果显示,转染后24 h,空白对照、阴性对照无荧光,pEGFP-N1空载质粒组和实验组均有较强的荧光出现,说明转染实验成功。且在72 h时,转染MyoD1-like-pEGFP-N1真核表达质粒的细胞,发生了明显分化,细胞融合形成了多核的肌管(见图9)。以上结果表明,MyoD1-like基因的过表达诱导成肌细胞发生分化。
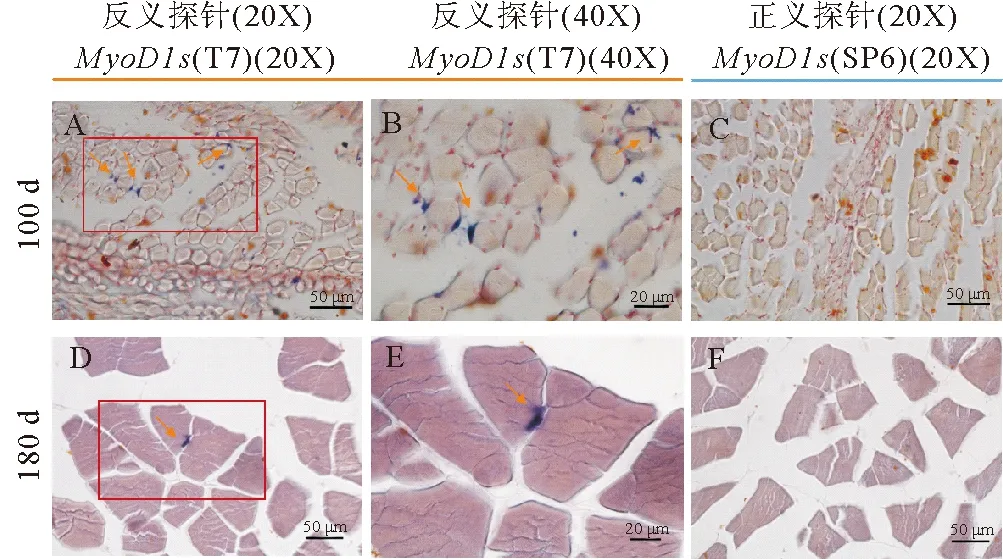
((A)~(C)和(D)~(F)分别代表MyoD1s在出生后100和180 d肌肉组织中的原位杂交结果。(B)和(E)分别为(A)和(D)中的放大框区域。箭头为MyoD1s阳性的细胞。相对于出生后180天的肌肉组织,100天的肌肉组织中有更多MyoD1s阳性细胞。标尺:(A、C、D、F)为50 μm,(B、E)为20 μm。(A)~(C) and (D)~(F) represent 100 dpb and 180 dpb samples respectively. (B) and (E) show magnification of boxed areas in (A) and (D) respectively. There are more MyoD1s positive cells noted by arrows in muscle of 100 dpb than in muscle of 180 dpb. Scale bar, 50 μm (A, C, D, F) and 20 μm (B, E).)

((A)、(A’)转染后24 h,MyoD1-like-pEGFP-N1质粒在细胞中表达;(B)空白对照组;(C)阴性对照组;(D)转染pEGFP-N1空载质粒;(E)转染MyoD1-like-pEGFP-N1质粒组。标尺:100 μm。(A), (A’) Expression of MyoD1-like-pEGFP-N1 plasmid in cells at 24 h. (B) Control group. (C) Negative control group. (D) pEGFP-N1 empty plasmid group. (E) Treatment group. Scale bar, 100 μm.)
3 讨论
3.1 许氏平鲉MyoD1基因的分子特征
本研究鉴定了许氏平鲉MyoD1基因两个亚型,这与文昌鱼(BranchiostomabelcheriGray)中含有两个MyoD1基因相类似[26]。在许氏平鲉肌肉中,MyoD1-like基因占主导地位,这可能与启动子多态性及DNA甲基化相关[27-28]。此外,MyoD1的基因组含有完整的内含子和外显子序列,而MyoD1-like基因只含外显子,因此也可能是基因结构的不同造成了两者转录效率的不同。许氏平鲉MyoD1-like氨基酸与其他鱼类、哺乳动物类似,有保守的氨基酸序列和bHLH、α螺旋(helixⅢ)结构域。在哺乳动物还是在鱼类中,上述两个结构域均为MyoD1蛋白调节肌肉生长的重要结构[5-7]。此外,氨基酸肽链的长度存在随进化地位升高而变长趋势[29-30]。不同鱼类MyoD1氨基酸肽链的长度也存在差异,其中,碱性区域的差异多于螺旋环区域[29]。系统进化树显示,许氏平鲉的MyoD1-like与其他硬骨鱼同源基因聚类为一支,说明了许氏平鲉的MyoD1-like在进化上相对保守,这也反映了不同物种的MyoD1基因在肌肉发育中的调控功能具有相似性[19]。
3.2 许氏平鲉MyoD1s基因的组织表达特征
在大多数鱼类的各个组织中均存在MyoD1基因的表达,在肌肉中的表达显著高于其他组织,如兰州鲇鱼(Silurusasotus)、团头鲂(Megalobramaamblycephala)[17,19]。许氏平鲉MyoD1s基因同样在各组织中都有表达,且肌肉组织的表达量显著高于其他组织,说明其在许氏平鲉肌肉发育调控过程中扮演了至关重要的角色。
鱼类胚后的肌肉发育主要包括增生和肥大两个过程,肌肉的增生和肥大受多种调控网络的调控[31-34],其中生肌调节因子家族(Myogenic regulatory factors, MRFs)在肌纤维的形成和分化中扮演着非常重要的角色[35]。许氏平鲉在100天时,MyoD1s基因有一个高表达,这说明此阶段肌肉中的成肌细胞发生了显著的增生[36],这也与黄鳝[15]的研究结果相似。
3.3 许氏平鲉MyoD1s基因的空间表达特征
MyoD1基因是增殖的成肌细胞的标记基因[37]。成肌细胞位于肌纤维的边缘,在肌肉生长或损伤修复过程中能够自我更新和分化[37-38]。MyoD1基因在组织中的细胞定位研究主要集中在小鼠中[39-40],鱼类中研究较少。斑马鱼MyoD1基因的定位主要是在胚胎中进行[22-23]。本研究证明许氏平鲉MyoD1s阳性细胞的表达位置在肌纤维的边缘,位于肌纤维之间,即成肌细胞增殖和分化的位置,这与小鼠肌肉中MyoD1阳性细胞所在位置一致[5,39,41]。此外,出生后100天肌肉组织中表达MyoD1s基因的细胞数目明显多于180天肌肉组织,说明在出生后100天肌肉组织中有更多处于增殖分化状态的成肌细胞。
3.4 许氏平鲉MyoD1-like基因的过表达诱导成肌细胞系C2C12的分化
肌肉前体细胞的命运决定和进入肌细胞程序由基因调控网络控制[42-43]。在不同的基因调控网络中,MRFs基因家族发挥了重要作用。作为MRFs基因家族的重要一员,MyoD1基因的表达量决定了成肌细胞的命运[1]。MyoD1基因表达量的升高可以诱导肌肉前体细胞趋向分化。之前的研究中,将线鳍电鳗的MyoD1基因转到MyoD1基因缺失的小鼠中,能够诱导小鼠的胚胎细胞转化为肌管。本研究中,过表达许氏平鲉MyoD1-like基因可诱导小鼠成肌细胞发生分化,融合形成肌管,这与山羊中MyoD1基因过表达可以调控成肌细胞分化融合为肌管的研究[44]相一致,这也进一步说明了MyoD1基因的功能在不同物种中具有高度的保守性。
4 结语
本研究鉴定了许氏平鲉MyoD1基因的两个拷贝,分别命名为MyoD1和MyoD1-like。MyoD1s主要在肌肉中表达,且MyoD1-like的表达量要显著高于MyoD1,表达效率显著差异的分子机制有待进一步研究。此外,MyoD1-like基因的过表达可以诱导成肌细胞分化,融合形成肌管,证明MyoD1基因功能在不同物种中具有高度的保守性。该结果为研究MyoD1基因在经济鱼类肌肉生长发育过程中的调控作用奠定了基础。

