金锡杉中紫杉醇合成途径GGPPS和TDC1的基因序列与时空表达分析*
刘彦君,王云鹏
(1. 上海交通大学医学院,上海 200003; 2. 中国海洋大学海洋生命学院,山东 青岛 266003)
紫杉醇是一种植物体内天然合成的二萜生物碱类药用化合物,其本身具有高效的抗癌作用。1979年Schiff P.B 等[1]首次发现紫杉醇能够抑制肿瘤细胞的纺锤体生成,从而揭示了其抗癌作用的机理。目前,紫杉醇主要应用于临床上治疗卵巢癌和乳腺癌等多种类型的癌症,由于其治疗效果极佳,因此紫杉醇被称作近十年以来科学家所发现的一种最有研究价值和治愈癌症希望的药物[2-4]。
一直以来,紫杉醇的生产是应用上的瓶颈,治愈一位癌症前期的病人需要两到四株成年红豆杉才能获得足够量的紫杉醇。这是因为其在红豆杉植株中本身合成率较低,含量较少,且紫杉醇的化学结构较为复杂,合成途径及部分反应原理尚未明确,因此运用化学合成的方法来获得紫杉醇其难度较大,也正因为这两种原因,紫杉醇的生产量一直较低,供需之间存在巨大的矛盾[5]。为了解决供需之间这一显著矛盾,国内外科学家一直致力于研究运用不同的方法来提高紫杉醇的合成产量[6-10]。
紫杉醇的生物合成途径总共分为三个阶段:紫杉烷环母核结构的形成、侧链苯基异丝氨酸的合成以及最终合成产物紫杉醇。前体紫杉烷合成途径中主要涉及到两种关键酶,第一种就是牦牛儿基牦牛儿基焦磷酸合酶(Geranylgeranyl diphosphate synthase,GGPPS),该酶是紫杉醇前体合成途径中的一种关键的异戊烯转移酶,其能够催化异戊烯焦磷酸与甲基丙烯基焦磷酸生成二萜类化合物的一个共同前体——牦牛儿基牦牛儿基焦磷酸(GGPP)[11]。另外一种则是紫杉烯合酶(Taxadiene synthase,TS),该酶位于GGPPS的下游,负责将生成的GGPP转化为具有紫杉烷骨架的母体烯烃,是紫杉醇前体紫杉烷合成途径中的限速酶,其表达量的高低同样能够显著影响紫杉醇前体的产量[12]。由于这两种酶在紫杉醇前体合成途径中起到关键性作用,因此研究其编码基因GGPPS和TDC1的表达特征便尤为重要。
金锡杉是一种南方红豆杉的自然变异品种,成熟后其假种皮呈金黄色,经过一系列检测,发现其紫杉醇含量高于原种,因此,是一种重要的遗传资源,具有一定的研究价值。以此为基础,本研究拟采用分子生物学方法,检测变异种材料中与紫杉醇前体合成代谢途径相关的两种关键酶基因GGPPS和TDC1的时空表达模式,揭示这两个基因的表达特征,为深入研究紫杉醇的代谢调控奠定基础。
1 材料和方法
1.1 材料
实验材料 实验材料主要取自于位于江苏省无锡市的南方红豆杉栽培品种‘金锡杉’(Taxuswallichianavar.maireicv.‘Jinxishan’),分别采取春季‘金锡杉’的树叶以及夏季‘金锡杉’的树叶、树皮、树枝和果实,-80 ℃保存备用。
酶与试剂 逆转录试剂盒(Transcriptor First Strand cDNA Synthesis Kit) TakaRa公司产品;PCR试剂(Premix TaqTM,Code) TakaRa生物有限公司产品;RNA试剂盒OMEGA公司产品;溴化乙锭(EB) ;DNA 分子量标准(DL 2000 bp) TakaRa 生物工程有限公司产品。
1.2 方法
1.2.1 引物设计 依据NCBI数据库中基因GGPPS(AF081514)和TDC1(U48796.1)的序列,利用Primer软件进行引物设计,GGPPS上下游引物分别为:F:5’-GAGGGAAGCCCACAAATCAC-3’,R: 5’-CCACAACCTGAAGCAGAAGC-3’,产物长度为380 bp。TDC1上下游引物分别为:F:5’-GGGCACAGCCAAGTAGAACA-3’,R:5’-AATACATACAGGGC ACGCAG-3’,产物长度为429 bp。
1.2.2 生物信息学分析 开放阅读框架预测由NCBI的ORF finder程序(http://www.ncbi.nih. gov/gorf/gorf.html)完成;蛋白质一级结构的预测运用ProtParam程序(http://www. expasy.org/tools/protparam.html)和ProTDC1cale程序;跨膜区域预测由Tmhmm程序完成(http://www.cbs.dtu.dk/services/TMHMM/);蛋白质亚细胞定位通过TargetP程序完成(http://www.cbs.dtu.dk/services/TargetP/);蛋白质信号肽预测运用SignalP完成(http://www.cbs.dtu.dk/services/ SignalP/)。
1.2.3 RNA提取 总RNA的提取参照OMEGA公司的RNA提取试剂盒中的说明书的方法进行,提取的总RNA用紫外分光光度计进行定量检测,并用1.0%琼脂糖凝胶电泳检测RNA质量,于-80 ℃保存备用。
1.2.4 cDNA合成 采用大连TaKaRa公司的cDNA反转录试剂盒中说明书上的cDNA合成体系,将2 μL的Oligo DT加入到8 μL的样品RNA中,轻微混匀。70 ℃下反应10 min后,迅速冰浴1 min,然后加入如下试剂:1 μL 10 mmol·L-1 dNTP Mixture,1 μL M-MLV(24 U/μL),4 μL 5×RT buffer,0.5 μL RNase Inhibitor(40 U/uL),3.5 μL DEPC H2O。混匀后低速离心,放入PCR仪中42 ℃反应60 min,然后95 ℃终止反应5 min,所得产物于-20 ℃冰箱保存备用。
1.2.5 半定量PCR扩增 选用一个内参基因(18S rRNA)做参照标准来观察比较GGPPS和TDC1在不同时期以及不同组织中的表达情况。PCR扩增体系:总体积25 μL,其中2.5 μL 10×PCR buffer,2 μL MgCl2(25 mmol·L-1),0.5 μL 10 mmol·L-1 dNTP,1 μL primer-F(10 μmol·L-1),1 μL primer-R(10 μmol·L-1),1 μL cDNA,0.25 μL Taq酶(购自TaKaRa公司),16.75 μL ddH2O。PCR反应条件:95 ℃预变性5 min,95 ℃ 30 s,58 ℃ 30 s,72 ℃40 s,28个循环。72 ℃延伸10 min。得到的PCR产物取20 μL,经1.5%琼脂糖凝胶电泳后,在紫外灯下拍照观察,所有PCR扩增实验重复两次。
2 结果与分析
2.1 GGPPS和TDC1基因序列及其编码蛋白的生物信息学分析
2.1.1 GGPPS和TDC1的序列特征 GGPPS的基因全长序列为1 889 bp,该基因能够编码393个氨基酸。运用Protparam程序预测发现其蛋白分子量约为42.7 kDA,等电点为5.58,是一种不稳定的脂溶性蛋白。
TDC1的基因全长序列为2 700 bp,该基因能够编码862个氨基酸。运用Protparam程序预测发现其蛋白分子量约为98.0 kDA,等电点为5.28,是一种不稳定的亲水性蛋白。
2.1.2 GGPPS和TDC1蛋白的特点分析 利用Tmhmm程序分析GGPPS和TS的跨膜区域,发现这两种蛋白均没有跨膜区域,不属于跨膜蛋白,因此预测这两种蛋白存在于膜内;进一步通过TargetP程序对GGPPS和TS的亚细胞定位进行预测,结果如表1所示,这两种蛋白的氨基酸序列中均含有线粒体靶向肽,因此属于胞内酶。同时运用SignalP-4.1 prediction程序对这两种蛋白的信号肽进行分析预测,结果发现这两种蛋白没有信号肽序列,属于非分泌性蛋白。

表1 蛋白质GGPPS和TS亚细胞定位预测结果
2.2 ‘金锡杉’各组织RNA提取
提取的‘金锡杉’各组织总RNA经紫外分光光度计检测,显示OD260/OD280的值均在1.8~2.0之间;1%的琼脂糖凝胶电泳检测结果如图1所示,各组织的总RNA完整性较好,无降解现象,且纯度较高,可应用于后续实验。
2.3 GGPPS基因的表达特征分析
2.3.1 不同季节时关键酶基因GGPPS的表达量分析 从‘金锡杉’叶片中GGPPS的表达水平图2可以发现,春季和夏季叶片中均能检测到GGPPS的表达,春季GGPPS的表达量比夏季明显高,这表明GGPPS具有显著得时间表达特异性。
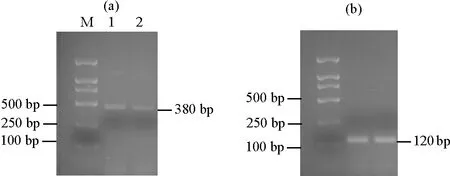
((a)GGPPS表达量。The GGPPS expression;(b)内参基因18S rRNA表达量。The 18S rRNA expression;M:DL 2000 marker,1:春季树叶,2:夏季树叶。M:DL 2000 marker,1:Spring leaves,2: Summer leaves.)
2.3.2 不同组织部位中关键酶基因GGPPS的表达量分析 同期对‘金锡杉’叶片、树皮、树枝和果实中GGPPS的表达情况进行检测,结果如图3所示,树叶、树皮、树枝和果实中均能检测到GGPPS的表达,树叶中GGPPS表达量最高,树枝和果实中次之,树皮中表达量最少,结果表明GGPPS具有显著的组织表达特异性。
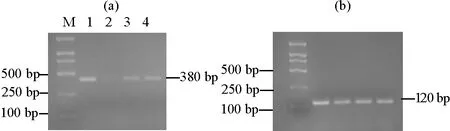
((a)GGPPS表达量。The GGPPS expression;(b)内参基因18S rRNA表达量。The 18S rRNA expression;M:DL 2000 marker,1:树叶组织,2:树皮组织,3:树枝组织,4:果实组织。M:DL 2000 marker,1: Leaves,2: Barks,3: Branches,4: Fruits.)
2.4 TDC1基因的表达特征分析
2.4.1 不同季节关键酶基因TDC1的表达量分析 由图4可知,季节的更迭与‘金锡杉’叶片中基因TDC1的表达情况之间呈现一定的相关性,具体表现为春季TDC1的表达量要略微高于夏季。这一结果表明基因TDC1同样具有一定的时间表达特异性。
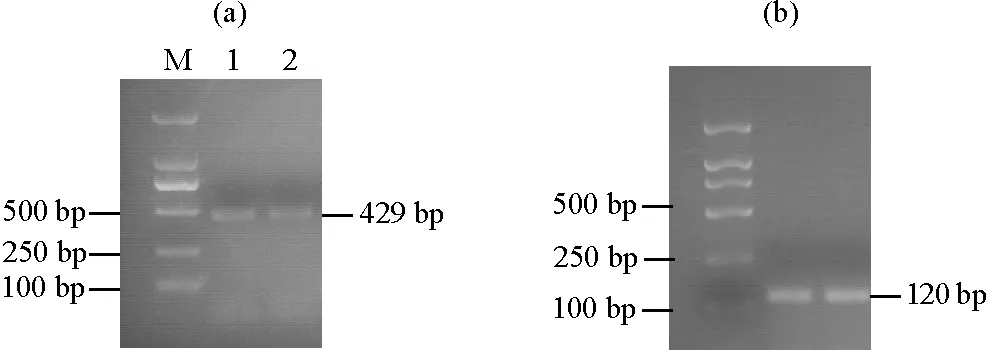
((a)TDC1表达量。The TDC1 expression;(b)内参基因18S rRNA表达量。The 18S rRNA expression;M:DL 2000 marker,1:春季树叶,2:夏季树叶。M:DL 2000 marker,1:Spring leaves,2: Summer leaves.)
2.4.2 不同组织部位中关键酶基因TDC1的表达量分析 通过采用与检测GGPPS表达情况相同的技术手段对‘金锡杉’树叶、树皮、树枝和果实中TDC1的表达水平进行检测分析,结果如图5所示,TDC1的表达与GGPPS有所异同,TDC1同样能够在树叶、树皮、树枝和果实中表达,但在树皮中表达量最高,树枝中表达量最少,这一结果表明基因TDC1同样具有一定得组织表达特异性,但具体表达模式却明显区分于GGPPS。
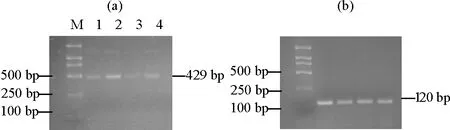
((a)TDC1表达量。The TDC1 expression;(b)内参基因18S rRNA表达量。The 18S rRNA expression;M:DL 2000 marker,1:树叶组织,2:树皮组织,3:树枝组织,4:果实组织。M:DL 2000 marker,1: Leaves,2: Barks,3: Branches,4: Fruits.)
3 讨论
‘金锡杉’是一种南方红豆杉的自然变异品系,相比于原种其紫杉醇含量更加丰富,是一种更具有生产应用价值的资源,但是对于其内在的影响紫杉醇表达量的关键因素尚未有人报道。本研究选取了紫杉醇合成途径中的两种关键酶基因GGPPS和TDC1,运用生物信息学以及半定量PCR技术分析得出在‘金锡杉’中这两种酶基因具有显著得时空表达特异性,这表明当外界环境因素发生变化时,会显著影响GGPPS和TDC1两种酶基因的表达活性,从而进一步影响紫杉醇的最终产量。
生物酶的活性会显著受到温度、湿度以及酸碱度等外界环境因素的影响,其活性的高低是决定酶促反应产物含量的关键性因素。芦站根等[13]发现,光照条件对于红豆杉植株的次生代谢反应有显著影响,相比于强光,红豆杉植株利用弱光的能力更强,在遮荫条件下,更适宜红豆杉植株生长,有利于其次生代谢反应及相应同化产物的积累。Wheeler等[14]在对研究不同短叶红豆杉的生态群落时发现水分条件也能够对植株的次生代谢反应产生影响,相比于温暖、干净的环境,红豆杉植株在潮湿、凉爽的环境下,其紫杉醇含量要更高。结合以上两点,推测在相对遮荫、凉爽和潮湿的环境下,会更有利于红豆杉植株的次生代谢反应,春季时期,光照强度适宜,气候潮湿,而夏季时期,太阳光强度较高,湿度较低,相比之下,春季时期的环境因素更有利于红豆杉植株自身的次生代谢反应,因此也能够合成更多的紫杉醇,这也与本研究分析得出的GGPPS和TDC1两种酶基因在春季时期表达活性更高这一结果相一致。我国的红豆杉植株大多为自然资源,鲜少有能将其人工培育至成熟期的案例,期望这一结果能够为人工栽培红豆杉,提高其生存率提供一定的理论基础。
处于成熟期的红豆杉含有丰富的紫杉醇,但是在其不同组织部位中,紫杉醇含量却有显著地差异性。郑德勇等[15]研究南方红豆杉的不同组织对于紫杉醇含量影响时发现,树皮中的紫杉醇平均含量为0.030 2%,分别为其针叶和木质部中含量的7和9.8倍。李郑娜等[16]运用荧光定位技术在研究银杏中GGPPS的转运机制时发现,其主要定位于植株的叶片中。本研究发现的GGPPS和TDC1两种酶基因具有组织表达特异性这一结果也与上述研究有所关联,GGPPS主要在植株的叶片中表达量较高,而TDC1主要在植株的树皮中发挥表达活性,因此推测红豆杉的树叶和树皮是进行紫杉醇合成反应的重要场所,希望这一结果能够为未来运用红豆杉组织培养法来进行工业化大规模生产紫杉醇这一途径提供了理论参考。
红豆杉虽种类繁多,但部分品种间亲缘性较高,其理化性质存在一定程度的相似性[17]。徐敏等[18]基于ITS序列分析变异品系与近缘类群的亲缘关系,发现黄色假种皮南方红豆杉与南方红豆杉原种的遗传距离为0,与中国红豆杉遗传距离为0.010,因此我们推测在金锡杉中发现的GGPPS和TDC1两种酶基因的表达特征可能同样适用于原种及其他部分品系红豆杉。
尽管本实验主要发现了紫杉醇前体紫杉烷合成途径所涉及的两种关键酶基因GGPPS和TDC1的表达模式,但后续关于一系列紫杉烷的修饰反应以及侧链合成反应所涉及的相应酶基因的表达特征仍未清楚,这主要与其相关酶基因表达量较低相关,如何检测这类酶基因的表达活性是下一步实验研究的方向。

