小米多酚及复配剂体系对花生油的抗氧化作用
朱俊玲 梁 凯 闫巧珍 陈振家 荆 旭 伊 莉 王晓闻 柳青山
(山西农业大学食品科学与工程学院;山西功能食品研究院1,太谷 030801) (山西省农业科学院高粱研究所2 ,晋中 030600)
柳青山,男,1968年出生,研究员,农学植物营养
小米营养丰富,适用人群广,是餐桌上的健康佳品。小米中多酚类物质具有抗氧化、抗癌、抑菌等多种生理功能,对人体健康起着积极的作用[1]。花生油色泽清亮透明,气味芬芳,易于消化,其中不饱和脂肪酸含量达到80%以上,因其不饱和脂肪酸含量较高,花生油易于发生氧化变质,生成自由基、过氧化物及醛、酮等化合物,摄入过量的酸败油脂会损害人体健康。在实际生产中多采用人工合成抗氧化剂防止氧化变质,如2,6-二叔丁基-4-甲基苯酚(BHT)、丁基羟基茴香醚(BHA)、叔丁基对苯二酚(TBHQ)等,这些人工合成的抗氧化剂对人体健康存在着潜在的威胁[2]。天然抗氧化剂因其安全、高效的优点,是近些年来食品行业研究和应用的热点之一,多酚类化合物因其较强抗氧化活性,在油脂抗氧化中发挥了重要作用。欧阳梦云等[3]研究得出白藜芦醇具有优异的抗油脂氧化性,与茶多酚、柠檬酸和VE复配之后表现出较好的协同作用。
本研究将提取的小米多酚经AB-8大孔树脂纯化并分析其对花生油的抗氧化作用,选择VC、VE、柠檬酸与小米多酚进行复配,以过氧化值、茴香胺值和全氧化值为指标,得出最佳复配组,并与常见人工抗氧化剂进行对比。同时采用气相色谱-甲酯化法对加入小米多酚复配抗氧化剂的花生油脂肪酸成分进行测定。
1 材料与方法
1.1 材料与试剂
小米(东方亮1号),压榨一级花生油(不含有任何抗氧化剂):市售。AB-8大孔树脂、异辛烷、p-茴香胺、三氟化硼、抗坏血酸(VC)、VE(脂溶性),分析纯。聚甘油脂肪酸脂(PEG)、蔗糖脂肪酸脂、磷脂、单硬脂肪酸甘油酯、柠檬酸、2,6-二叔丁基-4-甲基苯酚(BHT)、叔丁基对苯二酚(TBHQ),食品级。
1.2 仪器与设备
UV-1100型可见分光光度计,DHP-9032型恒温培养箱,DHG-9240型电热恒温鼓风干燥箱,FA25型高速组织分散均质机,GCMS-QP2010型气相色谱质谱联用仪。
1.3 方法
1.3.1 小米多酚的提取
小米多酚的提取参照闫巧珍等[4]复合酶法提取小米多酚的方法。
1.3.2 小米多酚的分离纯化
将AB-8大孔树脂正确装柱(Φ2.6 cm×30 cm),柱床体积为3/4,将小米多酚冻干粉配制成一定浓度的多酚溶液后上柱分离纯化,每5 mL洗脱液为1管。具体方法为:取100 mL小米多酚粗提液通过0.45 μm有机滤膜,根据王若兰等[5]的方法对小米多酚进行分离纯化。收集洗脱液,浓缩冻干成粉。
1.3.3 小米多酚抗油脂氧化作用的研究
1.3.3.1 评价指标的测定
过氧化值(POV)的测定参照GB/T 5538—2005[6]。茴香胺值(AV)的测定参照GB/T 24304—2009[7]。全氧化值按照公式计算:
TV=2POV+AV
式中:TV为全氧化值;POV为过氧化值/mmol/kg;AV为茴香胺值。
1.3.3.2 乳化剂种类及其浓度的选择
将不同种类的乳化剂:聚甘油脂肪酸脂(PEG)、蔗糖脂肪酸脂、磷脂、单硬脂肪酸甘油酯,设置质量浓度为1%、2%、3%,加入20 g花生油中,混匀后加入0.05%的小米多酚,将混合物进行均质化处理(1 000 r/min)。采用Schaal烘箱法,将处理后的混合物敞口置于电热鼓风干燥箱中,设置温度为(65±1) ℃,每隔12 h超声处理且改变其在干燥箱中的位置,同时设置空白对照,只含有花生油的空白组1,花生油和0.05%小米多酚的空白组2[8]。此后每2 d取出测定其茴香胺值,观察其茴香胺值的变化,选择最佳乳化剂及其浓度。
1.3.3.3 小米多酚添加量的选择
将选择的乳化剂加入到20 g花生油中混匀,设置小米多酚质量浓度分别为0.02%、0.04%、0.06%、0.08%、0.10%,加入花生油中后将其混合物进行均质化处理(1 000 r/min)。采用Schaal烘箱法,按照1.3.3.2的方法操作,同时设置空白对照,只含有花生油空白组。此后每2 d取出测定其茴香胺值,观察其茴香胺值的变化,选择小米多酚的最佳添加量。
1.3.3.4 增强剂与小米多酚复配对花生油抗氧化效果的影响
将乳化剂加入到20 g花生油中混匀,加入最佳量的小米多酚,选择与小米多酚具有协同增强作用的物质:VC、柠檬酸、VE,设置质量浓度为0.02%、0.04%、0.06%,分别加入花生油中,将其混合物进行均质化处理(1 000 r/min)。采用Schaal 烘箱法按照1.3.3.2的方法操作,设置空白对照,只含有花生油的空白组1和含有乳化剂和小米多酚的花生油的空白组2。此后每2 d取出测定其茴香胺值和过氧化值,并计算全氧化值,得出最佳抗氧化复配组。
1.3.3.5 最佳抗氧化复配组与其他抗氧化剂的比较
取0.02%BHT、0.02%TBHQ与最佳复配组对花生油的抗氧化效果进行比较,重复以上步骤,测定其过氧化值和茴香胺值,并计算全氧化值。
1.3.4 气相色谱-质谱分析小米多酚复配剂对花生油脂肪酸含量的影响
1.3.4.1 样品甲酯化处理
参照GB/T 17376—2008,将含有复配抗氧化剂和空白对照的花生油进行甲酯化处理[9]。
1.3.4.2 气相色谱-质谱分析条件
色谱条件:ZB-5色谱柱(60 m×0.25 mm,0.25 μm);载气为高纯度氦气(纯度>0.999 9);检测器及温度为FID检测器,260 ℃;载气流速为1 mL/min;进样量为1 μL;分流比为20:1;进样口温度:280 ℃;升温条件为,160 ℃(1 min)—速度为8 ℃/min升至190 ℃(20 min)—速度为5 ℃/min升至230 ℃(10 min)。
质谱条件:离子源及其温度为EI源,230 ℃;扫描范围为40~500 u;电子能量为70 eV。
1.3.5 数据分析与处理
实验数据采用Excel进行整理,采用Origin9.1绘图,用SPSS23.0进行统计分析,采用Duncan多重比较进行差异性分析。所有实验独立重复3次。
2 结果与分析
2.1 小米多酚抗花生油氧化的研究
2.1.1 乳化剂种类及其浓度的选择
由表1可知,空白组2和加入乳化剂的各实验组均对花生油的氧化起到了一定的抑制作用,表明小米多酚对油脂氧化有明显的抑制作用。加入乳化剂的实验组与空白组2相比,其茴香胺值较低,故乳化剂起到了一定的助溶作用。随着氧化时间的增加,各组花生油的茴香胺值不断增大,同时在6 d后其增大趋势加快,这是因为在花生油氧化初期产生的次级产物醛类物质较少,故其茴香胺值较低[10]。较其他乳化剂组相比,加入大豆改性磷、聚甘油酯的花生油茴香胺值较低,但磷脂本身有抗氧化作用,所以不排除其在油脂氧化过程中充当了抗氧化剂的可能[11]。适量的乳化剂可以帮助小米多酚更好地溶入油中,乳化剂加入过少不足以形成稳定的乳化体系,加入过多则可能对阻碍小米多酚抗氧化作用的发挥,结合表1结果,选择浓度为2%的聚甘油酯作为本实验的乳化剂,此时对花生油茴香胺值的抑制率为63.07%。
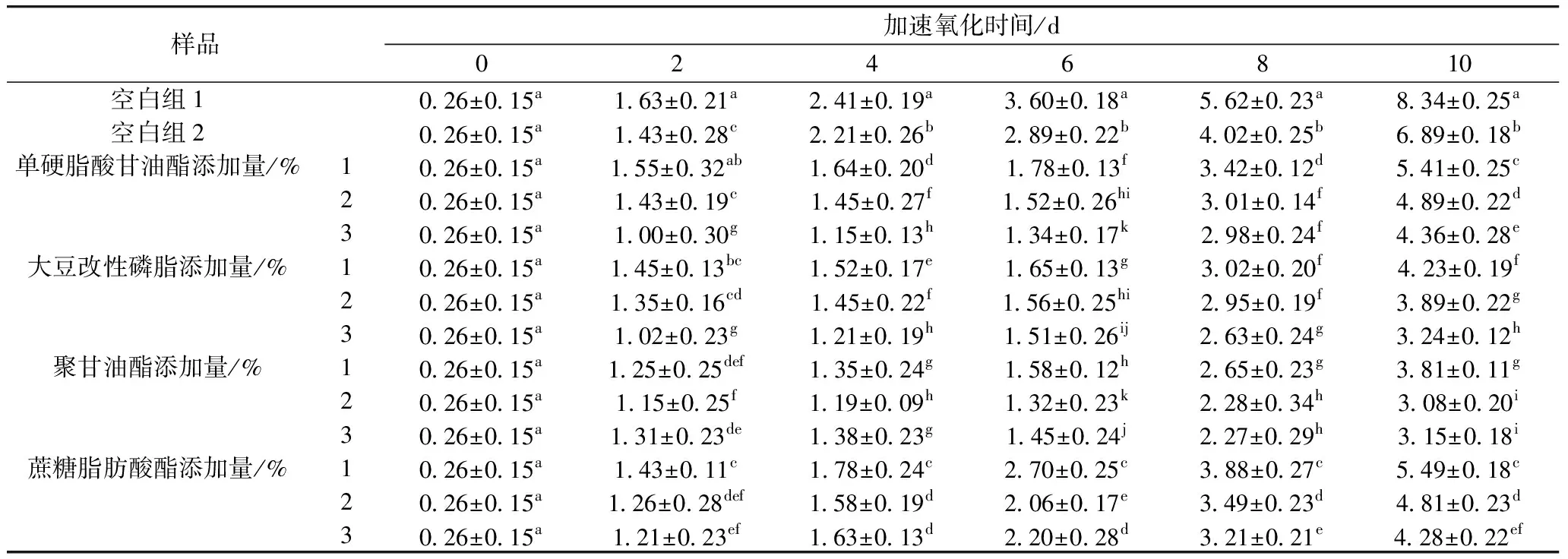
表1 乳化剂种类及用量对花生油茴香胺值的影响
2.1.2 小米多酚添加量的选择
由表2可知,随着氧化时间的增加,各组花生油的茴香胺值不断增大,且空白组较各实验组增长迅速,这说明小米多酚对花生油氧化具有明显的抑制作用。随着小米多酚添加量不断增大,茴香胺值呈现下降趋势。其添加量与抑制率基本呈现正相关,但质量浓度为0.10%时抑制率稍有下降,这可能是因为小米多酚易被氧化出现了副反应,其自由基会引发锁链反应,导致其抗氧化效果不再明显,所以浓度过高或是过低都会影响小米多酚对花生油的抗氧化效果[12]。根据实验结果,选用0.08%的小米多酚进行复配实验。
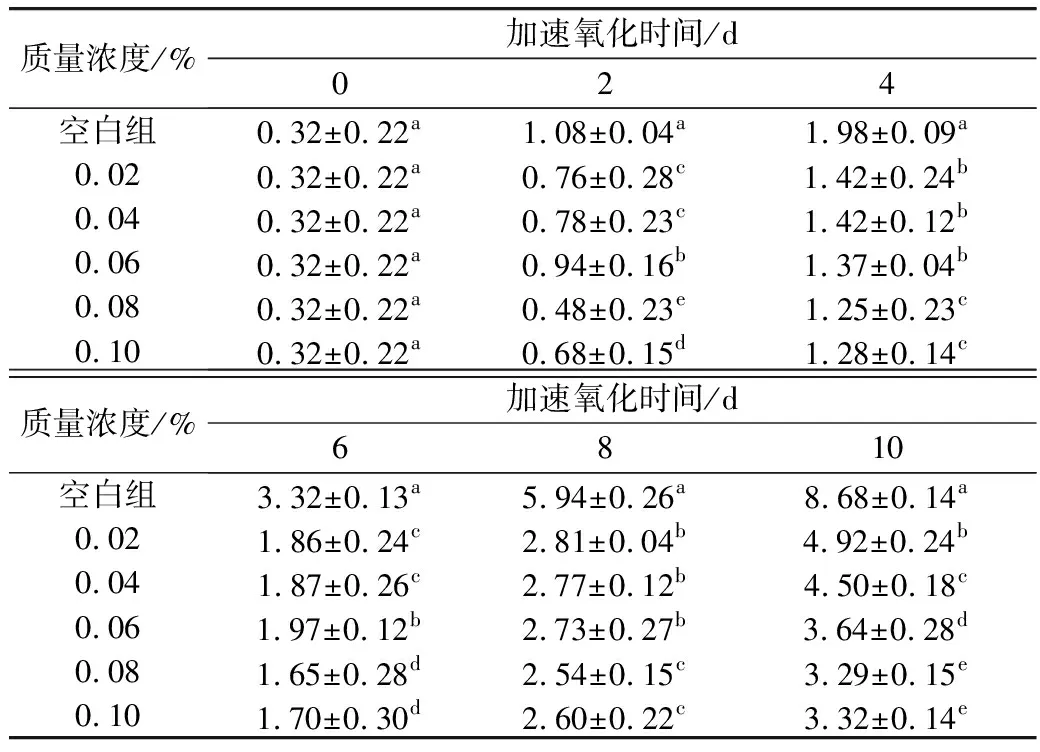
表2 不同浓度小米多酚对花生油茴香胺值的影响
2.1.3 增强剂与小米多酚复配对花生油抗氧化效果的影响
从表3~表5可知,添加小米多酚的实验组各值均低于空白组1,添加VC、VE和柠檬酸的复配实验组各值均低于空白组2。加速氧化到第10天后,不同复配实验组之间各值出现较大差异,酸败程度不一,VC复配组明显低于同一时间的其他各组(P<0.05),这可能是因为VC本身就具有较强的抗氧化性,和小米多酚共同发挥作用时,提供氢原子给小米多酚,使已脱氢的小米多酚重新合成原来的物质,VC本身成为脱氢抗坏血酸。同时VC提供了微酸的环境有利于小米多酚的稳定,在Schaal催化加速氧化中避免过快分解[13,14]。当VC质量浓度为0.04%时,表现出较好的抗氧化性能,这可能是VC添加量达到0.04%之后,随着浓度不断增加,活性氧含量增加幅度上升,导致抗氧化效果减弱。添加量为0.04%的VC作为增强剂时,花生油的过氧化值、全过氧化值茴香胺值依次为(1.89±0.06)、(19.23±1.21) mmol/kg、(80.69±3.21),对花生油3种指标的抑制率分别为57.55%、41.22%、42.26%。综上,得到最佳复配组为:0.08%小米多酚+2%聚甘油酯+0.04%VC。
2.1.4 最佳抗氧化复配组与人工抗氧化剂抗花生油氧化效果的比较
根据GB 2760—2014《食品添加剂使用标准》[15]的规定,采用0.02%的BHT、TBHQ进行实验。由表6、表7、表8可知,无论采用人工合成抗氧化剂还是VC与小米多酚复配体系进行抗氧化实验,花生油3种指标的变化趋势均随时间的增加呈上升趋势,各组均出现不同程度的酸败。各实验组的全氧化值全部高于空白组,到第10天时,各组之间3种值差异较大(P<0.05),同时从加速氧化前期到后期,复配组均比BHT、TBHQ抗氧化性强,其抗氧化能力依次为:最佳复配组>TBHQ>BHT。
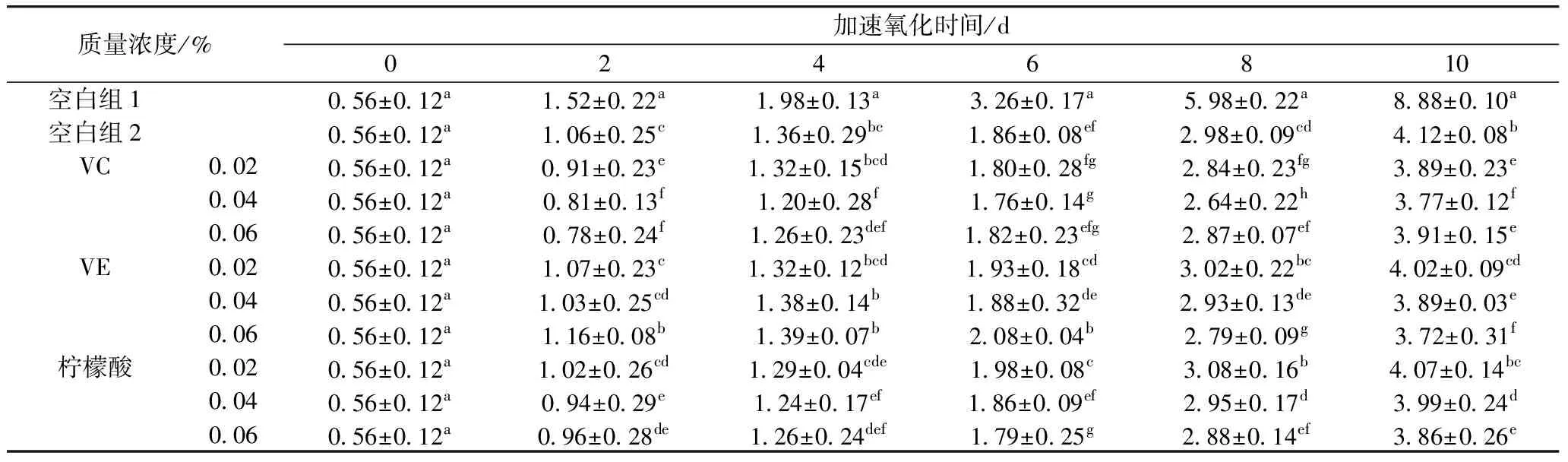
表3 VC、VE、柠檬酸与小米多酚复配后对花生油茴香胺值的影响
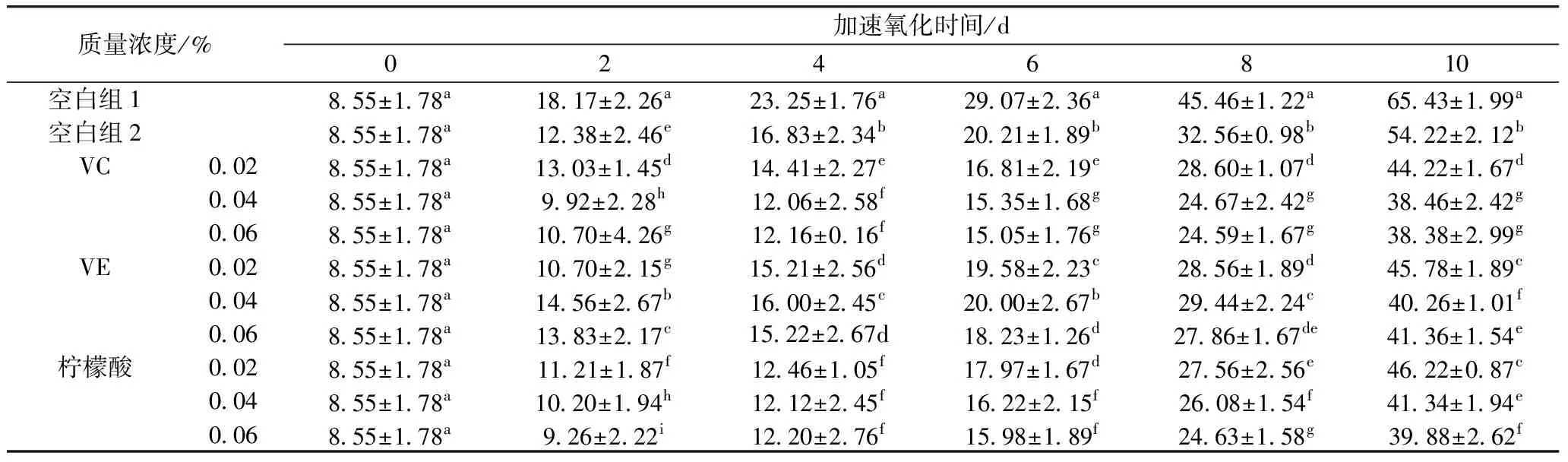
表4 VC、VE、柠檬酸与小米多酚复配后对花生油过氧化值的影响
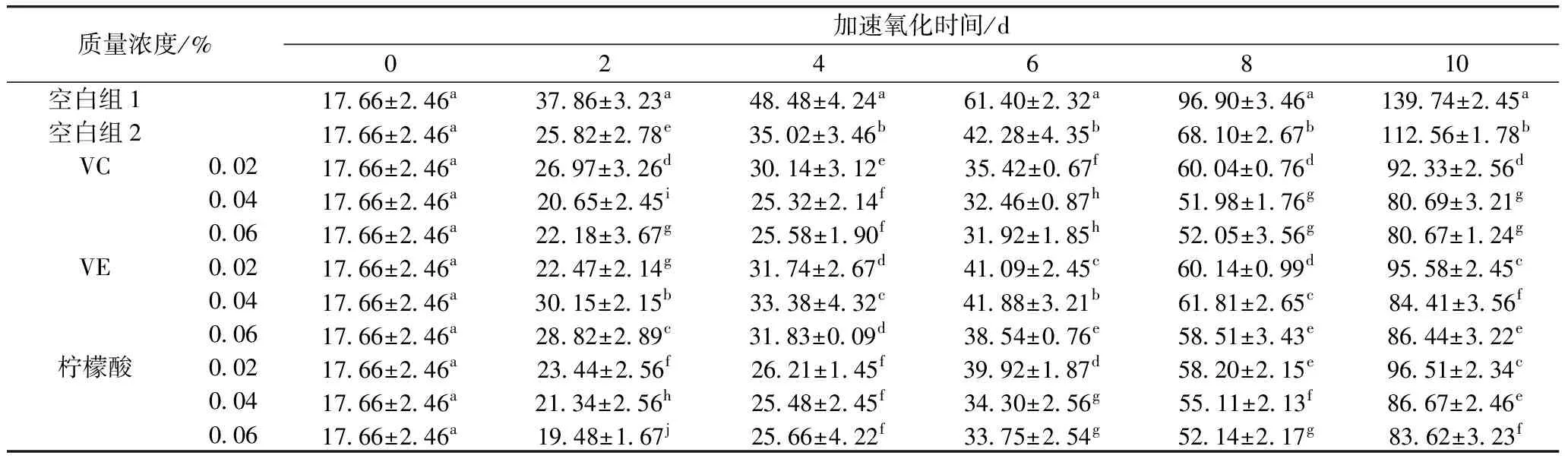
表5 VC、VE、柠檬酸与小米多酚复配后对花生油全氧化值的影响

表6 最佳复配组与BHT、TBHQ对花生油茴香胺值的影响

表7 最佳复配组与BHT、TBHQ对花生油过氧化值的影响
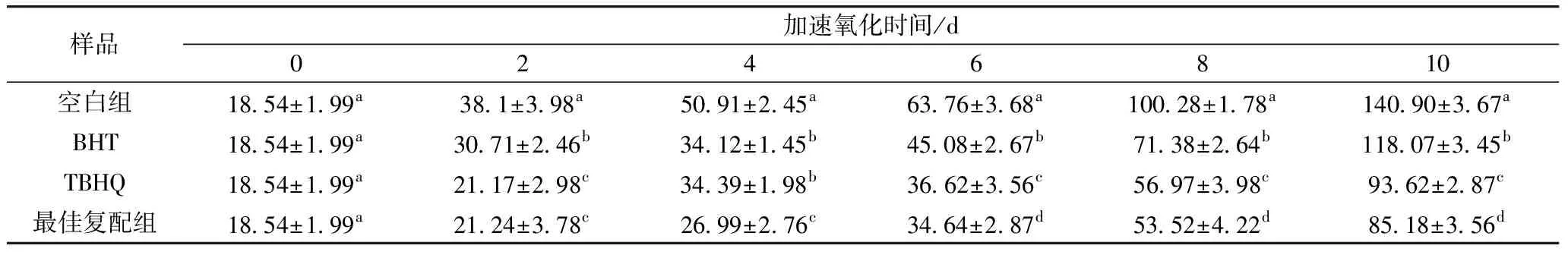
表8 最佳复配组与BHT、TBHQ对花生油全氧化值的影响
2.2 气相色谱-质谱分析花生油中脂肪酸含量变化
从表9中可得知,加速氧化12 d后,空白组和添加复配体系的油样较0 d其不饱和脂肪酸含量有所下降,分别为76.058%(空白0 d),74.450%(空白加速氧化12 d),74.904%(添加复配组加速氧化12 d),同时添加复配抗氧化剂的花生油(加速氧化12 d)的不饱和脂肪酸含量高于空白油样(加速氧化12 d),这表明,添加复配体系的抗氧化剂进一步延缓了饱和脂肪酸的生成,其抑制率为28.23%。
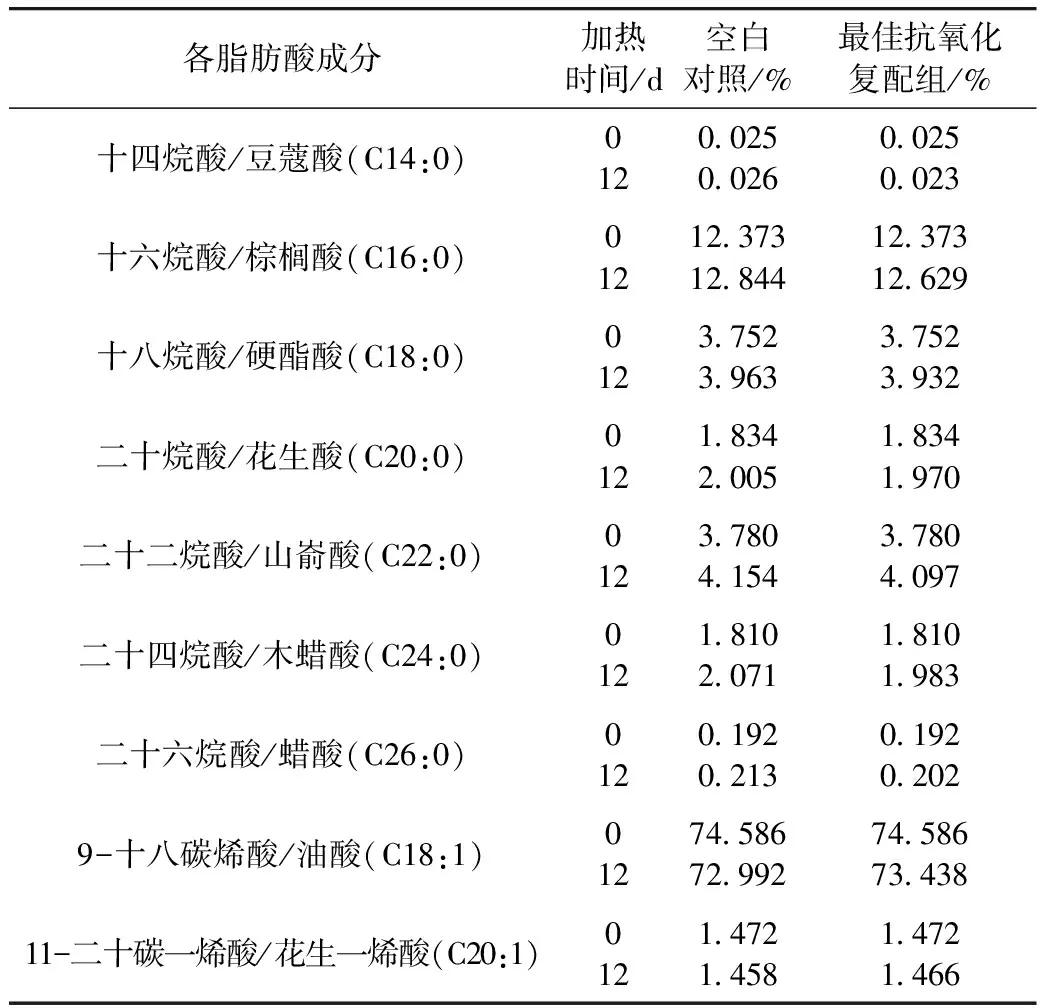
表9 VC与小米多酚抗氧化复配剂对花生油中主要脂肪酸含量的影响
3 讨论
由于小米多酚不能直接溶入油中,对其进行超声助溶效果也不理想,而将小米多酚溶入少量水加入油中会出现油水分层,所以加入适量的乳化剂(油包水型)可以形成均一稳定的油水混合物,以达到小米多酚的抗氧化效果。最终得出VC与小米多酚纯化物复配后其抗氧化效果甚至超过了人工合成的一些抗氧化剂(BHT、TBHQ)。但是如果在温度较高的条件下抗氧化效果可能会表现较差,因为如果加速氧化温度过高,小米多酚对热不稳定,容易发生分解,从而无法抑制游离脂肪酸的产生。本实验中采用的花生油为市售高油酸花生油,其特点为在增加油酸含量的同时降低亚油酸的含量,使花生油不易被氧化,稳定性得到改良。普通花生油中含有45%的油酸和35%的亚油酸,而高油酸花生油中油酸为75%左右,所以本实验花生油中所测得的油酸达70%以上。
4 结论
本研究得出复配体系为:2%聚甘油酯+0.08%小米多酚+0.04%VC,且抗氧化能力高于其他常用的人工抗氧化剂。加入复配组后在一定程度上可抑制花生油中不饱和脂肪酸向饱和脂肪酸的转化,抑制率达到28.23%。本实验仅对小米多酚抑制花生油氧化的机理需进行研究,而小米多酚对于其他动植物油脂的抗氧化作用仍需进一步探究。

