根瘤菌对广金钱草种子萌发及幼苗生长的影响
李娜 马祝铿 黄瑞华 刘潇晗 陈汶钊 杜勤


摘 要: 为探求促进广金钱草萌发及生长的有效途径,该文使用不同浓度的费氏中华根瘤菌、放射型根瘤菌以及田菁茎瘤固氮根瘤菌菌液分别浸染广金钱草种子,以蒸馏水浸泡种子为空白处理,研究其对广金钱草种子萌发指标(发芽率、发芽势、发芽指数、活力指数)的影响,并在温室培养40、60、80 d后分别测定广金钱草幼苗的生长指标(叶片数、分枝数、株高)及部分生理指标(叶绿素含量、含氮量)的变化。结果表明:(1)在1×107 CFU·mL-1浓度条件下,三种菌液浸种均获得最大萌发指标,其中田菁茎瘤固氮根瘤菌实验组效果最显著,发芽率、发芽势、发芽指数和活力指数高于对照组16.00%、9.33%、9.51和41.34%。(2)除田菁茎瘤固氮根瘤菌实验组外,其余实验组的廣金钱草幼苗叶片数、分枝数及株高均低于对照组。(3)放射型根瘤菌实验组和田菁茎瘤固氮根瘤菌实验组幼苗叶绿素含量相比对照组分别增加1.47%和7.47%,含氮量分别增加0.57%和5.17%。综上所述,三种根瘤菌菌液浸种均可在不同程度上提高广金钱草种子的发芽能力和植株生长期的叶绿素和含氮量,其中田菁茎瘤固氮根瘤菌具有最大正向影响,可有效提高种子萌发能力并促进植株生长。该研究可为不同地区广金钱草的种植和栽培提供技术指导,为开发田菁茎瘤固氮根瘤菌作为植物促生长菌剂提供理论支持。
关键词: 广金钱草, 根瘤菌, 萌发指标, 生长指标, 生理影响
中图分类号: Q945
文献标识码: A
文章编号: 1000-3142(2021)11-1931-08
Soaking effects of rhizobia on seed germination and seedling growth of Desmodium styracifolium
LI Na, MA Zhukeng, HUANG Ruihua, LIU Xiaohan, CHEN Wenzhao, DU Qin*
( College of Traditional Chinese Medicine, Guangzhou University of Chinse Medicine, Guangzhou 510006, China )
Abstract: In order to explore the effective way to promote the germination and growth of Desmodium styracifolium, in this paper, different concentrations of Sinorhizobium fredii, Rhizobium radiobacter, Azorhizobium caulinodans were used to soak the seeds of Desmodium styracifolium,
effects of these three kinds of rhizobium solution on the germination indexes (germination rate, germination potential, germination index and vigor index) of D. styracifolium seeds were investigated with
the seeds soaked in distilled water as control check (CK), and the growth indexes (number of blades, number of branches, plant height) and some physiological indexes (chlorophyll content, nitrogen content) of the seedlings were measured after 40, 60 and 80 d after transplant in greenhouse. The results were as follows: (1) Under the concentration of 1×107 CFU·mL-1, the maximum germination index could be obtained by soaking three kinds of rhizobium solution, among which the best germination rate, germination potential, germination index and vigor index in Azorhizobium caulinodans group were 16.00%, 9.33%, 9.51 and 41.34% higher than those in the control group. (2) The number of blades, number of branches and plant height of the seedlings treated by the Sinorhizobium fredii group and Rhizobium radiobacter group were lower than those of CK group, except for Azorhizobium caulinodans group. (3) The chlorophyll contents of Rhizobium radiobacter group and Azorhizobium caulinodans group increased by 1.47% and 7.47%, respectively, and the nitrogen contents increased by 0.57% and 5.17%, respectively. To sum up, the germination abilities, chlorophyll and nitrogen contents of the seeds of Desmodium styracifolium can be improved in different degrees by soaking the three rhizobia. Among them, Azorhizobium caulinodans group has the most positive effect, which could effectively improve the germination abilities of seeds and promote plant growth. This study can provide technical guidance for the planting and cultivation of Desmodium styracifolium in different areas, and provide theoretical support for the development of Azorhizobium caulinodans as a plant growth promoting agent.
Key words: Desmodium styracifolium, rhizobia, germination index, growth index, physiological effect
广金钱草来源于豆科植物(Desmodium styracifolium),以干燥地上部分入药,性微寒,味甘、淡,用于治疗黄疸尿赤、小便涩痛,具利尿通淋、利湿退黄的功效(中国药典,2015)。主要分布在广东、广西、四川、云南和福建等省(区)(廖红梅等,2019)。目前研究主要集中于成分及药理方面,广金钱草主要含有黄酮、酚酸、生物碱、萜类、甾醇、挥发油、多糖等成分,具有较好的抗炎、抑制肾结石形成的作用,常作为排石利胆片等制剂的主药(杨欣等,2019)。赖丽嫦等(2020)研究表明,广金钱草总黄酮部分可有效降低模型大鼠血清尿素氮(BUN)、血肌酐(Cr)水平,抑制肾组织草酸钙结晶的形成与沉积,减轻肾间质慢性炎症,对肾功能起到保护作用。随着人们对广金钱草需求的不断增加,野生资源透支趋势越来越明显(杨全等,2013)。现存野生资源已不能满足人们的医疗需求及国内外众多制药企业对中药原材料的需要,人们继而进行人工种植来扩大产量。广金钱草在广东和广西等地区有零散的种植,但未形成规模化生产,人工栽培技术的不完善及农药化肥的滥用,导致药材质量不稳定且污染土地(孙贤多等,2019)。随着广金钱草种植面积的扩大和产业化程度的提升,建立高产高质的人工辅助种植体系已迫在眉睫,筛选出提高种子萌发率和幼苗生长率的安全无害菌剂作为氮肥,对广金钱草的质量、产量提高及环境保护具有重要意义。
根瘤菌与农作物的生产关系密切,其中至关重要的是同豆科植物的共生固氮(王二涛,2016)。这种互作方式不仅能减少氮肥的使用,增加土壤有机质含量,从而改善土壤生态环境,还可提高互作植物的抗逆性及抗病性,促进植株生长,有利于维持生态平衡(赵叶舟等,2013)。诱导根瘤菌与豆科及非豆科植物互作生产共生固氮优质种苗,是栽培育种的热门研究方向(何国兴等,2020)。本文采用浸染法、培养皿纸上发芽法以三种不同根瘤菌浸种的方式,研究其对种子的发芽情况、生长指标及生理指标的影响,筛选提高广金钱草种子萌发能力的适宜菌液浓度及提高其产率、效率的优质菌种。本研究结果可为发掘优良根瘤菌种质资源提供实验依据,为完善和提高广金钱草的人工栽培技术提供理论支持和科学指导。
1 材料与方法
1.1 实验材料
1.1.1 种子和菌种 广金钱草种子于2018年11月上旬购自广东云浮栽培基地,经广州中医药大学杜勤教授鉴定为豆科植物广金钱草(Desmodium styracifolium)的种子;费氏中华根瘤菌(Sinorhizobium fredii,编号:GIM1.227)、放射型根瘤菌(Rhizobium radiobacter,编号:GIM1.757)购于广东省微生物保藏中心;田菁茎瘤固氮根瘤菌(Azorhizobium caulinodans,编号:ORS571)由西北农林科技大学刘华伟副教授提供。
1.1.2 试剂与仪器 试剂:酵母提取物、次氯酸钠、氯化钠、胰蛋白胨等均为分析纯,购自广东鼎国生物科技有限公司。仪器:JJ300型电子天平(常熟市双杰测试仪器厂);CX23型光学显微镜(OLYMPUS公司);THZ-100B型恒温培养摇床(上海一恒科学仪器有限公司);FK-YL04型叶绿素测定仪(山东方科仪器有限公司);血球计数板、pH计等实验耗材均购自广州华鑫仪器有限公司。
1.2 实验设计
1.2.1种子萌发阶段 优选籽粒饱满且品质均匀的广金钱草种子2 600粒,各200粒装于13个玻璃瓶内。依次用75%的乙醇消毒30 s(精确计时,下同)后置于有效氯浓度为5.7%的次氯酸钠溶液消毒10 min,无菌水漂洗4次。将对数生长期的费氏中华根瘤菌用无菌水稀释至1×106、1×107、1×108、1×109 CFU·mL-14个浓度梯度,各取20 mL分别装入4个培养瓶中(放射型根瘤菌、田菁茎瘤根瘤菌以相同方式处理),空白对照组(control check ,以下简称“CK”)培养瓶中装入20 mL蒸馏水,实验组与CK组均浸泡24 h。之后将种子转入贴好对应标签、直径9 cm的培养皿(铺有2层湿纱布、1层湿滤纸)中,每个菌种的不同浓度分为4个培养皿且每皿整齐摆放50颗(4组平行实验同时进行),加入6 mL对应处理液使纱布和滤纸饱和,将培养皿与种子一起称定重量并记录。以上步骤结束后将培养皿放置于光照培养箱,于28 ℃、湿度60%、12 h明/暗交替条件下培养。
试验过程中要确保发芽床湿润,每隔12 h加水至原重量,每隔24 h记录种子的发芽数,染霉菌的种子用消毒的镊子剔除,种子萌发结束后及时对幼苗鲜重、根长、株高进行测量,分析统计实验数据后测得萌发指标,筛选种子萌发适宜的菌液浓度。
1.2.2 幼苗生长阶段 从萌发结束的各菌种最适宜浓度培养皿中挑选萌发情况较好的3个培养皿,从每个培养皿中选出生长情况较好的3株幼苗,共36株幼苗。于2019年4月上旬将每株小苗单独移入有等量营养土的花盆中,放置于恒温(28±2)℃、恒湿60%的温室大棚中培养,各实验组与对照组分区摆放并编号。
待幼苗移入花盆后,每24 h记录一次生长情况,适当浇水和去除杂草虫蚜。从第40天开始测定生长指标(叶片数、分支数、株高)及生理指标(含氮量、叶绿素)(测定4片叶子的含氮量,剔除偏差较大的一个数据,其余3个数的平均值为最终数据,叶绿素同)。接下来每隔20 d(40、60、80 d)测一次生长指标及生理指标,得其变化曲线图,在80 d同时统计幼苗成活率及保苗率。
1.3 指标及测定方法
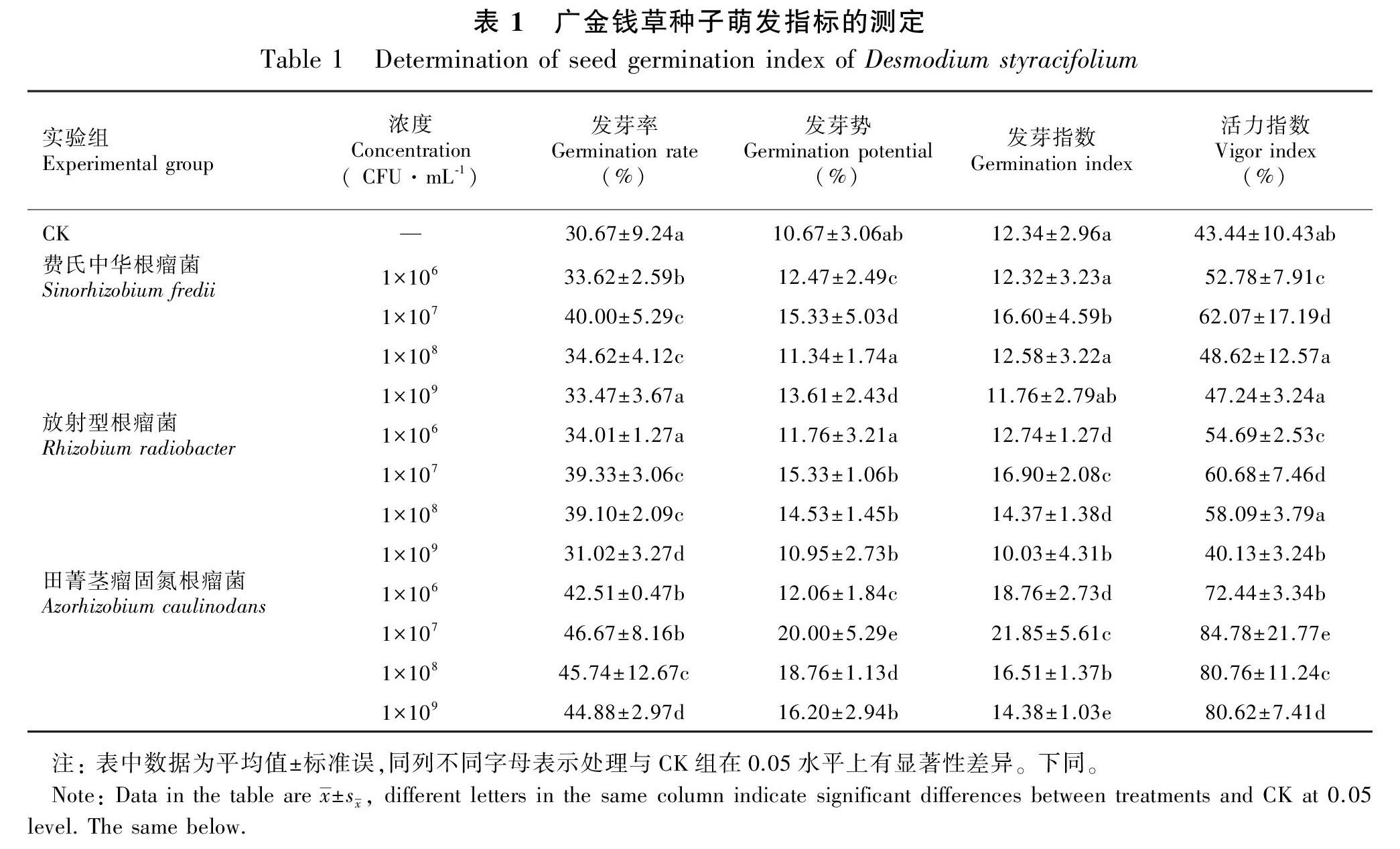
1.3.1 种子萌发指标测定 胚根突破种皮表明萌发开始(王毅敏等,2021),连续2 d再无种子萌发视为萌发结束。以达到50%发芽率的天數为初次计数时间,以种子萌发数达到最多,再无萌发种子出现时的天数为末次计数时间。发芽率(%)=萌发试验结束时正常发芽种子数/总供试种子数×100,发芽势(%)=3天后正常发芽种子数/总供试种子数×100,发芽指数=浸种t日的发芽数/相应的发芽天数,活力指数(%)=发芽指数×幼苗生长量(本实验使用长度)×100。
1.3.2 芽苗生长生理指标测定 株高使用皮尺测量,叶绿素及含氮量使用FK-YL04型叶绿素测定仪测定,以上数据与叶片数、分支数均取平均值为最终数据。
1.4 数据处理及分析
实验数据及图表均采用Excel软件制作,SPSS(24.0)软件进行统计分析,显著性P<0.05。
2 结果与分析
2.1 菌液对种子萌发的影响
萌发结果如表1所示, 20 d后种子萌发结束,不同浓度菌种实验组的发芽率、发芽势、发芽指数和活力指数均高于CK组,证明该浓度梯度下三种不同菌液浸种对广金钱草种子萌发均有正向影响。在相同浓度条件下,田菁茎瘤固氮根瘤菌实验组各项数据均大于其余实验组,浓度为1×107 CFU·mL-1的田菁茎瘤固氮根瘤菌实验组发芽率、发芽势、发芽指数和活力指数分别达到最大值46.67%、20.00%、21.85、84.78%,与CK组相比依次提高了16.00%、9.33%、9.51和41.34%。而对比相同根瘤菌不同浓度组可知,除放射型根瘤菌实验组在1×107、1×108 CFU·mL-1两个浓度种子发芽率和发芽势与CK组无显著性差异外,其余实验组在1×107 CFU·mL-1浓度条件下与其余浓度组及CK组差异显著(P<0.05),可获得最大萌发指标,该浓度下,种子萌发迅速整齐(图版Ⅰ),故使用此浓度下萌发种子进行幼苗生长指标和生理指标的测定。
2.2 菌液对幼苗生长及生理指标的影响
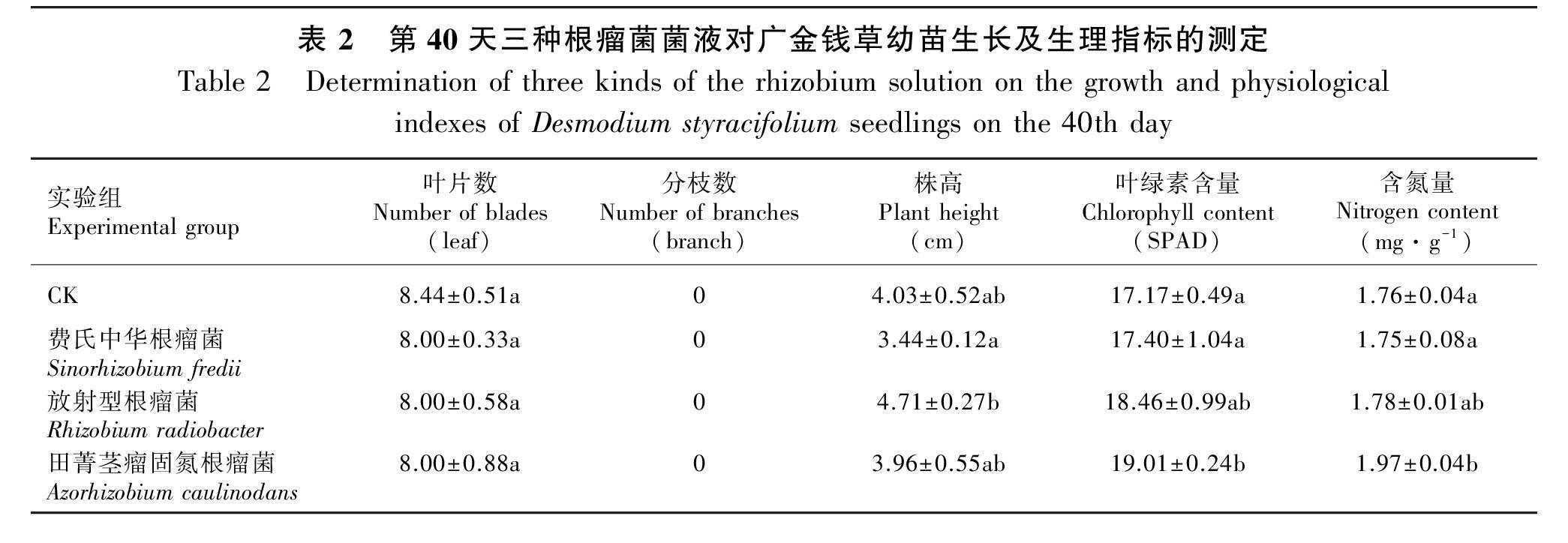
由表2可知,幼苗生长40 d后,三组实验组与CK组在叶片数上没有显著性差异, 植株均着生8片真叶,四组此时都未有分枝。田菁茎瘤固氮根瘤菌实验组株高与CK组无显著性差异,放射型根瘤菌实验组植株最高,且与各组差异显著(P<0.05),较CK组提高了16.87%。各实验组均能促进广金钱草体内叶绿素和含氮量的积累,田菁茎瘤固氮根瘤菌实验组提高最多,叶绿素含量较CK组提高10.72%,含氮量提高11.93%。
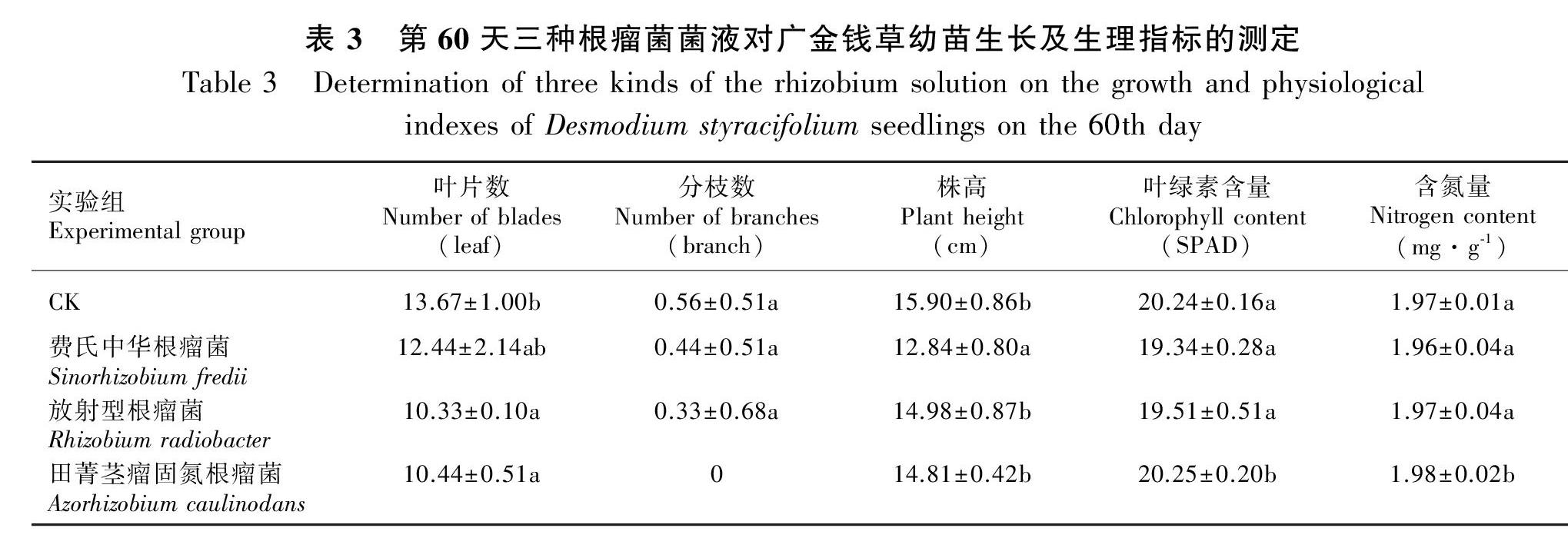
幼苗生长60 d后,CK组获得最多叶片(表3),田菁茎瘤固氮根瘤菌实验组无分枝,其他两组实验组与CK组在分枝数上无显著性差异,经费氏中华根瘤菌处理的植株在四组中最矮小。叶绿素含量和含氮量测定结果显示,费氏中华根瘤菌实验组和放射型根瘤菌实验组与CK组无显著性差异,而田菁茎瘤固氮根瘤菌实验组与CK组差异显著(P<0.05),对比CK组,该组叶绿素含量增长0.05%,含氮量增长0.51%。
80 d后,植株成活率及保苗率均在95%以上,对原始数据进行单因素方差分析,结果如表4所示,三种浓度为1×107 CFU·mL-1的根瘤菌对广金钱草幼苗的生长有显著性影响(P<0.05)。田菁茎瘤固氮根瘤菌浸种可显著促进广金钱草的叶片生长,除该实验组外,费氏中华根瘤菌实验组和放射型根瘤菌实验组在分枝数上与CK组有显著性差异(P<0.05),但都低于CK组,田菁茎瘤固氮根瘤菌实验组、放射型根瘤菌实验组及CK组可获得最高植株,而费氏中华根瘤菌实验组的植株最为矮小;在叶绿素含量和含氮量方面,放射型根瘤菌实验组与CK组植株有相同含氮量,费氏中华根瘤菌实验组含氮量低于CK组,田菁茎瘤固氮根瘤菌实验组可获得最高含氮量1.83 mg·g-1。
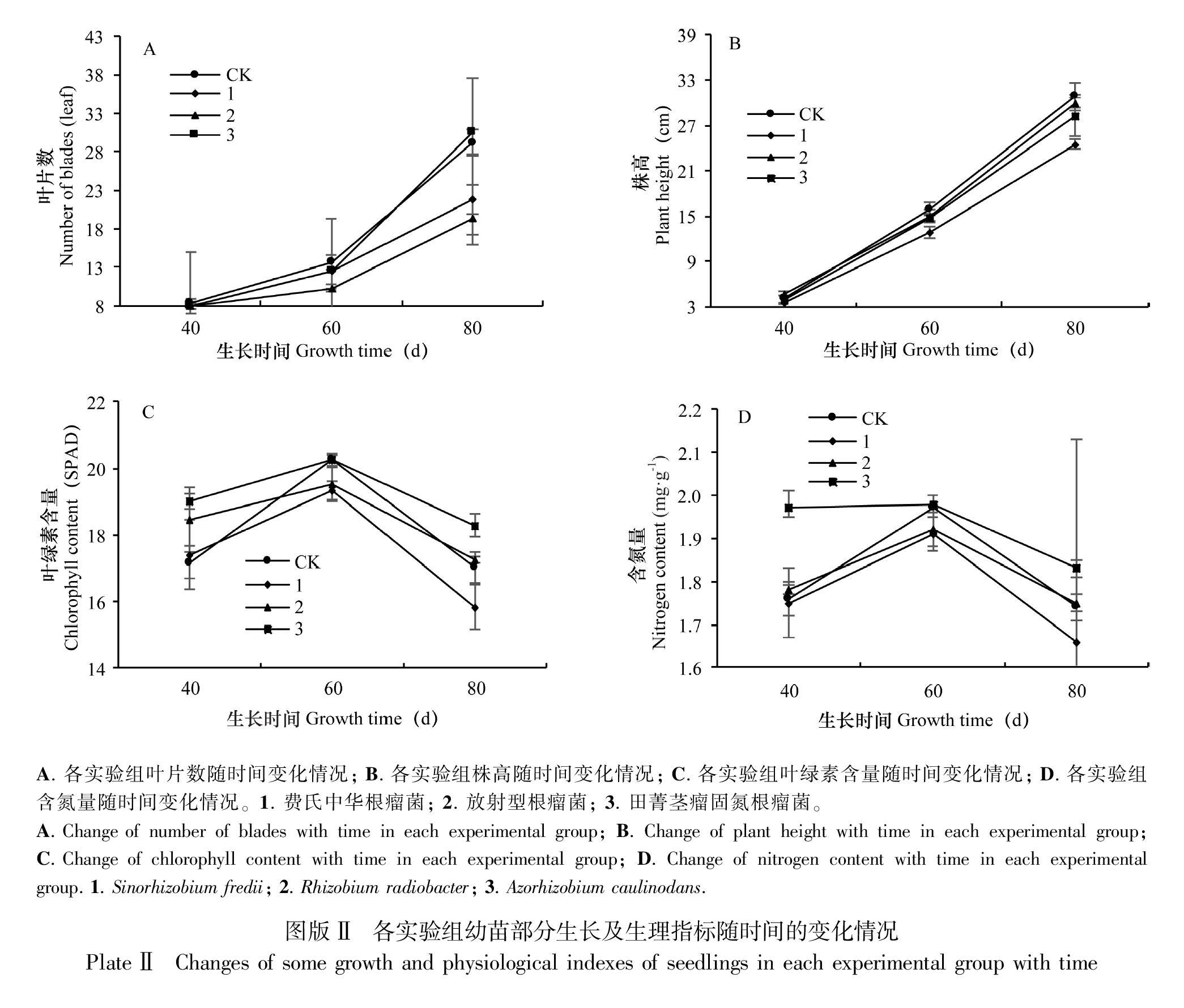
结合表2,表3,表4及图版Ⅱ可知:浓度为1×107 CFU·mL-1的三种不同根瘤菌侵染的广金钱草幼苗生长80 d后,费氏中华根瘤菌实验组和放射型根瘤菌实验组叶片数、分支数、株高均低于CK组,区别在于前者叶片数高于后者,而后者植株高度仅次于CK组;对两者的生理指标进行分析,可知费氏中华根瘤菌实验组对广金钱草的叶绿素含量和氮素含量均有抑制作用,放射型根瘤菌实验组在生理指标方面显示出一定的促进作用,叶绿素含量和含氮量分别较CK组提高了0.25 SPAD和0.02 mg·g-1。三组实验组中,田菁茎瘤固氮根瘤菌实验组着生最多叶片,前60天该组叶片数低于CK组且无分枝,60 d后,叶片长势迅速,近乎呈两倍增长,与其余三组差异显著(P<0.05),分枝数也在其后20 d内迅猛增长,最终与CK组数据接近一致;该处理也可显著提高广金钱草的生理物质含量,对比CK组,叶绿素增长7.47%,含氮量增长5.17%。从图版Ⅱ中C,D两个变化曲线还可看出,广金钱草植株叶绿素含量和氮含量与其生长期有关,随着植株生长期的增加,呈先缓慢增加后降低的趋势。
3 讨论与结论
传统种植方法栽培广金钱草,需要消耗大量化肥,致使土壤板结,肥力下降,严重影响广金钱草的可持续发展。减少化肥使用,降低农业成本并实现生产的有机化是广金钱草人工栽培技术的重要内容(孙贤多,2019)。Garcia et al.(2020)研究表明根瘤菌只需浸种或直接浇灌植物根部,就可定殖于植株体内,后期转变为具有固氮能力的拟菌体,促进植物生长,形成根瘤菌与根之间的共生关系,是绿色环保的“生物氮肥”。本文使用最为常用的放射型根瘤菌、费氏中华根瘤菌和田菁茎瘤固氮根瘤菌侵染广金钱草种子,研究其对种子萌發及植株生长的影响,开发适宜广金钱草拌种及施用的促生菌剂。
根瘤菌浸染种子促其萌发的方法现代早有研究(陈文新等,2004),但还未对广金钱草种子施行。不同根瘤菌入侵方式差异较大,定殖也为动态过程,根瘤菌可从植物伤口、气孔、水孔等自然开口处入侵,有些根瘤菌分布于植物根部的表皮、维管组织及细胞等位置,甚至定殖于茎、叶及子房中(Rajesh et al., 2020)。本实验发现1×107 CFU·mL-1的费氏中华根瘤菌以及放射型根瘤菌处理虽然对种子萌发可产生一定促进作用,但会降低其发芽周期前3天内的萌发整齐度,而该浓度下田菁茎瘤固氮根瘤菌处理可显著促进种子萌发,且萌发整齐度较好,该现象或受不同根瘤菌“入侵—定殖”过程的差异影响。本研究结果可为田菁茎瘤固氮根瘤菌直接拌种广金钱草种子的实际生产提供理论依据。
根瘤菌与豆科植物及非豆科植物形成根瘤产生共生固氮作用已在多种植物中得到验证(Vítor et al., 2019;王伦等,2020),其具有溶磷能力且能分泌多种植物促生长激素,如玉米素、IAA、GA等(刘华伟等,2012),可使植株叶片增多以及提高植株生长高度。田菁茎瘤固氮根瘤菌不仅可在宿主根部形成根瘤还可在茎部形成茎瘤(杨学智,2019),除一般根瘤菌的特性外,还具有其他特点:它存在自生固氮和与宿主植物共生固氮的“双重固氮”机制,既可自由吸收氮素,又可将氮素供给共生植物(Kyung-Bum et al., 2008),这就赋予了田菁茎瘤固氮根瘤菌比其他菌种更为强大的生物固氮能力。本实验的结论也验证了前人观点,经田菁茎瘤固氮根瘤菌侵染的广金钱草植株,长势从60 d开始与其余实验组逐渐拉开差距,生长旺盛且枝叶茂密,且在四组数据中各项萌发指标和两项生理指标(叶绿素含量和含氮量)最好。对于大部分非豆科植物来说, 根瘤菌不能与它们形成根瘤,而本实验中1×107 CFU·mL-1的田菁茎瘤固氮根瘤菌浸种可使部分广金钱草根部形成类根瘤状的膨大,且少数植株基部分枝处出现了膨大,分枝偏多,叶片多,但同时也发现这部分植株偏矮小,导致株高平均值被拉低。该现象的出现或与根瘤菌定殖位点差异和各类促植物生长激素的形成及其向基性有关:石志棉等(2020)在实验室早前研究中,通过绿色荧光蛋白gfp标记法发现田菁茎瘤固氮根瘤菌不仅能定殖于植物根部及附近土壤中,还可定殖于植物茎、叶、腺毛中,为植株生长提供氮源;刘薇等(2013)研究表明根瘤菌与宿主植物共生固氮系统形成后需要大量能量的参与,除宿主植物自身光合作用产生的碳水化合物外,还需要各类植物激素的相互协调,共同控制植物根瘤的形成。本研究中形成类根瘤和基部茎膨大的植株需要更多的植物激素参与固氮作用的消耗,导致促进植株生长的激素比重减少,从而发生了植株矮小的现象。植株中的叶绿素含量及氮含量与土壤中的含量呈正相关(胡喜巧等,2019),其含量随植株生长期的增加,呈现先增加再降低的趋势(Pijlman et al., 2020),本研究中广金钱草叶片叶绿素和氮含量在0~60 d期间缓慢升高,而在60~80 d期间明显下降,原因是此期间植株生长旺盛,果实逐渐成熟,叶片中的氮素等营养物质迅速向果实转移,影响了叶绿素的合成。
综上所述,三种根瘤菌对广金钱草种子的侵染均可在不同程度上提高广金钱草种子的萌发指标和植株生长期的叶绿素含量和含氮量。在本文1×107 CFU·mL-1浓度条件下,放射型根瘤菌和田菁茎瘤固氮根瘤菌对种子萌发和生长有更好的促进作用,前者可明显提高广金钱草植株的株高,后者显著提高叶片数、叶绿素含量和含氮量,并可出现类结瘤现象。初步研究发现田菁茎瘤固氮根瘤菌对苗期有良好效应,未来将针对成熟药材的黄酮类成分进行分析比较,进一步研究后提出完善的施用固氮菌肥的技术方案。
参考文献:
CHEN WX, WANG ET, CHEN WF, et al., 2004. The relationship between symbiotic diversity of rhizobia legumes and geographical environment [J]. Sci Agric Sin, 15(1): 81-86. [陈文新, 汪恩涛, 陈文峰, 等, 2004. 根瘤菌-豆科植物共生多样性与地理环境的关系 [J]. 中国农业科学, 15(1): 81-86.]
GARCIA K, BCKING H, ZMMERMIANN SD, 2020. Editorial: Importance of root symbiomes for plant nutrition: New insights, perspectives and future challenges [J]. Front Plant Sci, 11. DOI: 10.3389/fpls. 2020. 00594.
HE GX, SONG JC, WEN YJ, et al., 2020. Comprehensive effects of different Rhizobium fertilizer on alfalfa productivity and soil fertility [J]. Acta Pratac Sin, 29(5): 109-120. [何國兴, 宋建超, 温雅洁, 等, 2020. 不同根瘤菌肥对紫花苜蓿生产力及土壤肥力的综合影响 [J]. 草业学报, 29(5): 109-120.]
HU XQ, YANG WP, HUANG L, et al., 2019. Effects of different nitrogen sources on the growth and nutrient composition of safflower seedlings [J]. Acta Bot Boreal-Occident Sin, 39(11): 2044-2052. [胡喜巧, 杨文平, 黄玲, 等, 2019. 不同氮源对红花幼苗生长及营养成分影响 [J]. 西北植物学报, 39(11): 2044-2052.]
KYUNG-BUM L, PHILIPPE DB, TOSHIHIRO A, et al., 2008. The genome of the versatile nitrogen fixer Azorhizobium caulinodans ORS571 [J]. BMC Genom, 9(1): 64-73.
LAI LC, CHEN FL, WANG SL, et al., 2020. UPLC-Q/TOF-MS based serum metabonomic study on rats with calcium oxalate renal stones intervened by Desmodii styracifolii herba [J]. Trad Chin Drug Res Clin Pharmacol, 31(8): 950-959. [赖丽嫦, 陈丰连, 王术玲, 等, 2020. 基于UPLC-Q/TOF-MS的广金钱草水提物抗肾草酸钙结石大鼠的血清代谢组学研究 [J]. 中药新药与临床药理, 31(8): 950-959.]
LIAO HM, LIAO HY, WANG FB, et al., 2019. Cultivation technology of Desmodium styracifolium(Osbeck)Merr. in Guilin [J]. Bull Agric Sci Technol, 8: 342-343. [廖紅梅, 廖宏英, 王逢博, 等, 2019. 桂林市广金钱草栽培技术 [J]. 农业科技通讯, 8: 342-343.]
LIU HW, SUN C, YANG H, et al., 2012. The growth promoting effect of ORS571 on wheat seed infection and its colonization in root system [J]. Plant Nut Fert Sci, 18(1): 210-217. [刘华伟, 孙超, 杨呼, 等, 2012. 田菁茎瘤固氮根瘤菌对小麦种子侵染的促生作用及其在根系内的定殖 [J]. 植物营养与肥料学报, 18(1): 210-217.]
LIU W, ZHAO ZF, FENG YJ, et al., 2013. Regulation of plant hormones on the formation and development of legume nodules [J]. Soybean Sci, 32(2): 262-266. [刘薇, 赵振芳, 冯永君, 等, 2013. 植物激素在豆科植物根瘤形成和发育过程中的调控作用 [J]. 大豆科学, 32(2): 262-266.]
PIJLMIN J, HOLSHOF G, VANDENBERG W, et al., 2020. Soil nitrogen supply of peat grasslands estimated by degree days and soil organic matter content [J]. Nutr Cycl Agroecos, 117(3): 351-365.
RAJESH KS, PRATICSHA S, LI HB, et al., 2020. Diversity of nitrogen-fixing rhizobacteria associated with sugarcane: a comprehensive study of plant-microbe interactions for growth enhancement in Saccharum spp. [J]. BMC, 20(1): 111-119.
SHI ZM, DU Q, SU YM, et al., 2019. Effects of three rhizobia on seed germination of Andrographis paniculate under drought and salt stress [J]. Chin Pharm, 30(22): 3104-3108. [石志棉, 杜勤, 苏雨苗, 等, 2019. 3种根瘤菌对干旱和盐胁迫条件下穿心莲种子萌发的影响 [J]. 中国药房, 30(22): 3104-3108.]
State Pharmacopoeia Commission, 2015. Pharmacopoeia of the people’s Republic of China [S]. Beijing: China Pharmaceutical Science and Technology Press: 268. [国家药典委员会, 2015. 中华人民共和国药典 [S]. 北京: 中国医药科技出版社: 268.]
SUN XD, 2019. Screening and evaluation of finegermplasm of Desmodium styracifolium(Osbeck)Merr. [D]. Guangzhou: Guangdong Pharmaceutical University. [孙贤多, 2019. 广金钱草优良种质筛选及评价研究 [D]. 广州: 广东药科大学.]
VITOR GA, SANDRA MVF, RENATO P, et al., 2019. Soybean yield response to Bradyrhizobium strains in fields with inoculation history in Southern Brazil [J]. J Plant Nutr, 42(16).
WANG ET, 2016. Plant rhizobium symbiotic nitrogen fixation [J]. Chin Bas Sci, 18(1): 21-27. [王二涛, 2016. 植物-根瘤菌共生固氮 [J]. 中国基础科学, 18(1): 21-27.]
WANG L, GUANGZHAO ZS, RIBI YBM, et al., 2019. Lanthanide dependent methanol dehydrogenase isolated from Bradyrhizobium diazofeficiens USDA110 strain of Leguminosae [C]. Chinese Society of Bioengineering. Proceedings of the 13th Annual Meeting of Chinese Society of Bioengineering and 2019 National Biotechnology Conference. Chinese Society of Bioengineering: Chinese Society of Bioengineering: 449-456. [王伦, 菅沼宗矢, 日比野歩美, 等, 2019. 豆科固氮根瘤菌Bradyrhizobium diazoefficiens USDA110菌株中分离的镧系元素依赖型甲醇脱氢酶 [C]. 中国生物工程学会. 中国生物工程学会第十三届学术年会暨2019年全国生物技术大会论文集. 中国生物工程学会: 449-456.]
WANG YM, HUANG T, CHEN FJ, et al., 2021, Effects of simulated drought stress on seed germination and bud growth of Manglietia padongensis [J]. Guihaia, 41(6): 953-960. [王毅敏, 黃婷, 陈发菊, 等, 2021. 模拟干旱胁迫对巴东木莲种子萌发和芽苗生长的影响 [J]. 广西植物, 41(6): 953-960.]
YANG Q, LI SY, CHEN XX, et al., 2013. Resources investigation and quality evaluation of Desmodium styracifolium(Osbeck) Merr. [J]. Chin J Exp Trad Med Form, 19(3): 147-151. [杨全, 李书渊, 程轩轩, 等, 2013, 广金钱草资源调查与药材质量评价 [J]. 中国实验方剂学杂志, 19(3): 147-151.]
YANG X, LI YH, LI LL, et al., 2019. Study on the anti-inflammatory effect of the essential oil of Desmodium styracifolium(Osbeck)Merr. based on TRP channel [J]. Chin Trad Herbal Drugs, 50(1): 134-141. [杨欣, 李亚辉, 李来来, 等, 2019, 广金钱草挥发油基于TRP通道的抗炎作用研究 [J]. 中草药, 50(1): 134-141.]
YANG XZ, 2019. Research on the function of diguanylate cyclase genes in Azorhizobium caulinodans ORS571 [D]. Taigu: Shanxi Agricultural University: 3-4. [杨学智, 2019. 茎瘤固氮根瘤菌ORS571二鸟苷酸环化酶基因功能的研究 [D]. 太谷: 山西农业大学: 3-4.]
ZHAO YZ, WANG HM, WANG ZQ, et al., 2013. The role of legumes and rhizobia in ecological environment [J]. J Agric Resour Environ, 30(4): 7-12. [赵叶舟, 王浩铭, 汪自强, 2013. 豆科植物和根瘤菌在生态环境中的地位和作用 [J]. 农业资源与环境学报, 30(4): 7-12.]
(责任编辑 周翠鸣)

