大豆种子萌发后油脂体乳液稳定性的研究
刘 月,商 航,吴秦柔,冯 雪,官梦姝,李 佳,徐 聪,姜瞻梅,江连洲,侯俊财
(东北农业大学食品学院, 黑龙江哈尔滨 150030)
提到大豆(Soybean),自古就有“五谷宜为养,失豆则不良”的谚语,说明豆类的营养价值非常的高,大豆是一种富含脂肪和蛋白质的豆科植物,也曾被称为泥豆[1-2]。大豆中所含有的各类活性成分使其具有很多生理功能,不饱和脂肪酸可以预防心脑血管疾病[3],磷脂、生育酚[4]可以降低胆固醇[5],且磷脂对于破骨细胞的形成有重要作用,也可用作表面活性剂和界面吸附剂[6-7],生育酚有抗氧化作用[8]。大豆中蛋白质受到抗营养因子抑制,其营养价值不能完全被利用[9],而大豆种子经萌发后各种有益生物活性物质逐渐增加[10]。
油脂体是一类以甘油三酯(Triacylglycerols,TAGs)的形式存在于大部分油料作物种子中的脂质颗粒,也被称为油体或脂质体(Lipid body)[11],是一种离散型细胞器[12]。油脂体主要成椭圆形,大小通常为0.5~2.5 μm。其主要组成成分是三酰甘油脂、磷脂和蛋白质,由下图1油脂体的结构模型[13]可知,它是一个完整且独立的膜结构细胞器[14],单层磷脂膜表面为油脂蛋白,内部包裹三酰甘油,含有80%的磷脂。油脂体能够满足种子的生长发育并为幼苗代谢活动提供能量,大豆种子萌发后期,油脂体则作为主要的能量来源[15],脂肪在子叶、胚乳等组织中大量积累[16],促进胚轴突破种皮。且大豆种子经过浸泡才可开始萌发,浸种0~12 h为急剧吸水阶段,浸种12~27 h为滞缓吸水阶段,浸种27 h之后,种子鲜重明显增加,达到一定值时小部分胚根开始突破种皮,称为生长吸水阶段[17]。
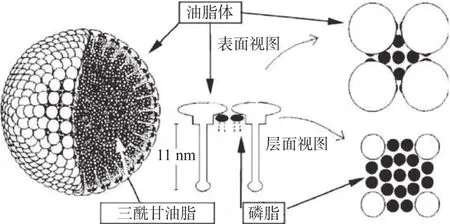
图1 油脂体的结构模型[13]Fig.1 Structure model of OBs
油脂体也是油料作物中天然的乳化油滴颗粒,因此其乳液具有很好的乳化性和稳定性,在食品中可用作乳化剂[10]。徐泽健等[18]通过研究指出油脂体乳液的乳化性及稳定性均表现良好,后续专业人士也对花生油脂体的提取方法及性质进行了研究。李向阳等[6]则对植物油脂体在提油及食品加工中的应用进行了阐述。而Wang等[19]研究了pH对大豆、花生、葵花籽油体理化性质的影响。且有研究表明在碱性条件下共价结合油蛋白、表没食子儿茶素-3-没食子酸酯可提高人工油体乳剂的稳定性和功能性能[20]。目前对于大豆油脂体的研究方向以油脂体提取方法、不同处理条件对油脂体的影响、不同条件下油脂体功能特性以及油脂体在食品加工中的应用几个方面为总体研究方向,而对萌发期大豆油脂体鲜有研究。基于以上,本实验通过油脂体稳定性各个表征指标的测定,将萌发期大豆与油脂体相结合进行研究,为后续对于不同时期油脂体的研究提供理论基础,以期萌发大豆油脂体能够更加广泛的应用于各个领域。
1 材料与方法
1.1 材料与仪器
大豆 东农大豆研究所;HCl、NaOH 天津科密欧化学试剂公司;蔗糖、NaCl、H2SO4、KH2PO4、硫氰酸钾、KMnO4西陇化工股份有限公司;PBS、ANS 博奥拓科技公司;SDS、Tris HCl、甲醇、乙醇、正丁醇、异辛烷、异丙醇、硫代巴比妥酸、三氯乙酸 Sigma公司。其他试剂均为国产分析纯。
HK-02型粉碎机 广州鸿兴机械有限公司;pHS-3C型pH计 Sartorius公司;恒温水浴锅 北京市永光明医疗仪器厂;GM-21M型高速冷冻离心机 湖南湘仪离心机仪器有限公司;PL-2002型电子天平 Merrler T oledo公司;Nano-ZS90型激光粒度仪、Zetasizer Nano ZS Zeta电位分析仪 Malvern公司;UV-6100型紫外可见分光光度计 Shimadzu公司。
1.2 实验方法
1.2.1 萌发大豆油脂体提取方法及油脂体乳液的制备 大豆种子萌发条件为黑暗环境、温度20 ℃、浸种液(0.01 mol/L KH2PO4)pH为7,浸种液与大豆种子比例4:1。对照组(浸种20 h)于4 ℃放置20 h,实验组浸种时间分别为21、23、25、27、29和31 h。油脂体的提取方法参照Wang等[19]和Sukhotu等[21]的方法并加以改进。研磨介质为50 mmol/L的Tris-HCl、0.4 mol/L的蔗糖以及0.5 mol/L的NaCl的混合溶液,浸泡后的大豆与研磨介质1:5于粉碎机内研磨1 min,两层纱布过滤获得滤液,滤液于离心机中4 ℃、10000 r/min离心30 min,使用药匙舀出或一次性胶头滴管吸出上层的悬浮物收集并分装于离心管中,加入等体积研磨介质,重复离心三次,收集的上层悬浮膏状物与等体积的0.1 mol/L的Tris-HCl缓冲液(pH7.5)置于离心管中,无需混匀,4 ℃、10000 r/min离心30 min,离心后的悬浮膏状物即为油脂体。置于4 ℃冰箱中保存备用。
本实验中所使用的油脂体乳液中油脂体含量为5%,将提取出的大豆油脂体经计算后称好,分散在去离子水中,使用高速分散机10000 r/min均质若干时间(观察油脂体均匀分散即可停止),所得乳液即为5%油脂体乳液,后进行下一步处理。
油脂体的提取率[22]计算公式如下:
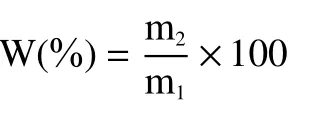
式中:W—油脂体提取率,%;m1—提取油脂体所用的大豆种子的质量,g;m2—最终提取油脂体的质量,g。
1.2.2 油脂体乳液絮凝稳定性 将制备好的油脂体配制成5%的油脂体乳液后,分别取10 mL放入样品瓶中,常温放置14 d,观察其絮凝情况,且分别在放置0、7、14 d时拍照记录其状态。
1.2.3 平均体积粒径和ζ-电势的测定 ζ-电势和平均粒径的测定均参照Iwanaga等[23]的方法。用蒸馏水将样品稀释,用Zetasizer Nano ZS Zeta电位分析仪进行测定。将5%油脂体乳液用蒸馏水稀释至1%,油脂体折射率为 1.47(分散相),水折射率为1.33(连续相),用激光粒度仪进行测定。NaCl浓度处理:将样品中加入0~200 mmol/L NaCl缓冲溶液稀释,放置于室温,定期取样进行测定。pH处理:将样品调至pH4、5、7、10,放置于室温,定期取样进行测定。温度处理:将样品密封于固定温度下贮藏(4、25、40、60 ℃)且 0~14 d 时定期取样进行测定。
1.2.4 表面疏水性的测定 使用PBS(10 mmol/L,pH7.0)将样品分别稀释至 0.25%、0.50%、1.00%、1.50% 和 2.00%(w/v),将 10 mL 样品稀释液与 100 μL ANS(8 mmol/L)荧光探针均匀混合后避光15 min,使用荧光分光光度计对样品进行荧光比色,散点图初始斜率(纵坐标为荧光强度,横坐标为样品蛋白浓度)为样品表面疏水性(H0)值。
1.2.5 乳化活性和乳化稳定性的测定 将5%的油脂体乳液用蒸馏水稀释至质量浓度为1 mg/mL,取5 mL样品稀释液,使用分散机10000 r/min均质1 min,吸取底部乳化液200 μL加入到10 mL SDS溶液中,500 nm波长下测量吸光值,剩余样品稀释液静置30 min后再吸取底部乳化液200 μL加入到10 mL SDS溶液中,测量吸光值。
1.2.6 过氧化值的测定 过氧化值的测定参照盛林霞等[24]的方法。用预先氧化的油脂(由AOCS Cd 8-53测得POV)来建立标准曲线。取1 mL 5%的油脂体乳液于试管中,加入5 mL异辛烷:异丙醇(v/v,2:1)混合溶液,3000 r/min漩涡混合10 min,取上层清液1 mL,分别加入 20 μL 硫氰酸钾和 20 μL FeCl2溶液,再用甲醇:正丁醇(v/v,2:1)混合溶液定容至5 mL,3000 r/min漩涡混合10 s,室温下避光静置20 min,以甲醇:正丁醇混合液作为空白,510 nm波长下测吸光值。硫氰酸钾溶液浓度为3.94 mol/L。将 BaCl2溶液和 FeSO4·7H2O溶液等体积混合,3000 r/min离心10 min,去上层清液即为FeCl2溶液。
1.2.7 TBARS值的测定 将0.375%(w/v)硫代巴比妥酸(TBA)、15%(w/v)三氯乙酸(TCA)溶解于0.25 mol/L的HCl中,加入蒸馏水混合均匀得到TBA试剂,取1 mL 5%油脂体乳状液,2 mL TBA试剂于15 mL试管中混合,3000 r/min漩涡30 s,于沸水浴中加热25 min,后冷却至室温,再于离心管中1000 r/min离心20 min,532 nm下测吸光值。
标准曲线y=0.5711x-0.0522,R2=0.9941
式中,y为吸光度,x为硫代巴比妥酸值(TBARS值)。
1.2.8 酸价的测定 取1 mL 5%的油脂体乳液加入到锥形瓶中,向其中加入5 mL的乙醇:正丁醇(v/v,1/1)混合溶液,0.1%酚酞试剂作指示剂,用0.01 mol/L NaOH溶液滴定。记录所消耗的NaOH溶液体积[19]。
1.3 数据处理
所有处理组均三次平行测定,通过SPSS Statistix 19.0软件处理数据,方差分析采用ANOVA,多重比较采用 LSD0.05的方法,P<0.05表示差异显著,P>0.05表示差异不显著;采用Origin 8.5软件作图。
2 结果与分析
2.1 不同萌发时间大豆油脂体乳液稳定性
2.1.1 不同萌发时间大豆油脂体的提取率及絮凝稳定性 不同萌发时间大豆提取率见图2。随着大豆种子的萌发,大豆油脂体的提取率应逐渐下降,对照组油脂体提取率为(12.36 %± 0.21%)。萌发后期则大量油脂体开始不断酶解为萌发提供能量,油脂体提取率呈逐渐下降趋势,27 h之后油脂体提取率下降速率加快,大豆种子经KH2PO4浸种液浸泡后,由21 h开始萌发,从提取率上来看,萌发前(20 h)的提取率高于萌发后,且萌发时间为21~27 h时大豆油脂体的提取率无显著变化,27 h后提取率显著低于27 h之前(P<0.05)。这与Denis等[25]发表的有关玉米种子油脂体降解的研究结果相似,油料作物种子进入萌发阶段后,除大量吸水之外还会自主合成酯酶,酯酶通过油脂体表面嵌镶蛋白与油脂体互相结合,将其水解为脂肪酸和甘油,这就解释了以上油脂体提取率的变化。这种情况类似于Yang等[26]研究的大豆种子发育过程中脂质贮藏变化。
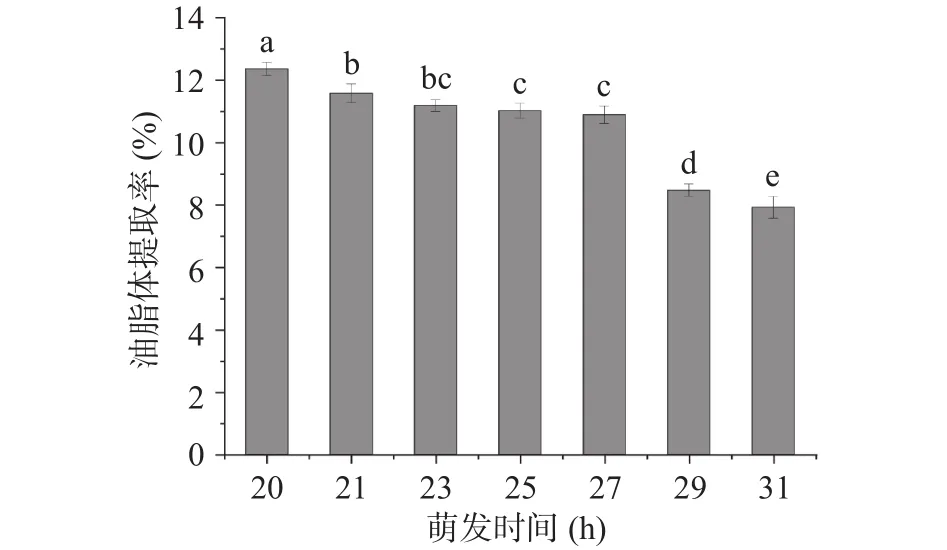
图2 不同萌发时间大豆的油脂体提取率Fig.2 Extraction rates of soybean oil bodies at different germination times
不同萌发时间大豆油脂体室温静置14 d絮凝情况如图3所示。油脂体的乳液稳定性与提取方法也有着密切的关系[27]。由图3可见,静置0 d时各样品瓶内样品并无明显差异;静置时间为7 d时L1(20 h)、L2(21 h)和 L3(23 h)样品瓶中均出现细微絮凝现象;静置14 d后样品瓶中均出现絮凝现象,絮凝程度达到最大,且静置14 d后27 h(L5)样品瓶内样品相较对照组和其他实验组絮凝程度小。

图3 不同萌发时间大豆油脂体乳液室温贮藏14 d絮凝稳定性Fig.3 Flocculation stability of soybean oil emulsion at different germination time after storage at room temperature for 14 d
2.1.2 不同萌发时间大豆油脂体的粒径及ζ-电势如图4所示,不同萌发时间下大豆油脂体乳液的平均体积粒径,萌发20 h大豆油脂体的平均体积粒径为(0.870±0.012)μm;萌发后的大豆油脂体平均体积粒径均小于对照组,但变化不大。通常用于研究的大豆油脂体的平均体积粒径(D[4,3])大致为0.9 μm,经萌发后,其平均体积粒径也有所减小,萌发期平均体积的粒径变化可能是由不同阶段油脂体酶解程度不同所引起的[28]。
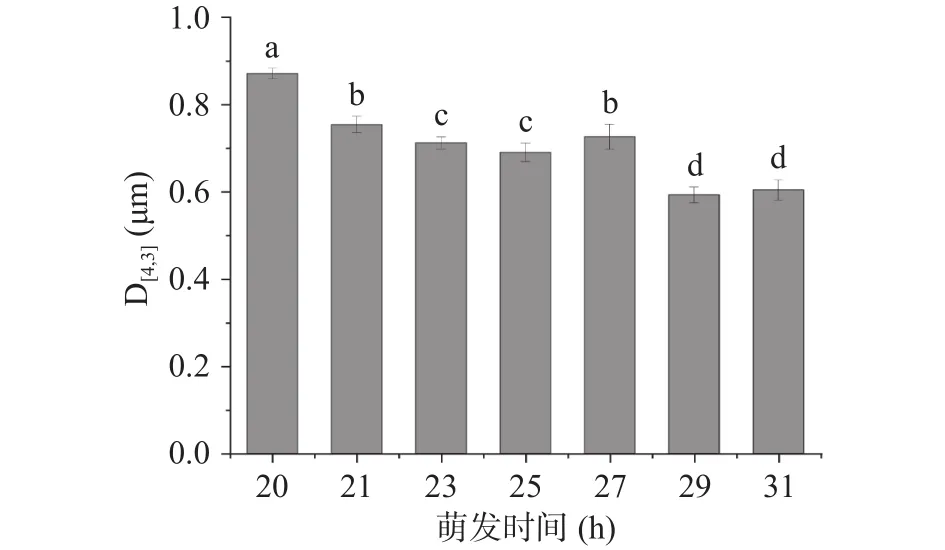
图4 不同萌发时间大豆油脂体乳液粒径分布Fig.4 Particle size distribution of soybean oil emulsion at different germination time
不同萌发时间大豆油脂体的ζ-电势情况如图5。由图5可见,随着萌发时间的增加,油脂体ζ-电势变化不均一,萌发20 h大豆油脂体ζ-电势为(-24.67±0.53)mV;相比20 h时大豆油脂体的ζ-电势,萌发阶段的大豆油脂体ζ-电势绝对值显著减小(P<0.05)且萌发27 h时ζ-电势与20 h时ζ-电势较接近。大豆油脂体表面带负电荷,萌发时间越长,酯酶水解越多的油脂体,脂肪酸释放的也就越多。脂肪酸的含量也可以影响大豆油脂体的ζ-电势。
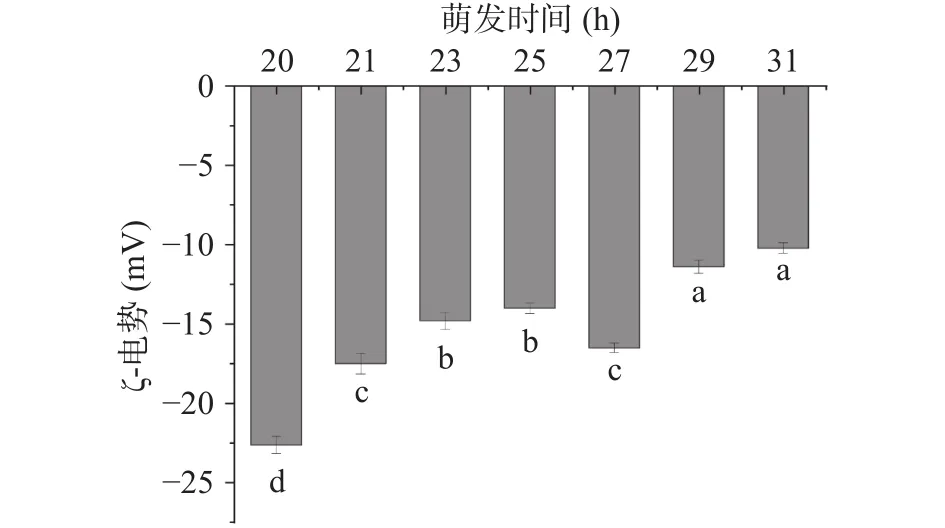
图5 不同萌发时间大豆油脂体乳液ζ-电势Fig.5 ζ-potential of soybean oil emulsion at different germination time
2.1.3 不同萌发时间大豆油脂体的表面疏水性和乳化稳定性 不同萌发时间大豆油脂体的表面疏水情况如图6所示。由图可知,除31 h以外,其他萌发时间的大豆油脂体表面疏水性大多集中在(50~90),且萌发27 h时表面疏水性(99.78±0.88)显著高于其他萌发时间(P<0.05),其中萌发最后阶段31 h时大豆油脂体的表面疏水性最小。随着油脂体相关酶对其水解程度的不同,其内部蛋白也发生二级结构的转换,降解程度越大其蛋白二级结构越多,越易形成超二级溶解度则越低,且表面疏水性随蛋白溶解度升高而降低,且与β-折叠含量正相关,与β-转角负相关[29]。27 h时是油脂体作为主要能量来源大量降解功能的时间,因此其表面疏水性较大。
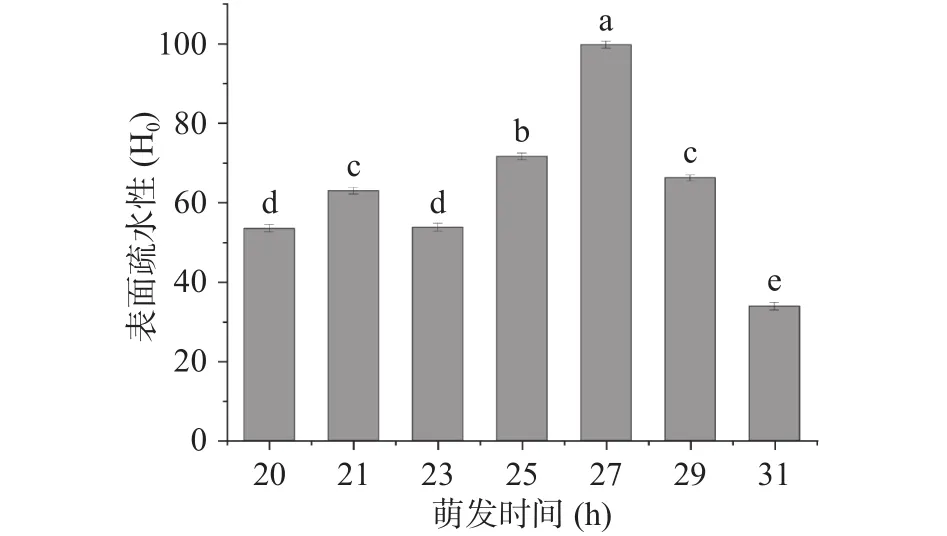
图6 不同萌发时间大豆油脂体乳液表面疏水性Fig.6 Surface hydrophobicity of soybean oil emulsion at different germination time
图7为不同萌发时间大豆油脂体乳液的乳化性质。由图7所示,随着萌发时间的延长,20~27 h的乳化活性指数(EAI)分布在 15~20 m2/g,而 27 h 之后的乳化活性有所减小;萌发27 h的大豆油脂体乳液的乳化稳定性(ESI)则显著高于其他萌发时间。
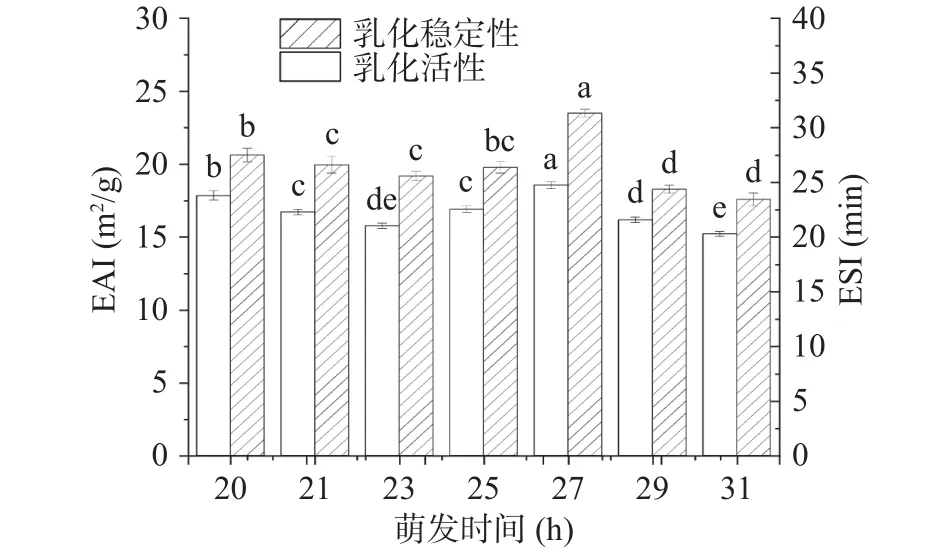
图7 不同萌发时间大豆油脂体乳液乳化性质Fig.7 Emulsifying properties of soybean oil emulsion at different germination time
浸种 20 h 时大豆油脂体 EAI 为(17.83±0.31)m2/g,萌发 27 h 后大豆油脂体 EAI为(17.55±0.24)m2/g,与20 h及其他实验组有明显差异(P<0.05)。萌发27 h 的大豆油脂体的 ESI为(23.49 ± 0.39)min,显著高于 20 h 大豆油脂体的 ESI(20.61±0.46)min 以及其他实验组大豆油脂体的ESI(P<0.05)。乳化稳定性是依靠静电排斥力的,由于乳化微粒表面上形成的乳化吸附层,微粒之间相互接近时,乳化吸附层相互间产生静电排斥力,防止微粒相互间产生聚集,可见27 h的乳化稳定性较高,这一结果与絮凝稳定性的实验结果相符合[30]。
2.1.4 不同萌发时间大豆油脂体的过氧化值和TBARS值 图8为不同萌发时间大豆油脂体14 d的过氧化值(PV)变化。由图8可知,随着贮藏时间的延长,不同萌发时间下的大豆油脂体在室温贮藏14 d过程中过氧化值均呈现先增大后减小的趋势,且过氧化值峰值大约出现在第6 d,随后逐渐减小,对照组(20 h)过氧化值变化趋势线位于实验组中间。萌发时间为27 h时大豆油脂体的过氧化值变化趋势最小,变化范围也最小,也就说明其贮藏时间内过氧化程度相对较小。
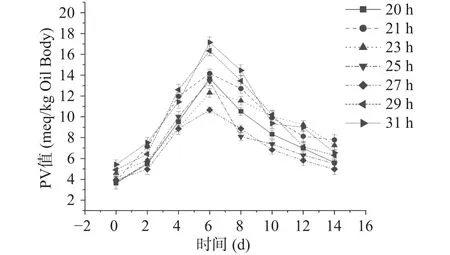
图8 不同萌发时间大豆油脂体乳液过氧化值Fig.8 Peroxidation value of soybean oil emulsion at different germination time
不同萌发时间下大豆油脂体乳液的TBARS值如图9所示。由图9可知,大豆油脂体TBARS值随着贮藏时间的增加呈现先增大后减小的趋势,同时TBARS值的峰值大致出现在第8 d。对照组(20 h)油脂体在贮藏时间为 0 d时,TBARS值为(0.85±0.04)μg/mL,萌发时间为25 h时,油脂体在贮藏时间0和8 d时TBARS值均为最大值,分别为(0.89 ±0.02)μg/mL 和(1.42±0.03)μg/mL,且可以看出萌发时间为27 h时,大豆油脂体的TBARS值变化趋势最为平稳。
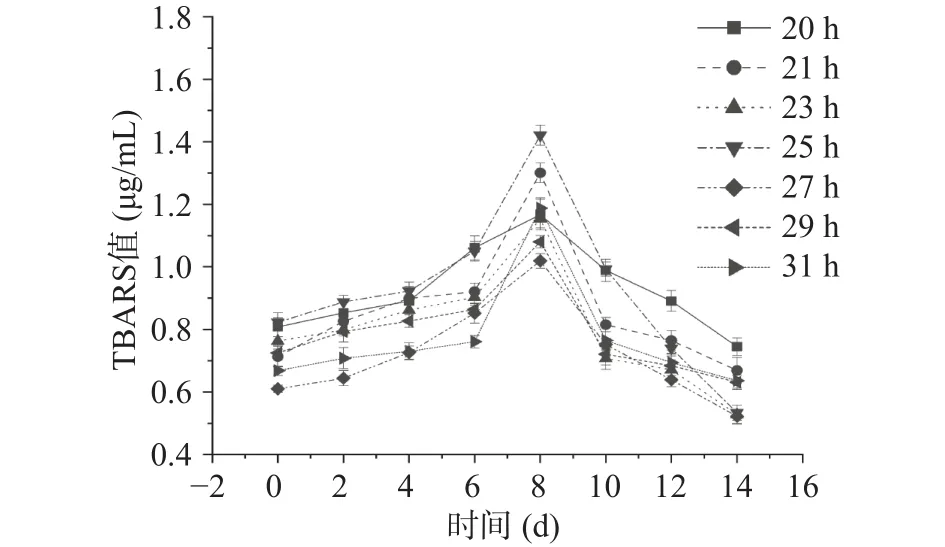
图9 不同萌发时间大豆油脂体乳液TBARS值Fig.9 TBARS value of soybean oil emulsion at different germination time
TBARS值表示脂质过氧化程度,且萌发时间不同时,大豆油脂体的TBARS值无显著差别,也就说明萌发条件下大豆油脂体的脂质过氧化程度大致相同,其原因可能是由于在萌发过程中大豆油脂体的脂质作用相同,均在大豆种子萌发后期(油脂体大量降解之前)为发芽提供能量。
2.1.5 不同萌发时间大豆油脂体的酸价 酸价是衡量脂肪中的游离脂肪酸含量的指标[31]。不同萌发时间的大豆油脂体常温贮藏14 d的酸价变化如图10所示。
由图10可知,室温下贮藏时间延长,大豆油脂体的酸价均出现明显的峰值,在第0~4 d时,对照组和实验组油脂体酸价只有略微的增加,且萌发27 h油脂体酸价较低,而在第4~6 d时,酸价显著增加(P<0.05),在 6~14 d时各组油脂体的酸价开始降低。由图10可看出,室温贮藏条件下萌发27 h的大豆油脂体酸价低于其他组。
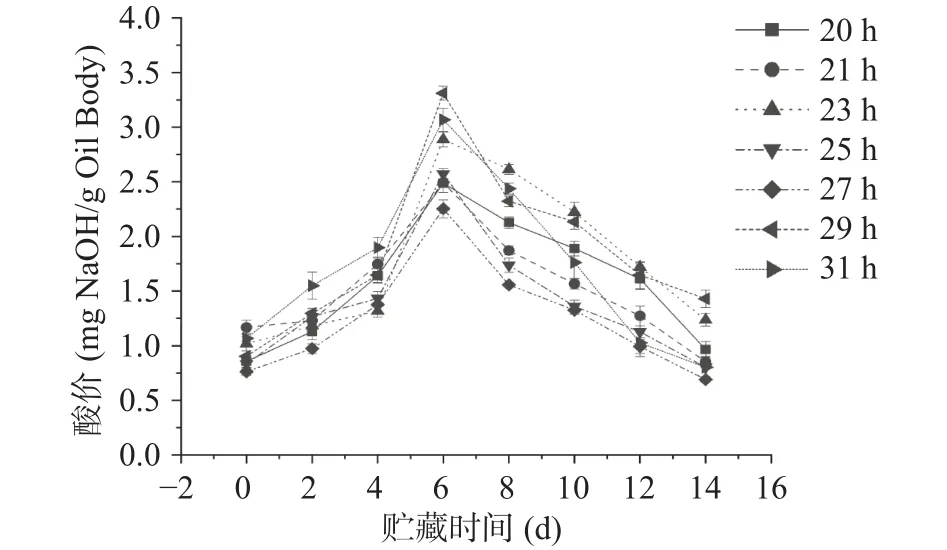
图10 不同萌发时间大豆油脂体乳液酸价Fig.10 Acid value of soybean oil emulsion at different germination time
油脂酸价的上升,是由于三酰甘油酯水解后产生了游离脂肪酸。萌发后的油脂体随贮藏时间不断推移,其酸价也出现不同的变化趋势,其中萌发29 h和31 h的大豆油脂体酸价变化范围极大,贮藏时间内的酸价最大值也最大,说明其中游离脂肪酸的含量较其他萌发时间更多,且14 d内萌发27 h的大豆油脂体乳液酸价显著低于其他组(P<0.05)。推测产生这种结果的原因可能是大豆在萌发过程中,分为几个阶段,萌发时间为27 h以后则属于大豆种子的萌发末期,萌发前中期大多行为表现为吸水,而此过程中油脂体被水解则大部分都发生在滞缓吸水后期,也就是说27 h后大豆油脂体才有大量贮藏物质被水解,释放更多游离脂肪酸。这与顾骞骞等[32]的研究结果一致。
2.2 NaCl浓度、pH、贮藏温度对萌发27 h大豆油脂体乳液稳定性的影响
2.2.1 NaCl浓度、pH、贮藏温度对萌发27 h大豆油脂体乳液粒径分布及ζ-电势的影响 NaCl浓度、pH、贮藏温度对萌发27 h油脂体平均体积粒径的影响见图11。由图可知,随着NaCl浓度的升高,萌发27 h大豆油脂体的平均体积粒径呈增大趋势。在NaCl浓度为0 mmol/L时的平均体积粒径为最小,在不同NaCl浓度为50~100 mmol/L时的平均体积粒径增幅较大。pH越高,油脂体的平均体积粒径越小。pH为4时萌发27 h大豆油脂体的平均体积粒径为(6.23±0.15)μm。温度为 4、25、40 ℃ 时,萌发27 h大豆油脂体的平均体积粒径呈递增趋势,且当温度上升到一定值后油脂体的平均体积粒径开始减小,温度为60 ℃时萌发27 h大豆油脂体的平均体积粒径为(35.67±1.31)μm,显著小于其他三组(P<0.05)。
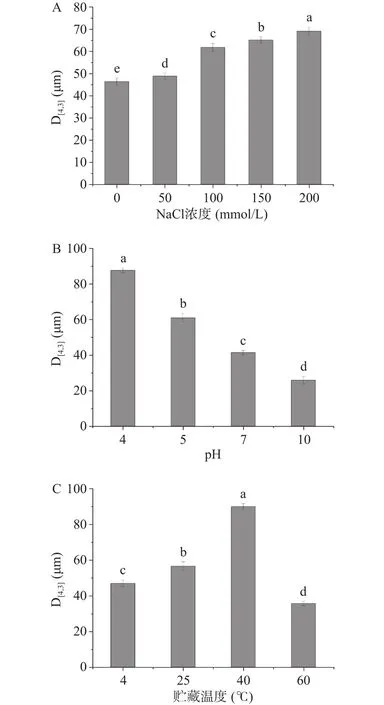
图11 不同条件处理对萌发油脂体粒径影响Fig.11 Effect of different treatment conditions on particle size of germinated oil bodies
图12为NaCl浓度、pH、贮藏温度对萌发油脂体乳液ζ-电势影响。萌发27 h大豆油脂体乳液的ζ-电势在 0 mmol/L NaCl浓度时为(-15.37±0.33)mV,NaCl浓度 0~150 mmol/L时萌发27 h大豆油脂体的ζ-电势增幅变大,NaCl浓度大于150 mmol/L时萌发27 h大豆油脂体的ζ-电势无明显变化(P>0.05)。ζ-电势随着pH值的增加而减小,pH为4时为最大值(-5.67±0.20)mV,酶的活性也可以影响大豆油脂体的ζ-电势,pH不同时,影响着酶的活性使其具有不同的酶活性,因此也从这一方便减小了萌发27 h后的大豆油脂体的ζ-电势。这也解释了本实验第一部分不同萌发时间时大豆油脂体ζ-电势的变化。萌发27 h大豆油脂体的ζ-电势绝对值随着温度的增加而减小,温度为 4 ℃ 时为 ζ-电势最小值(-19.87±0.30)mV,且贮藏温度为 60 ℃时为ζ-电势最大值(-10.77±0.35)mV。
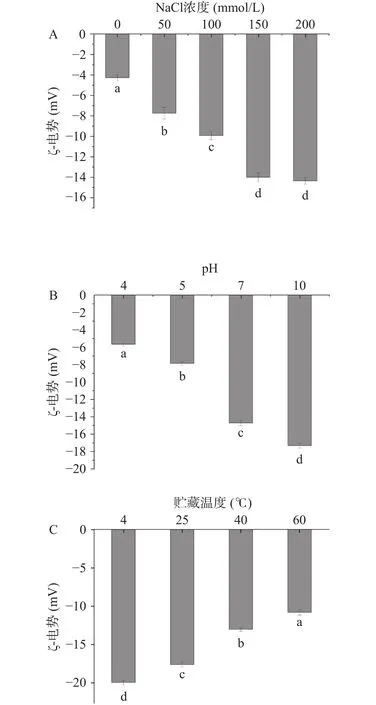
图12 不同处理条件对萌发油脂体ζ-电势影响Fig.12 Effects of different treatment conditions on ζ-potential of germinated oil bodies
2.2.2 NaCl浓度、pH、贮藏温度对萌发27 h大豆油脂体乳化性质的影响 图13所示为NaCl浓度、pH、贮藏温度对萌发27 h时大豆油脂体的乳化性质。乳化活性(EAI)在添加了不同浓度的NaCl后并无显著差异,大致分布14~16 m2/g之间,而乳化稳定性(ESI)在添加了不同浓度NaCl后则呈现出逐渐下降的趋势,0~150 mmol/L的NaCl可以使ESI显著下降(P<0.05),且 150和 200 mmol/L 的 NaCl浓度下 ESI无显著变化,分别为(4.75±0.12)min 和(4.74±0.14)min。随着 pH的增加 EAI呈减小趋势,且pH 为 4时 EAI为最大值(19.13±0.23)m2/g。乳化稳定性(ESI)在pH4~7时呈增大趋势,且pH7时ESI(10.67±0.20)min 显著高于其他pH 时的ESI(P<0.05)。pH10 时的 ESI减小到(4.78±0.26)min。热处理改变了大豆油脂体乳液的界面特性,进而影响油脂体乳液的物理稳定性和氧化稳定性[33]。由图13可知,随着温度的升高,EAI无显著变化,4 ℃时EAI为(16.35±0.41)m2/g。温度为 25、40、60 ℃ 时 EAI呈逐渐上升,且 60 ℃ 时 EAI为(17.98±0.41)m2/g。乳化稳定性(ESI)在温度为 4 ℃ 时显著高于其他温度(P<0.05),为(10.44±0.36)min。温度为 25、40、60 ℃ 时 ESI逐渐上升。由此可知,温度对萌发27 h大豆油脂体乳化性的影响由大到小依次为25、40、60、4 ℃。
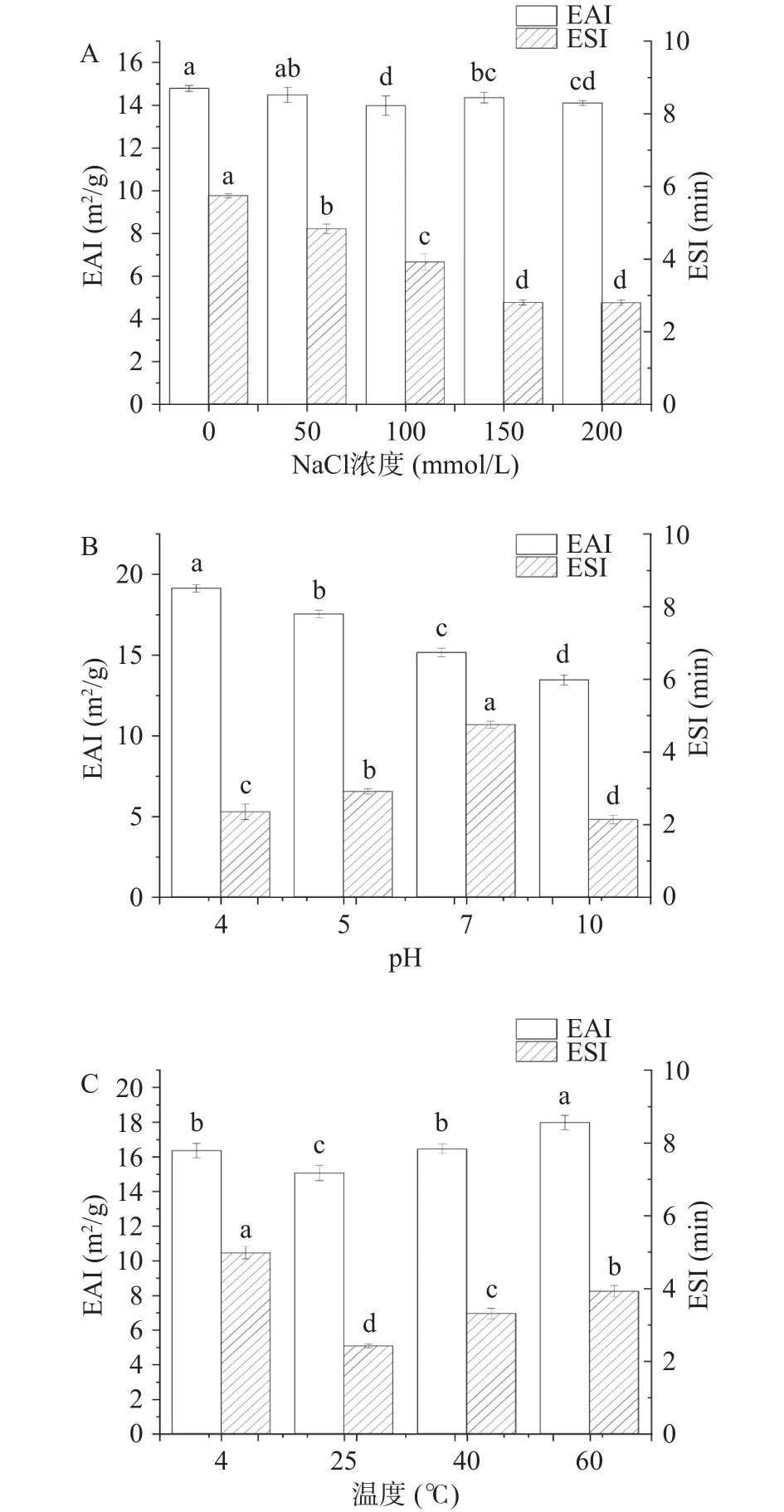
图13 不同处理条件对萌发油脂体乳化性质影响Fig.13 Effects of different treatment conditions on emulsifying properties of germinated oil bodies
2.2.3 NaCl浓度、pH、贮藏温度对萌发27 h大豆油脂体过氧化值的影响 NaCl浓度、pH、贮藏温度对萌发27 h大豆油脂体过氧化值的影响见图14。由图14可知,加入NaCl后萌发27 h大豆油脂体过氧化值随贮藏时间的延长而增大,且NaCl浓度越高,过氧化值增加的越多,变化的越大。0~6 d时其过氧化值增大的速率较高,而6~14 d时其过氧化值增加的速率明显低于0~6 d时。NaCl浓度为200 mmol/L时样品 PV值最高(15.85±0.23 meq/kg)。在 pH的影响下,萌发27 h的大豆油脂体的过氧化值均呈现上升趋势,且0~4 d时四组过氧化值上升速率均较大,6~14 d时其过氧化值则变为缓慢上升。pH10时,萌发27 h大豆油脂体的过氧化值均高于其他组,且pH=7时0~7 d的过氧化值均低于其他组。由此可知pH对萌发27 h大豆油脂体过氧化值的影响为从大到小依次为 pH=10>pH=4>pH=5>pH=7。随温度上升,萌发27 h的大豆油脂体的过氧化值均呈现缓慢的上升趋势,温度为40和60 ℃时过氧化值的变化不稳定,说明影响较大。温度为4 ℃时其过氧化值的变化最小且上升趋势平稳。温度为25 ℃时过氧化值在0~4、8~14 d均无明显的变化,而在4~8 d时迅速上升。温度对萌发27 h大豆油脂的过氧化值影响大小依次为 40、60、25 、4 ℃。
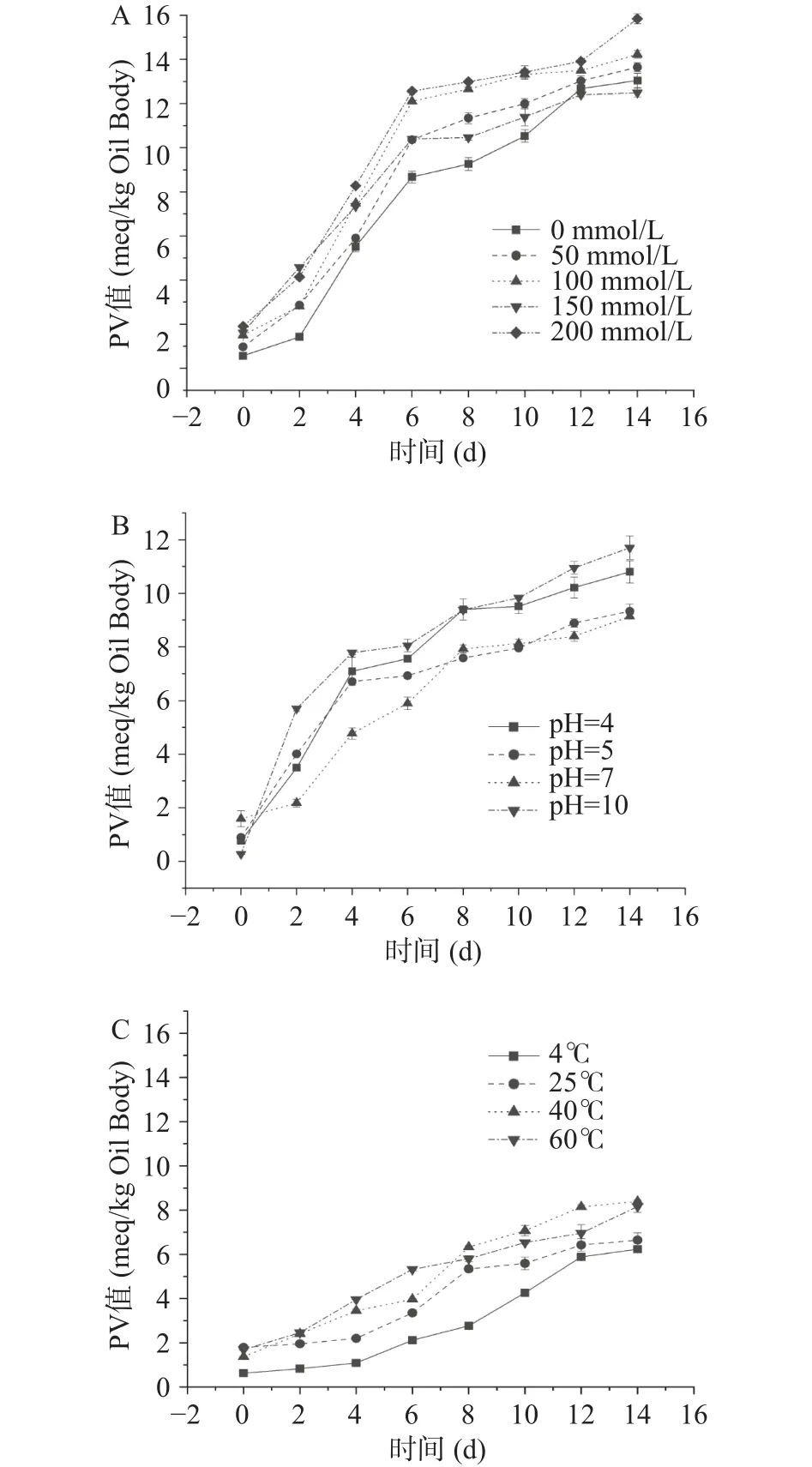
图14 不同处理条件对萌发油脂体过氧化值影响Fig.14 Effect of different treatment conditions on peroxide value of germinated oil bodies
2.2.4 NaCl浓度、pH、贮藏温度对萌发27h大豆油脂体TBARS值的影响 如图15所示,NaCl浓度、pH、贮藏温度对萌发 27 h大豆油脂体 TBARS值的影响。未加入NaCl的大豆油脂体TBARS值在6~14 d的下降速率大于加入NaCl油脂体6~14 d TBARS值的下降速率。NaCl浓度为200 mmol/L时峰值最大,为(3.380±0.086)μg/mL。pH 不同产生了两种影响。pH3和pH4时其TBARS值在0~10 d先增后减,10~14 d时又出现了平缓的增加。pH7和pH10时萌发27 h大豆油脂体的TBARS值在0~4 d迅速增大,在4~14 d时缓慢下降。且pH10时的TBARS值变化趋势显著大于其他pH(P<0.05)。由图15可知,0~4 d时 4、25、40和 60 ℃ 四种温度处理都可使萌发27 h大豆油脂体的TBARS值呈显著增大趋势(P<0.05),4~14 d 时 25 和 40 ℃ 的 TBARS值显著大于 4和 60 ℃(P<0.05),且下降趋势较 4 和60 ℃时缓慢。由此可见低温和高温都可以抑制萌发27 h大豆油脂体的TBARS值变化,影响大小依次为 25、40、60 、4 ℃。
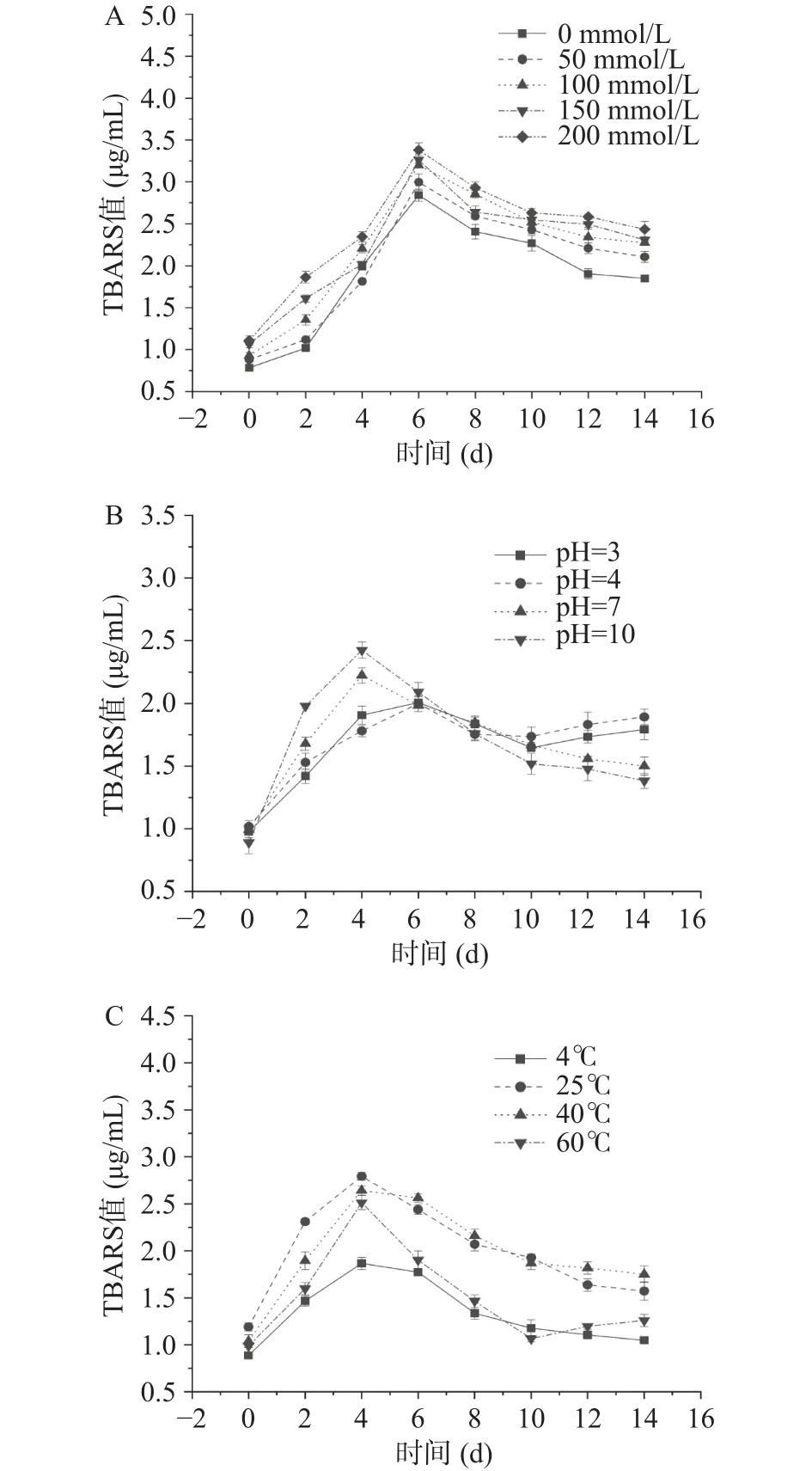
图15 不同处理条件对萌发油脂体TBARS值影响Fig.15 Effect of different treatment conditions on TBARS value of germinated oil bodies
2.2.5 NaCl浓度、pH、贮藏温度对萌发27 h大豆油脂体酸价的影响 NaCl浓度、pH、贮藏温度对萌发27 h大豆油脂体酸价的影响见图16。由图16可知,经过萌发处理27 h的大豆油脂体中加入不同浓度的NaCl,酸价均呈上升。在第0~6 d时,NaCl浓度为0和50 mmol/L时,油脂体酸价增加的趋势平缓,无显著性差异,NaCl浓度为100、150、200 mmol/L时,油脂体酸价明显上升,显著高于NaCl浓度为0和50 mmol/L时的酸价上升速率(P<0.05)。在第6~14 d时,除0 mmol/L的NaCl实验组酸价上升趋势缓慢,其他添加了NaCl的大豆油脂体酸价上升速率均出现了明显变化。随贮藏时间的增加经过萌发处理27 h的大豆油脂体的酸价在pH影响下呈逐渐上升趋势。pH为4和7时,萌发27 h的大豆油脂体的酸价呈稳定上升趋势,而pH为5和10时,酸价的上升趋势很不平稳。且从图16中可以看出,pH越大,萌发27 h的大豆油脂体酸价越大。pH为10时的油脂体酸价显著高于其他三组(P<0.05),且pH对萌发27 h大豆油脂体酸价的影响从大到小依次为pH=10>pH=7>pH=5>pH=4。随着温度的升高,萌发27 h的大豆油脂体酸价随时间增加呈现出上升趋势,温度为4、25和40 ℃时,其酸价上升趋势缓慢,同时40 ℃时的酸价高于其他组,而温度为60 ℃时,其酸价在0~6 d时上升缓慢且低于其他组,在6~14 d时的酸价上升速率明显增加且显著高于其他组,又在10~14 d时酸价值超过其他组成为最大值。由此可见温度对萌发27 h大豆油脂体酸价的影响为 60 ℃>40 ℃>25 ℃>4 ℃。
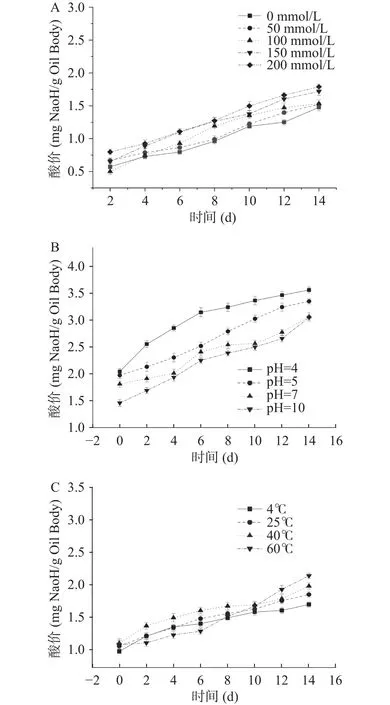
图16 不同处理条件对萌发油脂体酸价影响Fig.16 Effect of different treatment conditions on acid value of germinated oil bodies
3 结论
本实验对大豆种子萌发处理后的油脂体乳液稳定性进行研究,对不同萌发时间下的大豆油脂体乳液各指标进行了综合比较,萌发后的大豆油脂体提取率逐渐降低,经比较后,萌发27 h的大豆油脂体乳液乳化稳定性较好,且室温密封贮藏14 d后的过氧化值、TBARS值及酸价变化趋势及变化范围都呈现出较好的结果,则选出较稳定的萌发时间为27 h。
用不同NaCl浓度、pH及贮藏温度处理萌发27 h大豆油脂体,NaCl浓度越高,萌发27 h的大豆油脂体乳液过氧化值、TBARS值及酸价的变化范围和趋势越大,说明NaCl的添加对其稳定性的影响较大,且NaCl浓度越高,影响越大,稳定性越不好。不同pH的乳液过氧化程度也大不相同,pH对萌发27 h大豆油脂体乳液稳定性的影响也很大,且pH7时稳定性较好。贮藏温度为4 ℃时过氧化值整体变化范围最小,且TBARS值最低。不同温度条件下,萌发27 h大豆油脂体的酸价无显著变化(P>0.05),可见萌发27 h后的大豆油脂体乳液仍具有一定的热稳定性。
本实验在萌发大豆油脂体的应用上可以作为理论基础,为其在不同领域应用研究的开展打开了方向,但同时本研究在其成分变化以及结构变化上有所欠缺。今后萌发大豆油脂体方面的研究会更加全面,萌发大豆油脂体的应用也会更加广泛。

