卵白蛋白-壳聚糖静电相互作用对蛋白质结构和热特性的影响
熊文飞,李 亚,王立峰
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心, 江苏南京 210023)
利用蛋白质-多糖之间的静电相互作用来提升单一组分的功能特性(如增稠性、乳化性、起泡性等)和应用范围,是新型食品配料开发和食品体系稳定性调控的一条可靠途径,得到了学术界和工业界的普遍重视[1-2]。因而,近年来关于利用不同来源蛋白质-多糖之间静电相互作用强弱实现不同尺度复合凝聚物组装的基础研究和应用报道非常多,且大多数报道均侧重于蛋白质与多糖之间静电作用相行为、热动力参数、复合物功能特性等的探究[3]。然而,蛋白质-多糖复合凝聚物界面性能的强弱不仅依赖于复合物的尺度效应和理化特性,更主要取决于蛋白质在静电结合过程中的构象转变程度[4-7]。因此,探明与多糖的静电结合作用对蛋白质分子构象的影响,对深入揭示复合凝聚物的界面特性机制具有重要作用。
卵白蛋白(Ovalbumin,OVA)是鸡蛋蛋清蛋白中含量最丰富的蛋白组分,约占蛋清蛋白的54%,对蛋清的功能特性(凝胶性、乳化性和起泡性)及其在焙烤、鱼糜等制品中的应用起主导作用[8]。然而,单纯蛋白质稳定的界面易受温度、pH和盐离子强度等环境因素的影响[9]。为此,过去的报道发现采用酶法和非酶法处理OVA均可有效改善其功能特性[10-11]。然而,这些处理存在过程较复杂、应用性不强等突出缺陷。最近,Niu等[12]发现卵白蛋白与阿拉伯胶(gum arabic,GA)之间的静电结合诱导蛋白质三级构象去折叠,使更多的色氨酸残基埋藏在结构内部。此外,OVA/GA复合凝聚物的形成导致蛋白质晶体结构更为有序,且提高了α-螺旋和β-转角的pH稳定性[13];这些转变使得OVA/GA复合物稳定的乳液在pH3.8~7.0范围内均表现出较好的储藏、耐盐和耐热稳定性[14]。另一方面,在系统研究OVA与壳聚糖(Chitosan,CS)之间静电相互作用基础之上[15],研究发现OVA与CS之间的静电结合会显著增强油水界面吸附层的粘弹性和乳液宏观粘弹性,从而有助于乳液展现出突出的稳定性[16]。然而,OVA与CS之间的静电结合对蛋白质构象的影响尚未揭示,而这对于深入理解OVA/CS复合物稳定乳液的机制以及相关调控策略的提出具有重要作用。
因此,本文的重点在于借助紫外-可见光谱、圆二色谱、内源荧光光谱、傅里叶变换红外光谱探究并比较分析OVA与CS之间的静电排斥和吸引作用对蛋白质构象的影响,且进一步利用差示扫描量热仪探明静电结合对OVA热稳定性的干扰程度,从而为OVA/CS乳化特性的增强提供更深入理解。
1 材料与方法
1.1 材料与仪器
卵白蛋白(Ovalbumin,OVA,A5503,纯度大于98%) Sigma公司;壳聚糖(Chitosan,CS,脱乙酰度90.5%,平均分子量约350 kDa) 青岛云宙生化公司;其他试剂均为分析级 国药化学试剂集团。
PE20 pH计 梅特勒托利多;UV3900紫外-可见分光光度计 日本日立公司;Jasco 810型圆二色谱仪 日本Jasco公司;F-4600荧光光谱仪 日本日立公司;Nexus 470傅里叶变换红外光谱仪 美国Nicolet公司;Micro DSC III Evo微量热差示扫描量热仪 法国Setaram公司。
1.2 实验方法
1.2.1 卵白蛋白/壳聚糖混合液的制备 将卵白蛋白(OVA)粉末溶解在去离子水中,于25 ℃温和搅拌2 h,然后在4 ℃放置过夜以确保蛋白质完全水合而获得储备液(1%,w/v)。将壳聚糖(CS)粉末溶解于乙酸溶液(1%,w/v)中,在 25 ℃下搅拌过夜,制备CS(1%,w/v)储备液。按OVA与CS质量比为3:1配制混合物,然后使用0.5 mol/L盐酸和0.5 mol/L氢氧化钠将对照OVA溶液和OVA/CS混合溶液的pH分别调节至4.0和5.5。OVA/CS混合物和对照OVA的总生物聚合物含量均固定在0.2%(w/v)[15]。
1.2.2 紫外可见光谱测定 将如1.2.1所述制备的对照OVA和OVA/CS溶液用去离子水稀释至蛋白质含量为0.2 mg/mL,并调节其pH至4.0和5.5。然后采用紫外-可见分光光度计在200~700 nm范围内以5 nm的间隔进行扫描,光程1 cm,响应时间0.2 s[13]。
1.2.3 圆二色谱测定 样品制备如1.2.2所述。使用圆二色谱仪于25 ℃进行蛋白质溶液的CD光谱扫描,扫描范围190~240 nm。采用光程为0.1 cm石英皿,光谱分辨率0.5 nm,扫描速度100 nm/min,响应时间0.25 s,带宽1 nm。累积三次扫描取平均值[8]。
1.2.4 内源荧光光谱测定 样品制备如1.3.2所述。将样品置于光程为1 cm的石英皿内,使用荧光光谱仪于25 ℃下进行扫描。激发波长为290 nm,发射光谱范围为300~460 nm。激发和发射狭缝宽度为2.5 nm,扫描速度 1200 nm/min[8]。
1.2.5 傅里叶变换红外光谱测定 将1.2.1制备的对照OVA和OVA/CS混合溶液通过冷冻干燥获得粉末态样品,然后取适量样品与溴化钾混合压片并采用FTIR光谱仪于4000~400 cm-1范围内进行扫描,分辨率为4 cm-1。此外,取纯CS作为对照[8]。
1.2.6 差示扫描量热测定 采用微量差示扫描量热仪探究样品热特性。取0.800 g如1.2.1所述制备的样品置于样品池,并取等量的去离子水置于参比池。样品在25 ℃恒温10 min后,以0.5 ℃/min的速率升温至 100 ℃[17]。
1.3 数据处理
所有测量均做三次平行取平均值,图表制作均采用Origin软件8.0版。
2 结果与分析
2.1 紫外-可见分光光谱分析
一般地,蛋白质在280 nm处的特征吸收峰为酪氨酸和色氨酸残基,因而通过该吸收峰强度和位置的变化可初步判断蛋白质构象的转变情况[18]。从图1A可以发现,壳聚糖的存在导致OVA的吸收峰发生了约5 nm的红移;此外,比较吸收强度的差异可观察到在pH4.0的强度弱低于pH5.5。结合OVA为含有9个酪氨酸和3个色氨酸残基的单体球状糖蛋白[19],这些光谱信息意味着芳香族氨基酸所处的微环境发生了改变,指示蛋白质构象的转变[20]。这些转变在卵白蛋白-阿拉伯胶的静电相互作用体系内也被观察到[12]。
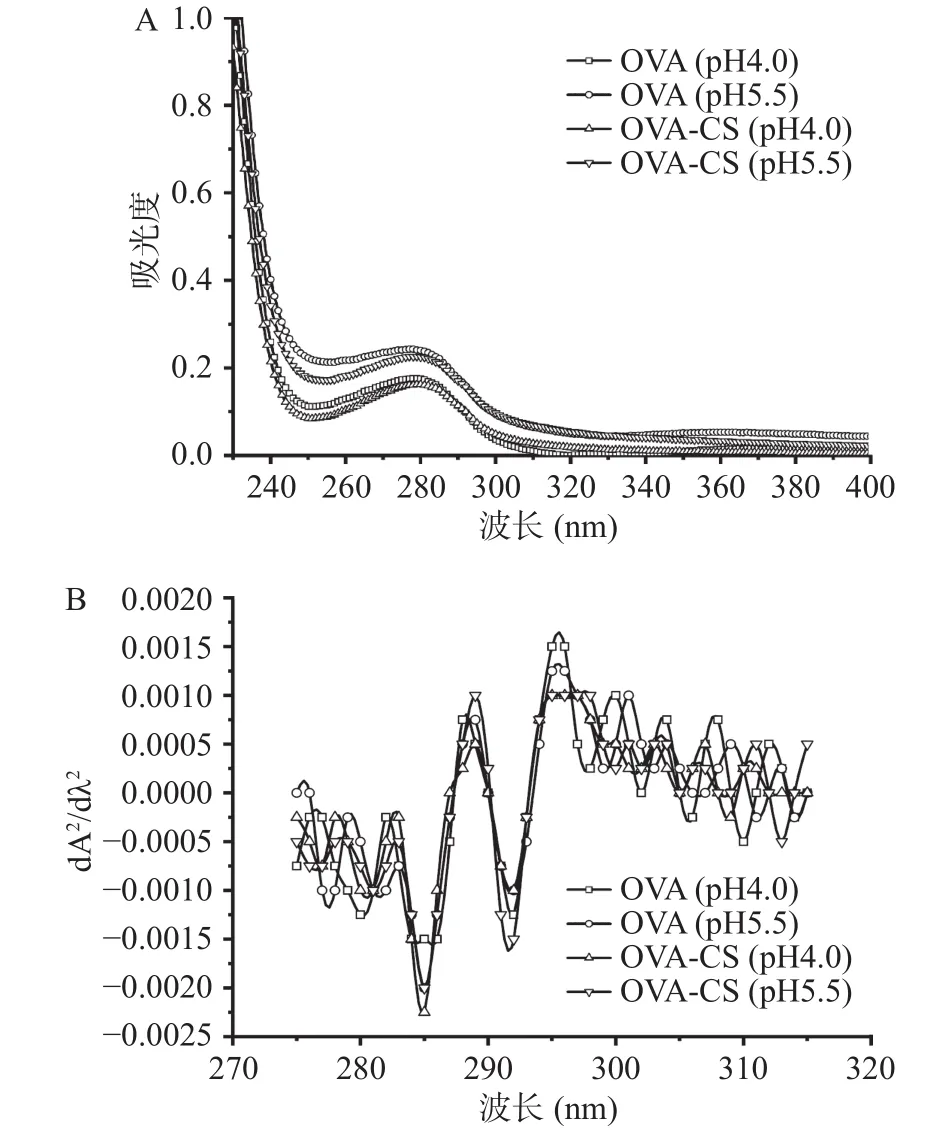
图1 不同pH条件下OVA和OVA/CS复合物的零阶紫外-可见光谱(A)与二阶导数光谱(B)Fig.1 Zero-order (A) and second-derivative (B) UV spectra of OVA and OVA/CS solutions at different pH
为进一步区分OVA构象转变的差异,对零阶光谱曲线进行处理得到二阶导数光谱(图1B)。在280~300 nm范围内,可以明显观察到曲线呈现出两个最低(285和292 nm)和最高(289和296 nm)吸收峰,其中285 nm吸收峰可能由于是酪氨酸和色氨酸残基的共同作用,296 nm为色氨酸单独贡献的结果[12]。此外,比较296 nm峰形和位置可以发现,CS的存在(包括pH4.0和5.5)导致峰形变扁平且轻微红移(约2 nm),这表明混合物中OVA的微环境的极性发生了转变,进一步意味着蛋白质的三级结构去折叠使得色氨酸残基向亲水性区域迁移[21]。类似结果在羧甲基纤维素-溶菌酶和卵白蛋白-阿拉伯胶体系也被报道过[12,22]。
2.2 内源荧光光谱分析
由于球状蛋白所含有的芳香族氨基酸(酪氨酸和色氨酸)残基的暴露情况与蛋白质周围环境的极性变化直接关联,故通常利用蛋白质内源荧光光谱来表征其高级构象的去折叠[21,23]。因此基于上一部分紫外可见光谱分析结果,进一步采用内源荧光光谱对蛋白质三级构象的转变进行表征和确认,结果如图2所示。显然地,CS的存在导致OVA的发射荧光强度显著下降,而pH对单纯OVA的影响差异较微弱。在pH4.0时,由于此时处于OVA等电点(约为pH4.85)以下,蛋白质主要荷载正电荷,故OVA与阳离子多糖CS之间以静电排斥力为主;相反,在pH5.5时,OVA与CS分别荷载负电荷和正电荷,两者可通过静电引力形成稳定的溶解性复合物[15]。因此,在样品所包含的溶解性蛋白质浓度相同的情况下,最大荧光强度的显著下降也一定程度反映了蛋白质表面芳香族氨基酸暴露程度的变化,进而表明蛋白质三级构象的部分去折叠[24]。此外,由于荧光激发波长为290 nm,只有色氨酸残基荧光被激发[25]。这说明OVA与CS之间的静电相互作用导致蛋白质表面色氨酸残基暴露程度下降,OVA三级构象发生了部分去折叠,且静电引力(pH5.5)对构象的影响更为强烈。这个结果与紫外可见光谱的发现基本一致,Niu等[12]在OVA-阿拉伯胶体系也观察到类似的现象。
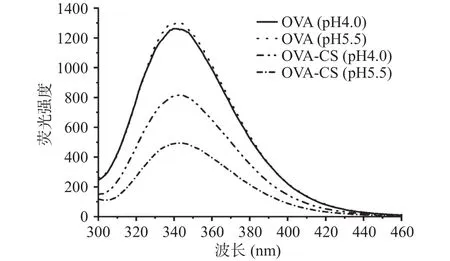
图2 不同pH条件下OVA和OVA/CS复合物的内源荧光光谱Fig.2 Intrinsic emission fluorescence spectra of OVA and OVA/CS solutions at different pH
2.3 圆二色谱分析
基于上述静电作用对OVA三级构象的影响,本部分进一步借助圆二色谱对蛋白质的二级结构进行表征,结果如图3所示。与单纯OVA体系(包括pH4.0、5.5)比较,OVA的光谱曲线受静电作用的影响较明显。为定量比较不同类型二级结构含量的变化,借助仪器自带软件通过杨氏方程对蛋白质二级结构含量进行拟合计算,结果如图3中表格所示。首先需要指出的是,与天然OVA在中性条件下的不同二级结构含量(α螺旋、β-折叠、β-转角和自由卷曲的含量分别为49%、13%、14%、24%)比较[26],pH对其有序二级结构的影响较明显,这可能是由于蛋白质分子间静电斥力的减弱(pH4.0和5.5相对于pH7.0更接近等电点)导致分子间发生微弱聚集而产生的构象变化。其次,同单纯OVA体系(pH5.5)比较,OVA与CS之间的静电吸引作用导致其α-螺旋、β-转角和自由卷曲含量分别下降约26.9%、52.3%、6.0%,β-折叠增加约33.9%。此外,与静电排斥力(pH4.0)比较,吸引力(pH5.5)导致 OVA-CS 的α-螺旋、β-转角和自由卷曲含量分别增加约1.5%、7.7%、2.3%,β-折叠下降约2.0%。类似的结果在溶菌酶-羧甲基纤维素体系内也被观察到[5-6],这进一步确认了静电作用诱导蛋白质发生了部分去折叠,且这些变化主要发生在蛋白质的有序二级结构层面。
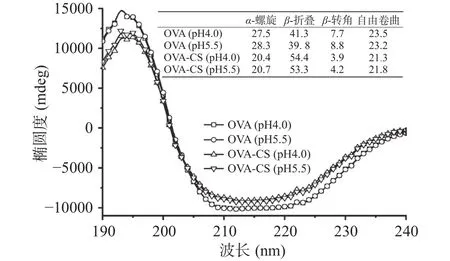
图3 不同pH条件下OVA和OVA/CS复合物的圆二色谱Fig.3 Circular dichroism spectra of OVA and OVA/CS solutions at different pH
2.4 傅里叶变换红外光谱分析
根据傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)光谱所反映的官能团间的相互作用,可进一步证实蛋白质-多糖之间的静电相互作用[5-6]。如图4所示,对于天然OVA在pH5.5,3287 cm-1处的峰对应-OH,1700~1600 cm-1为酰胺I(C=O,自由羧基)的拉伸振动,1575~1475 cm-1为酰胺II的拉伸和弯曲振动,1400~1200 cm-1为由N-H弯曲和CN-拉伸组合形成的酰胺III[27-28]。另一方面,CS的特征峰分别出现在3400、3300、1560和1080 cm-1左右,分别对应于其羟基(-OH)、胺基(-NH2)、酰胺II(N-H弯曲振动与C-N拉伸振动耦合)和糖苷键(C-O-C)[29]。此外,尽管 OVA与 CS在pH5.5通过静电结合形成的复合物也保留了天然OVA所显示的类似光谱轮廓,但在OVA/CS复合物中与酰胺 I(1650 cm-1,C=O,自由羧基)、-NH3+(1560 cm-1)相关的吸收峰均向低波数移动。这表明OVA的-COO-与 CS的-NH3+之间发生了静电结合[29],同时进一步证明了静电结合对蛋白质构象产生了影响。此外,3600~3000 cm-1处的宽带表明OVA和CS之间的氢键增强,暗示两者之间还存在氢键作用[6]。
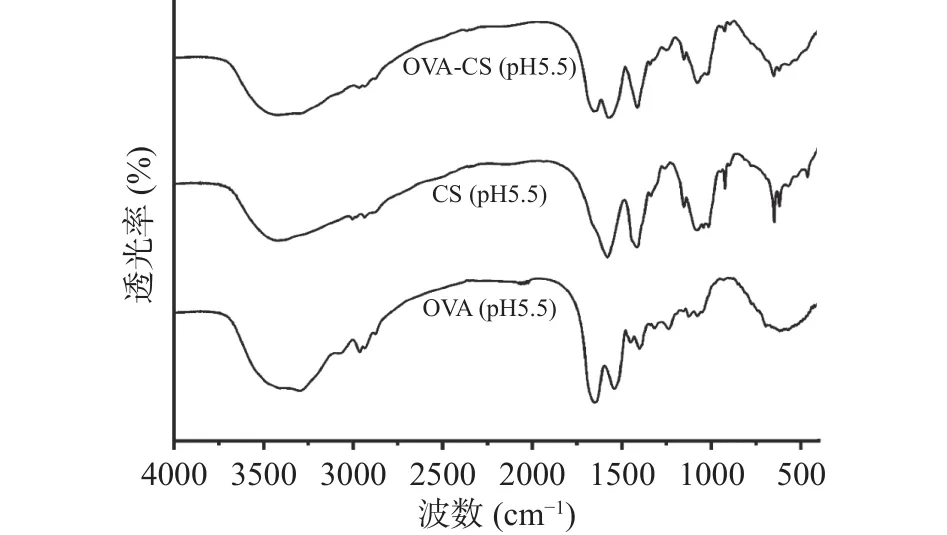
图4 OVA和OVA/CS复合物的傅里叶变换红外光谱Fig.4 FTIR spectra of OVA and OVA/CS solutions
2.5 差示扫描量热分析
OVA、CS和OVA/CS静电结合物(pH5.5)的差示扫描量热(DSC)数据如图5所示。首先,纯OVA在78 ℃左右呈现出一个典型的吸热峰,由于实验过程中为液态样品且是微量量热测定程序,因此该温度为蛋白质的变性温度。这与文献报道的液态OVA变性温度(84 ℃)略有不同[17],推测可能是pH导致的差异。本实验样品体系(pH5.5)相比于中性体系更接近OVA的等电点(pH4.85),蛋白质分子间的斥力减弱而产生微聚集使得结构在加热过程中更易于展开。此外,由于CS骨架由糖苷键串联形成,其玻璃化转变温度高于100 ℃[30],因此在实验温度范围内未观察到明显的吸热峰。有报道表明,静电结合作用通常能提高蛋白质的热变性稳定性[29],而在OVA/CS静电复合物体系中也观察到了这种现象。如图5所示,OVA的变性吸热峰从78 ℃上升到83 ℃左右。进一步证实了通过与多糖的静电结合可有效提升蛋白质的热变性温度,这对于一些热敏性蛋白质(如酶类)是一种简单、可靠且实用的保护策略。
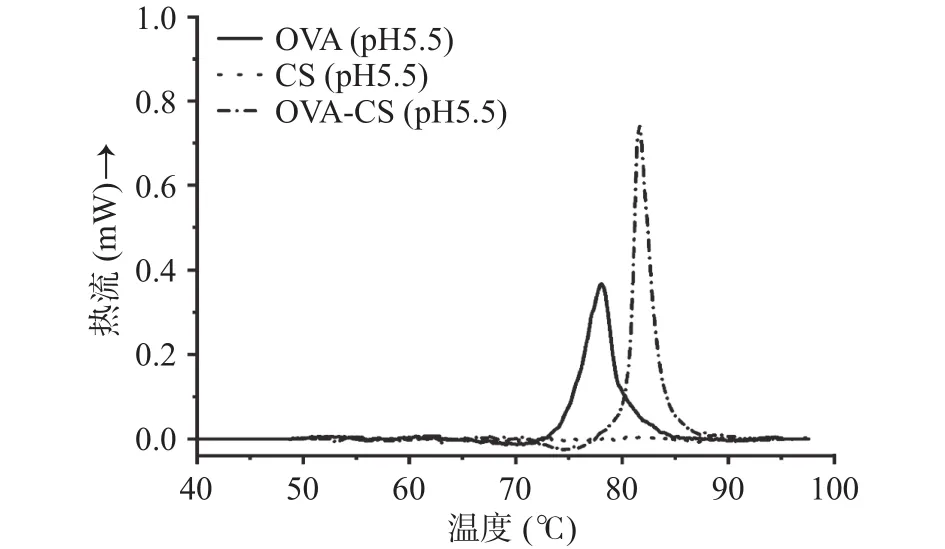
图5 OVA和OVA/CS复合物在pH5.5的热流曲线Fig.5 Heat flow curves of OVA and OVA/CS solutions at pH5.5
3 结论
OVA与CS之间无论是静电排斥力还是静电吸引力都会导致OVA的结构发生去折叠,主要表现为色氨酸残基向亲水区域迁移且暴露程度下降;二级结构中α-螺旋、β-转角和自由卷曲含量分别下降约26.9%、52.3%、6.0%,β-折叠增加约 33.9%。FTIR不仅确认了上述结果,还进一步证明了OVA与CS之间静电结合作用的存在。此外,OVA的热变性温度由于静电结合作用从78 ℃上升到83 ℃左右,表明其热稳定性得到了增强。这些发现不仅对深入理解OVA/CS静电复合物的界面特性提供新的见解,也对相关蛋白质-多糖系统性能调控提供借鉴作用。

