经导管主动脉瓣置换术在重度主动脉瓣狭窄合并主动脉瓣关闭不全患者中的应用
纪 军, 何胜虎, 徐 冰, 陈 述, 张 晶, 方 震,
廖清池, 陈 勇, 杨柳青, 黄文诺
(江苏省苏北人民医院 心内科, 江苏 扬州, 225001)
近年来,经导管主动脉瓣置换术(TAVR)以其创伤小、恢复快等优点,成为有症状的行外科手术的中高危重度主动脉瓣狭窄(AS)患者的优选治疗方案。2019年美国心脏病学会科学年会(ACC 2019)[1-2]公布的PARTNER3研究和Evolut Low Risk研究表明,外科手术低危的重度AS患者应用球扩式瓣膜(SAPIEN3)和自膨胀式瓣膜(Evolute R)进行TAVR治疗的主要终点发生率等同或者优于外科主动脉瓣置换术(SAVR)治疗。目前,临床上TAVR主要应用于重度AS患者。对于单纯重度主动脉瓣反流(AR)患者,由于自身解剖结构的特点,如钙化程度轻,甚至无钙化,缺乏稳定的锚定区; 主动脉瓣的瓣环通常较大,瓣膜定位困难,容易发生移位,术后瓣周漏发生率高[3-4]; 或是没有合适尺寸的人工瓣膜可供选择,这些原因都限制了TAVR技术在AR患者中的应用。本研究探讨TAVR在合并主动脉瓣关闭不全的重度AS患者中的疗效及安全性,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取2018年4月—2021年1月江苏省苏北人民医院18例入院诊断为重度AS合并中重度主动脉瓣关闭不全的住院患者为A组,另选取22例同期入院诊断为单纯重度AS或仅合并轻度主动脉瓣关闭不全患者为B组,患者均采用杭州启明公司的Venus-A自膨胀式人工主动脉瓣膜完成TAVR术。
纳入标准: ① 老年(年龄≥70岁)重度AS者,伴或不伴主动脉瓣关闭不全。超声心动图检查显示跨主动脉瓣血流速度≥4.0 m/s, 或跨主动脉瓣平均压力差≥40.0 mmHg (1 mmHg=0.133 kPa), 或主动脉瓣口面积<1.0 cm2; 或主动脉瓣口面积指数<0.5 cm2/m2。② 患者有气喘、晕厥、胸痛、胸闷等AS相关临床症状,美国纽约心脏病协会(NYHA)心功能分级Ⅱ级以上。③ 瓣环直径20~29 mm, 外周主入路血管直径≥6 mm。④ 外科手术中高危者、有手术禁忌证者。⑤ 预计TAVR术后生存时间超过12个月者。排除标准: ① 左心室内血栓者; ② 左室流出道梗阻者; ③ 左心室射血分数<20%者; ④1个月内的心肌梗死者; ⑤ 预计术后生存时间不足12个月者。所有患者均经心脏内外科联合会诊,存在SAVR手术禁忌证或者中高程度危险,并签署知情同意书。
1.2 研究方法
所有患者均在杂交手术室内完成手术,采取全身麻醉,选取经股动脉或者颈动脉途径。常规消毒铺巾,穿刺右侧颈内静脉,置入5F鞘管,漂浮临时起搏电极经鞘管送至右室心尖部,测试后备用。经食道超声全程监测,透视及造影引导下分别穿刺辅入路和主入路股动脉,置入动脉鞘。主入路股动脉预置2把Proglide缝合器,在Lunderquist超硬导丝引导下送入18~20 F股动脉鞘。推注肝素80~100 U/kg, 活化凝血时间(ACT)维持在250~350 s, 每30 min监测1次。经辅入路侧股动脉鞘管送入6F猪尾导管至无冠窦内或者升主动脉窦低行主动脉根部造影。选择直头导丝或泥鳅导丝跨瓣送至左心室内, 6F猪尾导管送入左心室,测跨瓣压差并记录。将Lunderquist导丝头端预塑形并交换送至左心室心尖部,沿Lunderquist导丝送Numed球囊至主动脉瓣处, 180次/min快速起搏右心室,收缩压降至60 mmHg以下时,快速预扩张1~2次,根据球囊膨胀是否完全及术前CT血管造影测量结果选择合适的Venus-A人工主动脉瓣膜(杭州启明医疗器械有限公司),沿Lunderquist导丝送至主动脉瓣环处,以猪尾导管最低点作为瓣环参考线,调整人工瓣膜深度0~6 mm, 缓慢释放瓣膜前1/3部分,瓣膜中间1/3部分在140~160次/min右心室起搏下快速释放,最后缓慢完全释放人工瓣膜。经食道超声及主动脉根部造影评估瓣膜形态及功能情况,如瓣膜膨胀不良或者出现中度及中度以上瓣周漏,需行球囊后扩张或植入第2个瓣膜。术毕使用预置的2把Proglide缝合器缝合股动脉穿刺点,局部加压包扎后至心血管内科监护病房(CCU)或者重症监护病房(ICU)观察,并保留临时起搏电极至术后24~48 h。术后对于无抗凝适应证者,给予阿司匹林100 mg联合氯吡格雷75 mg双联抗血小板治疗3~6个月,而后长期单一抗血小板药治疗。对于有抗凝适应证者,给予长期华法林抗凝治疗。
1.3 评价指标
① 即刻手术成功率(无术中死亡、人工主动脉瓣位置正确、跨主动脉瓣平均压力差<20 mmHg且无中重度AR和瓣周漏)。② 即刻及随访6个月跨瓣压差、瓣周漏情况、人工瓣膜形态及功能。③ 随访6个月左室射血分数及左室舒张末期内径变化等。④ 住院及随访6个月期间发生的主要不良事件,包括急性脑血管事件(脑卒中、短暂性脑缺血发作等)、严重出血事件、严重传导阻滞(需植入永久起搏器)、严重血管并发症(血管急性闭塞、穿刺部位动脉夹层、动静脉瘘、假性动脉瘤、严重血肿等)、死亡。
1.4 统计学分析

2 结 果
2.1 2组患者基本资料比较
2组患者年龄、性别、吸烟、高血压、糖尿病、高血脂、肾功能、合并心房颤动或者心房扑动、美国胸外医师协会(STS)评分、欧洲心脏手术风险回归(Logistic EuroSCORE)评分、NYHA心功能Ⅲ~Ⅳ级比率等比较,差异均无统计学意义(P>0.05)。A组患者平均主动脉瓣环内径、二叶式畸形患者比率、升主动脉内径高于B组,钙化积分低于B组,差异有统计学意义(P<0.05)。见表1。

表1 2组患者基本资料比较
2.2 2组TAVR术中情况比较
2组患者手术即刻均取得成功, 2组手术入路、选择瓣膜尺寸及植入瓣中瓣率等比较,差异均无统计学意义(P>0.05)。见表2。

表2 2组TAVR术中情况比较[ n(%)]
2.3 2组围术期超声检查及并发症比较
2组术后即刻和术后6个月的跨主动脉瓣流速、主动脉瓣平均跨瓣压差以及术后6个月的左心室舒张末内径均低于术前,术后6个月的左心室射血分数高于术前,差异有统计学意义(P<0.05)。B组术后即刻、术后6个月的瓣周漏发生率低于A组,差异有统计学意义(P<0.05)。见表3。2组术后即刻、术后6个月的并发症发生率比较,差异无统计学意义(P>0.05)。见表4。

表3 2组围术期超声检查结果比较
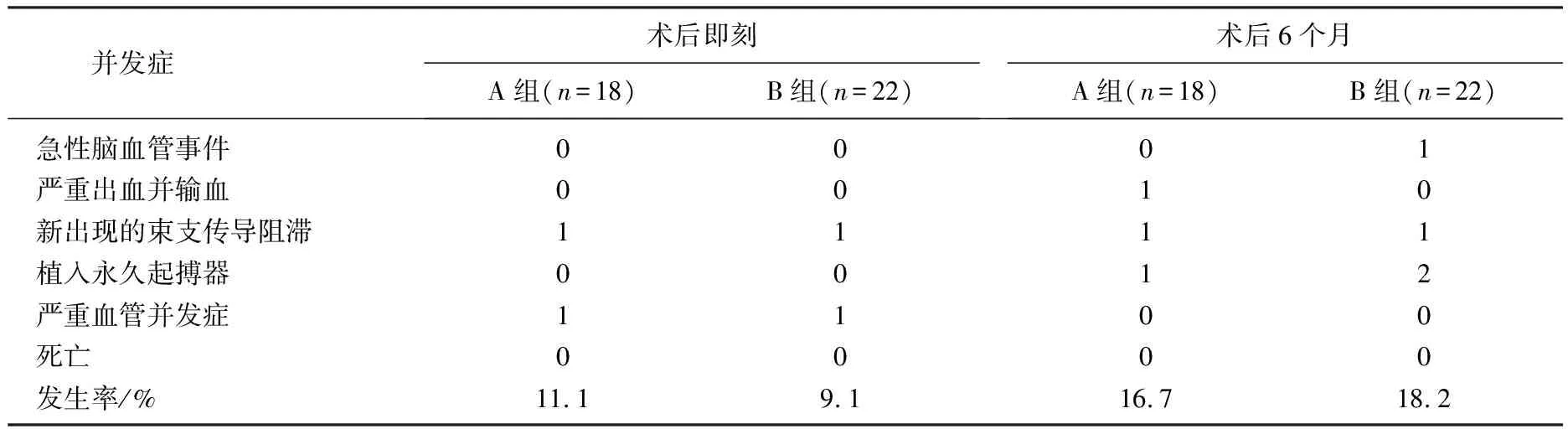
表4 2组围术期并发症发生情况比较
3 讨 论
对于无法耐受外科手术或者外科手术高危的主动脉瓣疾病(包括AS和主动脉瓣关闭不全)患者, TAVR已成为其主要的治疗手段[5-6]。因AS和主动脉瓣关闭不全患者主动脉瓣解剖结构特点不同,在瓣膜选择、释放位置等方面都有差异。对于重度AS合并中重度AR的患者,由于解剖结构综合了狭窄和关闭不全的特点,更为复杂,手术难度及手术风险也更大。
目前国内TAVR术使用的人工瓣膜大多为自膨胀式瓣膜,需要将钙化的自体瓣叶压在主动脉壁上,以此获得足够的径向支撑力,牢固锚定人工瓣膜。自体瓣膜钙化是完成TAVR的一个重要条件。如果自体瓣膜钙化程度较轻甚至无钙化,支架植入易产生移位,增加TAVR手术失败风险[7-8]。而一旦发生瓣膜移位,无论是上移还是下移,均会导致严重并发症。位置明显下移可能会影响二尖瓣功能及增高瓣周漏风险; 位置明显上移可能会增加阻塞冠状动脉开口的危险,并可导致心力衰竭、心肌梗死、死亡等风险增高。本研究中A组患者的钙化容积显著小于B组(P<0.05), 钙化程度相对较轻,增加了手术难度及风险。
研究[9]表明,合并升主动脉增宽的主动脉瓣疾病患者行TAVR术后的少量瓣周漏发生率会明显高于不合并升主动脉增宽的患者,对于外科手术高风险和较多合并症的患者,即使轻度瓣周漏也会增加TAVR术后2年随访的死亡率。二叶式主动脉瓣畸形常伴有升主动脉扩张、主动脉夹层、升主动脉瘤等情况。研究[10]发现,二叶式主动脉瓣疾病患者的瓣环面积、升主动脉及瓦氏窦内径均显著大于正常三叶式主动脉瓣患者,并且二叶式主动脉瓣的偏心钙化更加严重。另一项观察TAVR在二叶式AS中应用的研究[11]也发现,入组的100例重度AS患者,术前超声心动图检查提示二叶式AS组与正常三叶式AS患者比较,升主动脉直径更宽。正是由于这些解剖特点,这些患者行TAVR手术的成功率比三叶瓣患者要低,瓣周漏的发生率以及中重度AR、瓣中瓣植入率、转外科换瓣手术的发生率等不良事件发生率均较高。一项多中心回顾性研究[12]结果表明,在使用自膨胀型主动脉瓣瓣膜治疗的TAVR术中,升主动脉内径增大(>32.1 mm)是手术失败的独立因素。长期的AR会有主动脉根部及升主动脉的相对病理性扩张,导致主动脉瓣瓣环扩大[13], 从而使反流进一步加重,形成恶性循环。本研究中, A组的二叶式主动脉瓣畸形率、升主动脉内径高于B组,差异有统计学意义(P<0.05), 导致TAVR术后A组瓣周漏的发生率高于B组。
从病理生理特点来看,单纯重度AS患者主要是压力负荷过重,压力负荷需要更粗的心肌细胞来对抗更大的后负荷,导致左心室向心性肥厚。这类患者在TAVR术后左室压力负荷会得到改善, LVEF升高,左室肥厚大多会逆转[14]。合并中重度主动脉瓣关闭不全的重度AS患者,除了压力负荷过重外,容量负荷也会增大,容量负荷需要更长的心肌细胞来调节Frank-Starling机制,一旦该机制失调,左室功能就不可逆转地受损,造成心室体积增大,室壁应力增加,并出现左心室重构和左室功能障碍[15]。这类患者在TAVR术后左室功能很难完全恢复,理论上会导致左心室扩张、心力衰竭、心律失常等并发症增高,这类患者的预后也较差。
本研究结果显示,重度AS合并中重度主动脉瓣关闭不全患者TAVR术后能有效降低平均跨瓣压差,改善心功能,但瓣周漏发生率明显增加,且多为微量或轻度瓣周漏。术后6个月内脑卒中、消化道大出血、严重血管并发症、永久起搏器植入情况及死亡等主要不良事件的发生率无明显增加。

