慢性心力衰竭患者预后不良的血清学预测指标研究
睢 勇, 孙 慧, 幺传为, 时 敏, 虞 君
(山东省聊城市中医医院, 1. 心内科; 2. 血液透析室, 山东 聊城, 252000)
慢性心力衰竭(CHF)是心脏循环障碍相关心血管疾病的晚期并发症。CHF患者预后很差,年均病死率高达30%~50%, 因此对CHF患者进行预后预测极其重要。目前常用的血液检测生物标志物是血清N端B型利钠多肽(NT-proBNP), 但由于其水平容易受到自身蛋白结构以及患者体质量指数(BMI)、年龄、性别、代谢异常和肾功能等因素的影响,其检测结果也易受到影响[1-2]。因此需要探索新型生物标志物进行CHF预后预测。研究[3-4]显示,血清可溶性基质裂解素2(sST2)在CHF患者体内显著升高,而血清分化生长因子-15(GDF-15)在发生急性应激时,会产生活性,两者有望作为新型生物标志物用于CHF的诊断治疗以及预后评估。
另有研究[5]报道,孤独G蛋白偶联受体(Apelin)是一种肽类激素,具有多种生物效应,而孤独G蛋白偶联受体配体-12(Apelin-12)是Apelin亚型之一,广泛存在于心肌组织和冠状动脉内皮细胞中,与心肌缺血后再次灌注损伤相关,在CHF患者中其水平明显降低,可作为CHF预后评估的潜在标记物。但目前血清sST2、GDF-15和Apelin-12三者联合作为CHF患者预后预测的相关研究减少。基于此,本研究探讨血清sST2、GDF-15、Apelin-12水平对CHF患者预后不良预测效能,现报告如下。
1 资料与方法
1.1 一般资料
选取山东省聊城市中医医院2019年1月—2020年4月收治的145例初诊CHF患者作为A组,招募138例健康志愿者作为B组。A组男71例,女74例; 年龄42~82岁,平均(64.48±4.67)岁; 有吸烟史52例,饮酒史57例; 病因: 冠心病38例,高血压性心脏病36例,风湿性心脏病23例,扩张型心肌病28例,病毒性心肌炎20例; 合并糖尿病61例;合并高脂血症62例; 心功能按照美国纽约心脏病协会(NYHA)心功能分级, Ⅱ级患者48例, Ⅲ级患者47例, Ⅳ级患者50例。B组男138例,女68例; 年龄41~84岁,平均(65.89±5.37)岁。2组性别、年龄比较,差异无统计学意义(P>0.05)。
纳入标准: ① A组均符合《中国心力衰竭诊断和治疗指南2014》中的相关规定[6]; 均为初诊病例; 均同意且签署知情同意书。② B组均是血常规、血糖、肝功能、胸片和心脏彩超检查等结果正常的志愿者; 均同意且签署知情同意书。排除标准: ① 半年内发生急性心肌梗死患者; ② 恶性心律失常患者; ③ 患有缺血性心肌病、心脏瓣膜病、支气管哮喘、感染性疾病、自身免疫病、严重肝肾功能不全和各种恶性肿瘤等者; ④病史不全影响判断的患者; ⑤ 妊娠期患者; ⑥ 不签署知情同意书者。剔除标准: 随访过程中失联或者未能定期随访者。
1.2 方法
① 血清sST2、GDF-15和Apelin-12水平测定: A组确诊后采取5 mL空腹静脉血放于采集管中,室温下放置2 h或者4 ℃过夜,然后2 000转/min离心20 min, 取上清液,或将上清液置于-70 ℃低温冰箱保存,但要避免反复冻融。B组次日采用相同办法获取血清上清液,然后分别按照sST2、GDF-15和Apelin-12 ELISA试剂盒(购自上海酶联生物科技有限公司)中操作说明,检测血清中的sST2、GDF-15和Apelin-12水平。
② CHF治疗: 参照《中国心力衰竭诊断和治疗指南2014》, 对心力衰竭患者均进行规范治疗,常规情况进行血管紧张素转化酶受体拮抗剂或者抑制剂(ARB/ACEI)治疗,当心功能处于Ⅱ~Ⅲ级时,用脑啡肽酶抑制剂(ARNI)和血管紧张素受体代替(ARB/ACEI)治疗; 当患者体液潴留过多,用利尿剂进行治疗;心力衰竭合并糖尿病患者进行醛固酮受体拮抗剂治疗。按照上述治疗后,对于左心室射血分数(LVEF)<35%时的窦性心律,可增加伊伐布雷定治疗,患者病情稳定后,长期服用β受体阻滞剂和ACEI预防和延缓心力衰竭的复发。
③ 预后不良判断: 预后不良判断参照《中国心力衰竭诊断和治疗指南2014》, 即患者治疗出院后,电话随访1年,了解治疗后患者情况,记录心脏不良事件,包括患者是否CHF恶化入院或者死亡,若患者随访中发现CHF恶化入院或者死亡,记为预后不良,其他为预后良好。
④ 血清sST2、GDF-15、Apelin-12水平与CHF患者预后不良的关系分析方法: 记录入院患者年龄、性别、BMI、吸烟史、饮酒史、联系方式、入院时间和采血时间,并采集既往和现病史,主要包括是否合并糖尿病、合并高脂血症以及病因等。将性别、年龄、BMI、吸烟史、饮酒史、合并糖尿病、合并高脂血症、病因以及血清NT-proBNP、sST2、GDF-15、Apelin-12水平作为自变量,将CHF患者的预后情况作为因变量。
1.3 观察指标
① A组与B组血清sST2、GDF-15、Apelin-12水平比较; ② A组预后情况; ③ A组预后不良与预后良好者血清sST2、GDF-15、Apelin-12水平比较; ④ 血清sST2、GDF-15、Apelin-12水平与A组预后不良的关系分析: 记录A组预后不良的影响因素,并记录各影响因素的比值比(OR)与95%可信区间(95%CI); ⑤ 分析血清sST2、GDF-15、Apelin-12水平单独与联合应用对A组预后不良的预测价值: 利用受试者工作特征(ROC)曲线下面积(AUC)评估,其中三者中任意1个指标预测A组预后不良阳性即认为联合预测阳性,记录三者单独与联合应用预测预后不良的灵敏度、特异度、AUC、95%CI。
1.4 统计学分析
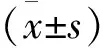
2 结 果
2.1 A组与B组血清sST2、GDF-15、Apelin-12水平比较
A组血清sST2和GDF-15水平均高于B组,血清Apelin-12水平低于B组,差异均有统计学意义(P<0.05), 见表1。

表1 2组血清sST2、GDF-15、Apelin-12水平比较[ M(Q1, Q3)]
2.2 A组预后情况及不同预后血清sST2、GDF-15、Apelin-12水平比较
随访期间, A组有2例失访,剔除本研究,共计预后不良患者63例(预后不良组),其中CHF恶化入院的有57例,死亡患者6例,预后良好80例(预后良好组),预后不良发生率为44.06%。预后不良组的血清sST2和GDF-15水平均高于预后良好组, Apelin-12水平低于预后良好组,差异均有统计学意义(P<0.05), 见表2。

表2 A组预后不良和预后良好组血清sST2、GDF-15、Apelin-12水平比较[ M(Q1, Q3)]
2.3 血清sST2、GDF-15、Apelin-12水平与A组预后不良的关系分析
各变量赋值方法见表3, 经分析发现,预后不良组年龄、血清NT-proBNP、sST2、GDF-15水平均高于预后良好组,血清Apelin-12水低于预后良好组,合并糖尿病、合并高脂血症例数均多于预后良好组,差异均有统计学意义(P<0.05), 见表4。经Logistic回归分析发现,年龄、合并糖尿病、合并高脂血症和血清NT-proBNP、sST2、GDF-15水平升高及血清Apelin-12水平降低均是影响CHF预后不良的独立危险因素(OR=6.726、6.038、6.753、5.859、6.456、6.693、6.190,P均<0.05), 见表5。

表3 变量赋值方法
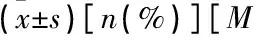
表4 A组CHF发生与未发生患者临床资料比较(Q1, Q3)]
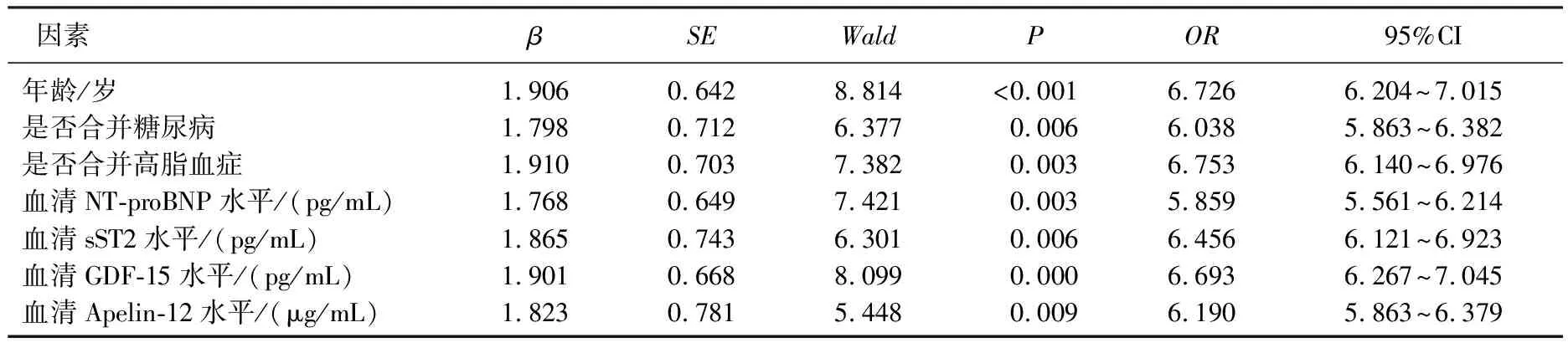
表5 Logistic回归分析
2.4 血清sST2、GDF-15、Apelin-12水平单独与联合应用对A组预后不良的预测价值比较
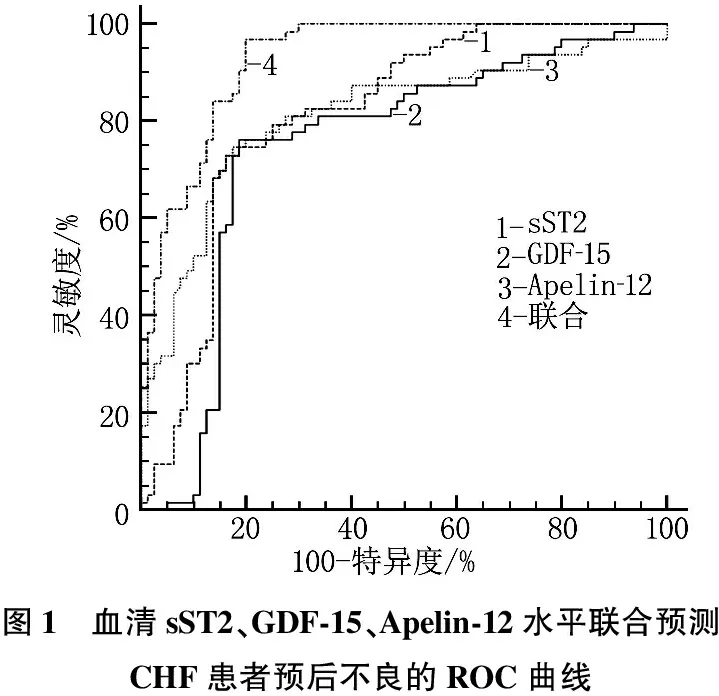
血清sST2、GDF-15、Apelin-12水平联合预测CHF患者预后不良的灵敏度均高于单独预测(χ2=13.945 0,P=0.000;χ2=11.492,P=0.001;χ2=12.704,P<0.001), AUC均高于单独预测(Z=2.815,P=0.005;Z=3.893,P<0.001;Z=2.645,P=0.008), 特异度均与单独预测差异无统计学意义(χ2=0.379,P=0.538;χ2=0.040,P=0.841;χ2=0.164,P=0.685)。见表6、图1。

表6 sST2、GDF-15、Apelin-12水平对CHF患者预后不良的预测分析
3 讨 论
CHF是一种以外周血流分布异常、神经内分泌激活和心室功能不全为特征的临床综合征,具有高复发性,严重影响患者生活质量。研究[7]发现,出院后复发是影响CHF患者预后的主要因素,因此寻找生物标志物有效评估CHF患者预后情况对临床具有重大意义。传统的心力衰竭诊断和预后预测标志物为NT-proBNP[8], 但因其检测结果易受多因素影响,急需寻找新的更有效的生物标志物。
本研究结果显示, A组血清sST2和GDF-15水平均显著高于B组,血清Apelin-12水平低于B组,提示血清sST2、GDF-15和Apelin-12与CHF密切相关,具有作为新的预测CHF患者预后的生物标志物潜能。前期研究[9]报道, CHF患者中血清sST2和GDF-15水平显著升高,血清sST2和GDF-15有望作为新型标志物用于临床CHF患者预后评估,这与本研究结果相一致。这可能是因为sST2作为基质裂解素2(ST2)的一种分泌型亚型,当心肌成纤维细胞和心肌细胞受到压力负荷或者容量变化时大量分泌,与ST2的另一种跨膜型亚型ST2L竞争性结合白细胞介素(IL)-33, 阻断了ST2L的内源性心肌保护作用,进而引起心肌重构,导致心力衰竭。A组血清sST2水平高于B组,而GDF-15是一种应激反应蛋白,当机体发生缺血、CHF和炎症反应时,心肌细胞中会大量表达GDF-15蛋白,血清浓度升高。活性肽Apelin是APJ受体的内源性配体, Apelin-12是其家族重要成员之一,当心力衰竭发生时, RAAS系统激活,血浆中的AngII水平明显升高,通过与AngII受体结合抑制Apelin/APJ系统的表达和分泌,可能导致了CHF患者血清中Apelin-12水平降低[10]。
本研究A组预后不良发生率为44.06%, 高于穆艳会等[1]研究中的27.45%, 但低于丁才智等[11]报道的49.53%, 这可能是因为选择的患者病情不完全相同以及临床治疗差异等,但都表明CHF预后不良发生率很高,进一步表明寻找性能更好的生物标志物具有重要意义。研究[12-13]报道,血清sST2与CHF患者1年后的预后不良呈剂量依赖关系,血清中sST2水平的升高常伴有病死率的升高,是CHF预后不良的标志; 血清GDF-15水平越高, CHF患者心血管不良事件发生率越高,而血清Apelin-12水平越低, CHF患者心血管不良事件发生率越高。本研究结果显示, A组预后不良患者血清sST2、GDF-15水平高于预后良好患者, Apelin-12水平低于预后良好患者,与前期研究结果一致,这可能与血清sST2、GDF-15和Apelin-12作用机制有关,前两者可促进CHF发生,两者水平升高会提高CHF恶化概率,而Apelin-12可降低心脏前后负荷,促进心肌细胞增强,所以其水平的降低会提高CHF恶化概率。李明远等[14]研究表明血清sST2、Galectin-3、BNP和三者联合预测CHF不良预后的灵敏度分别为81.50%、76.90%、78.5%和86.25%, AUC分别为0.891、0.853、0.881和0.910, 丁才智等[11]报道的血清HGF、GDF-15以及两者联合预测CHF患者预后不良灵敏度分别为73.00%、78.00%和86.00%, AUC分别为0.805、0.849和0.923, 均表明联合预测性能高于单独预测。本研究结果显示,血清sST2、GDF-15、Apelin-12及三者联合预测CHF患者预后不良的灵敏度分别为73.02%、76.19%、74.60%和96.83%, AUC分别为0.811、0.745、0.812和0.930, 与前期报道一致,联合预测性能均高于单独预测,这可能因为三者参与CHF发病机制不同,联合预测可减少误差,使灵敏度更高,效果更好。
此外,本研究还发现年龄、合并糖尿病、合并高脂血症和血清NT-proBNP水平升高均是A组预后不良的影响因素,提示上述因素升高,均会增高CHF不良预后的概率,与前期国内外CHF影响因素的相关研究[15-16]结果一致。其原因可能为随着年龄增长,患有多种心脏病概率增大,使心脏储备功能变差; CHF患者合并糖尿病后,因为糖尿病主要累及毛细血管,会使毛细血管网减少,导致心肌弥漫性缺血,在参与心室重构过程中导致心力衰竭,因此糖尿病是A组预后不良的影响因素,而高脂血症是糖尿病的危险因素,进而可能导致高脂血症、促使CHF预后不良; 血清NT-proBNP是肽类神经激素中的一种,心力衰竭发生时,心脏容量负荷和压力加重,使心肌细胞遭受牵张,促使NT-proBNP分泌增多,心力衰竭越严重,其水平越高,患者预后越差,因此上述因素均是A组预后不良的影响因素。
综上所述, CHF患者血清sST2和GDF-15水平偏高,血清Apelin-12水平偏低,且上述血清指标、年龄、合并症均与患者的预后有关。血清sST2、GDF-15和Apelin-12联合预测CHF预后不良具有更理想的预测效能,可为临床提高CHF预后效果提供有力的依据。

