全段成纤维细胞生长因子23与维持性血液透析患者肾性贫血的相关性研究
韩 蓓, 韩俊岭, 曹靖昊, 于 洋, 龚 琴
(1.江苏省扬州友好医院 肾内科, 江苏 扬州, 225001; 2. 江苏省泰州市人民医院 检验科, 江苏 泰州, 225300;3. 新乡医学院, 河南 新乡, 453000; 4. 江苏省泰州市人民医院 全科医学科, 江苏 泰州, 225300)
肾性贫血是终末期肾病(ESRD)患者最常见的并发症之一,发生于超过90%的透析患者中,严重影响维持性血液透析(MHD)患者的生活质量和远期预后[1]。铁缺乏和促红细胞生成素缺乏一般被认为是ESRD患者发生贫血的主要原因,亦是有效的治疗靶点[2]。然而越来越多的横断面研究[3-4]表明,矿物质代谢紊乱相关指标与贫血之间可能存在联系。成纤维细胞生长因子23(FGF23)是正常生理过程中最重要的磷脂激素之一,主要由骨细胞和成骨细胞分泌,也可由骨髓分泌[5]。在肾脏中,FGF23主要通过结合FGF23受体(FGFR)-αKlotho共受体抑制肾小管上皮细胞表达钠磷共转运蛋白-Ⅱa(NaPi-Ⅱa)和钠磷共转运蛋白-Ⅱc(NaPi-Ⅱc),抑制磷酸盐重吸收,刺激尿磷酸盐排泄,调节1, 25-二羟基维生素D的产生和降解[6]。晚期慢性肾脏病(CKD)患者中,磷的蓄积可导致血清FGF23水平不断升高。相关研究[7]发现, FGF23、炎症、铁代谢和红细胞生成之间存在着意想不到的相互作用。本研究探讨了全段FGF23(iFGF23)与MHD患者肾性贫血的相关性,现报告如下。
1 对象与方法
1.1 研究对象
选择2020年9月—2021年3月在扬州友好医院血液净化中心规律血液透析的成年患者作为研究对象。纳入标准: ① 年龄>18岁者; ② 每周透析2~3次,每次4 h者; ③ 透析血流量200~300 mL/min者; ④ 被诊断为慢性肾衰竭者。排除标准: ① 透析龄<3个月者; ② 正在服用免疫抑制剂或其他影响骨髓造血功能的药物者; ③ 近3个月内有消化道出血史或接受过输血治疗者; ④ 近1个月内有手术或创伤史、急性心肌梗死、急性脑梗死、主动脉夹层、动脉瘤等患者; ⑤ 既往有血液系统疾病、恶性肿瘤、肝硬化史者; ⑥ 临床资料不完整者。
1.2 研究方法
1.2.1 一般资料收集: 收集研究对象的性别、年龄、透析龄、体质量指数(BMI)、收缩压(SBP)、舒张压(DBP)等资料,并记录既往高血压、糖尿病等基础疾病情况。计算周促红细胞生成素(EPO)用量=周总剂量(IU)/体质量(kg)。
1.2.2 实验室检查: 检测所有研究对象透析前空腹外周血血红蛋白(Hb)、红细胞(RBC)、红细胞比容(HCT)、红细胞平均体积(MCV)、红细胞平均血红蛋白量(MCH)、红细胞分布宽度(RDW)、白细胞(WBC)、血小板(PLT)、血小板分布宽度(PDW)和甘油三酯(TG)、总胆固醇(TC)、尿酸(UA)、血肌酐(Scr)、白蛋白(Alb)、钙(Ca)、磷(P)、碱性磷酸酶(ALP)、全段甲状旁腺激素(iPTH)、高敏C反应蛋白(hs-CRP)、铁蛋白(Fer)等指标水平。
1.2.3 血清iFGF23检测: 抽取所有研究对象1周内第1次上机前的空腹静脉血,室温放置半小时,待血清析出后低温离心,取上层血清于-80 ℃冰箱冻存。采用夹心酶联免疫吸附法检测透析患者血清iFGF23水平,试剂盒购自安徽巧伊生物技术公司。将待测标本在常温下解冻30 min后严格按照试剂盒说明书要求进行测定。
1.2.4 肾性贫血的评估及分组: 依据《中国肾性贫血诊治临床实践指南》[8],将肾性贫血控制达标定义为Hb≥110 g/L。根据是否肾性贫血控制达标将所有患者分为达标组与未达标组。
1.3 统计学分析

2 结 果
2.1 MHD患者临床资料分析
本研究最终纳入138例MHD患者,其中男82例、女56例,中位透析时间为50.5个月,平均Hb水平为(105.0±19.0) g/L, 其中79例患者Hb≥110 g/L, 肾性贫血控制达标率为57.2%(79/138)。未达标组中,轻度贫血(Hb 90~<110 g/L)29例(49.2%), 中度贫血(Hb 60~<90 g/L)27例(占45.8%), 重度贫血(Hb<60 g/L)3例(占5.1%)。未达标组外周血RBC、WBC、HCT、Hb、Alb水平低于达标组,iFGF23水平、Ln(iFGF23)高于达标组,差异有统计学意义(P<0.05)。2组周EPO用量及Scr、UA、P水平比较,差异无统计学意义(P>0.05)。见表1。
表1 MHD患者一般资料及实验室指标比较 P75)]
2.2 MHD患者Hb水平与其他临床指标的相关性分析
相关性分析结果显示,全组MHD患者的Hb与HCT、WBC、血清Alb均呈正相关(P<0.05), 与SBP、Scr、Fer、Ln(iFGF23)均呈负相关(P<0.05), 见表2、图1。按照肾性贫血控制情况分组情况进一步行相关性分析发现,未达标组MHD患者的Hb仍与Ln(iFGF23)呈负相关(r=-0.266,P<0.05)。
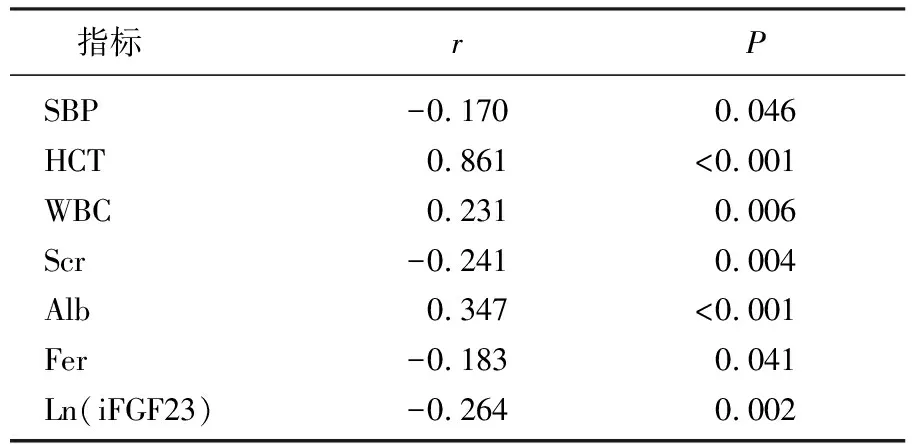
表2 全组MHD患者Hb水平与其他临床指标的相关性分析
2.3 MHD患者Hb水平的影响因素分析
散点图矩阵结果显示, Hb与Ln(SBP)、WBC、Alb、Scr、Fer、Ln(iFGF23)存在较强的线性趋势。将这些因素纳入多重线性回归分析,回归模型具有显著性(P<0.001); 共线性诊断提示,自变量之间不存在较强的线性相关关系(方差膨胀因子均<5)。Alb与Hb呈正相关(P<0.001), 标准化偏回归系数为0.377; Ln(iFGF23)与Hb呈负相关(P=0.027), 标准化偏回归系数为-0.218; Scr与Hb呈负相关(P=0.029), 标准化偏回归系数为-0.222。见表3。行德宾-沃森检验,德宾-沃森统计量为2.372, 提示残差独立。绘制标准化预测值与标准化残差的散点图,标准化残差的波动范围基本保持稳定,残差具有方差齐性。
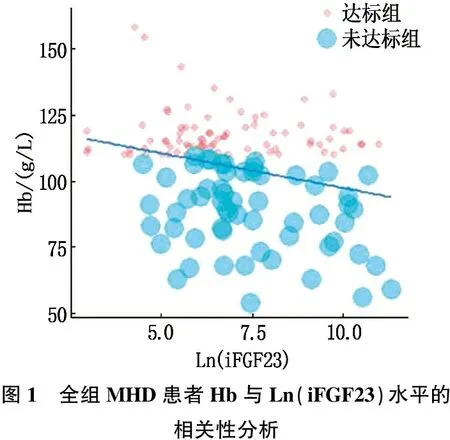
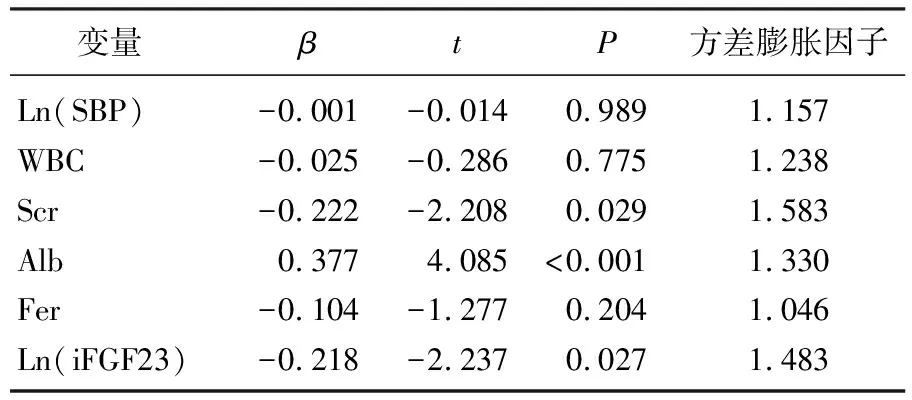
表3 MHD患者Hb水平的影响因素分析
3 讨 论
肾性贫血是严重影响ESRD患者心血管事件发生及预后的最常见并发症,受到人们的高度关注。本研究中,肾性贫血控制达标率为57.2%。未达标患者中,重度贫血(Hb<60 g/L)3例,占5.1%。本研究发现, Hb与HCT、WBC、Alb呈正相关,与SBP、Scr、Fer、Ln(iFGF23)呈负相关; 多重线性回归分析显示,低Alb、高Scr、高Ln (iFGF23)是肾性贫血发生的独立预测因子。
FGF23是一种重要的调节P代谢和维生素D水平的成纤维细胞生长因子(FGF)家族成员,其作用超出了维持矿物质代谢稳态的范围,例如FGF23可通过激活心肌细胞FGF受体4诱导左室肥厚[9]。FGF23可分为iFGF23和从179位精氨酸与180位丝氨酸间被切割产生的cFGF23[5]。CKD和ESRD患者Ca、iPTH等水平异常均会使循环中FGF23水平升高[10-11], 且iFGF23裂解受到抑制,故iFGF23升高。本研究亦选择测定了MHD患者的iFGF23。
FGF23影响Hb的可能机制如下: 一方面,FGF23可通过影响EPO的产生、损害骨髓造血、促进红细胞凋亡等负性调控Hb; 敲除FGF23基因可促进红细胞生成,且不依赖于活性维生素D, 说明FGF23水平升高可能对造血系统有直接影响[4, 12]。另一方面, CKD患者多存在绝对缺铁或功能性铁缺乏,铁缺乏可刺激骨髓产生大量FGF23, 从而进入恶性循环。动物实验[13]结果也表明,铁缺乏小鼠的iFGF23水平显著升高。由于血清FGF23水平在CKD早期即开始升高,推测FGF23升高可能是CKD患者发生贫血的新机制。亦有研究[4]表明,抑制FGF23可改善肾性贫血。本研究证实了Ln (iFGF23)与MHD患者肾性贫血的发生风险有关,推测FGF23亦可能成为临床评估及干预肾性贫血的有效靶点。
一项针对53例CKD 3期、4期患者的横断面研究[14]显示, FGF23水平升高与Hb水平降低独立相关。另一项纳入3 869例CKD患者的前瞻性队列研究[15]显示,基线FGF23与肾性贫血发生风险独立相关。本研究也证实血清Ln (iFGF23)与Hb呈显著负相关,且高Ln (iFGF23)是患者发生肾性贫血的独立预测因子。血清Alb可反映MHD患者的整体健康状况,既往研究[16]显示,血清Alb与Hb呈正相关。导致低蛋白血症的营养不良、炎症等事件也可能通过抑制红细胞生成而引起贫血[17]。本研究亦发现,血清Alb与Hb呈正相关,且低血清Alb是患者发生肾性贫血的独立预测因子。本研究还发现,高Scr是患者发生肾性贫血的独立预测因子,这可能与高毒素水平破坏红细胞、骨髓抑制有关,亦有研究[18]指出贫血与中国中老年人肾功能下降相关。
本研究尚存在局限性: ① 本研究未纳入转铁蛋白饱和度(TSAT)、铁调素、EPO等肾性贫血相关指标,可能导致结果偏倚; ② 本研究为单中心小样本的横断面研究,不能提示iFGF23与肾性贫血的因果关系。2019年,首种低氧诱导因子-脯氨酸羟化酶抑制剂(HIF-PHI)作为治疗肾性贫血的新药在中国上市,其可促进EPO合成、改善铁代谢、直接刺激造血干细胞等[19], 采用HIF-PHI纠正贫血可能调节FGF23的生成。纠正肾性贫血的不同治疗方式会否影响血清FGF23水平,值得临床进一步探讨。

