国产与进口美罗培南治疗重症感染临床评价*
王 馨 ,朱欣杰 ,霍 炎 ,陈 燕 △,干 润 ,郭 澄
(1. 上海交通大学附属第六人民医院药剂科,上海 200233; 2. 上海健康医学院药学院,上海 201318)
2018 年12 月18 日发布的《关于印发加快落实仿制药供应保障及使用政策工作方案的通知》(国卫体改发〔2018〕53 号)[1]中明确,加强仿制药技术攻关,促进仿制药替代使用的重大任务。原研药注射用美罗培南(商品名美平,日本住友株式会社)于1999 年在注射用美罗培南(商品名倍能,深圳海滨制药有限公司)于2001 年在我国上市;对于仿制药倍能的研究不足,且作为评价仿制药上市的标准即生物等效性(BE)试验尚不能替代临床疗效等效性[2]。本研究中回顾性分析了2020 年4 月至2021 年1 月上海交通大学附属第六人民医院使用倍能或美平进行抗感染治疗及治疗药物监测(TDM)患者的临床资料,综合其感染指标、肝肾功能、血药浓度,以判断倍能与美平药代动力学/药效动力学(PK/PD)和临床疗效是否一致。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:年龄≥18 岁;临床医师判定需要使用美罗培南治疗;进行美罗培南血药浓度监测。本研究经医院医学伦理委员会批准,通过医院信息系统(HIS)进行数据挖掘,筛选回顾性临床研究。
排除标准:有碳青霉烯类抗菌药物过敏史;入组前使用其他碳青霉烯类抗菌药物。
脱落标准:使用美罗培南治疗天数不足4 d;仅测定峰浓度或谷浓度;出现严重不良反应;病历资料极不完整;个体差异太大,无同类对照。
病例选择与分组:选取上海交通大学附属第六人民医院药剂科2020 年4 月至2021 年1 月使用美罗培南治疗的重症患者39 例,按美罗培南生产厂家的不同分为进口美罗培南组(美平组,25 例)和国产美罗培南组(倍能组,14 例)。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表 1。

表1 两组患者一般资料比较Tab.1 Comparison of the patients′ general data between the two groups
1.2 方法
治疗方法:倍能组患者给予国产美罗培南(商品名倍能,深圳市海滨制药有限公司,国药准字H20010250,规格为每支0.5 g),美平组患者给予进口美罗培南(商品名美平,日本住友株式会社,国药准字J20140169,规格为每支 0.5 g),最高剂量均不超过 2.0 g,每 8 h 1 次。两组均予以维持血流动力学稳定、维持水电解质酸碱平衡、营养支持、保护脏器功能等基础治疗,治疗时间不短于4 d。
血药浓度测定:达稳态血药浓度后,于用药后3 h及再次用药前0.5 h 抽取患者输注对侧肢体静脉血5 mL,置含有乙二胺四乙酸(EDTA)的抗凝管中,于4 ℃冰箱保存,24 h 内送至检测室。采用高效液相色谱法[3]测定血药浓度,按碳青霉烯类计,得游离药物浓度高于最低抑菌浓度 ( MIC)时间占给药间隔时间百分比( f% T>MIC)[4]。
色谱条件:色谱柱采用 Thermo Syncronis C18柱(250 nm ×4.6 nm,5 μm);流动相为 0.01 mol/L KH2PO4(pH =7)- 乙腈(91 ∶9,V / V),等度洗脱;检测波长为296 nm;流速为 1.0 mL /min;进样量为 20 μL。
方法学考察:根据前期试验,得曲线下面积(Y)与血药浓度(X)之间的标准曲线 Y =1.765 3 X +2.108,R2= 0.999 1。该方法学的专属性、稳定性、精密度、准确度试验结果均符合样品检测要求,不定期进行质控检测,高、中、低3 个浓度的误差不超过±15%。
1.3 观察指标与疗效判定标准
感染指标及肝肾功能指标:采用酶联免疫吸附法检测血清 C 反应蛋白(CRP)、降钙素原(PCT)水平,以及患者体内的白细胞计数(WBC)及中性粒细胞百分比(NEUT% )。肝肾功能指标包括丙氨酸氨基转移酶(ALT)、天 门 冬 氨 酸 氨 基 转 移 酶 (AST)、总 胆 红 素(TBiL)、血清肌酐(SCr)。
临床疗效判定[5]:临床症状、体征、实验室检测指标和病原学检查均恢复正常,为治愈;病情明显好转,上述4 项指标中有1 项未完全恢复正常,为显效;病况有所好转但不明显,为有效;用药 72 h 后病情未改善或加重,需更换或合并使用其他药物治疗,为无效。总有效=治愈+显效+有效。
细菌学疗效[5]:治疗结束时病原菌消失,为细菌清除;病原菌无变化,为持续存在;病原菌转为其他菌株,为菌交替;一直未培养出病原菌为无法评估。
安全性:观察治疗期间患者的不良反应发生情况,包括肝肾损伤、血小板异常、皮疹、中枢不良反应等。
1.4 统计学处理
采用 SPSS 19.0 统计学软件和 Graphpad Prism 7.0软件进行分析。计数资料以率(%)表示,行 χ2检验;计量资料以表示,行方差分析或 t 检验。P< 0.05为差异有统计学意义。
2 结果
结果见表2 至表5 及图1。由图1 可知,美平组的血药峰、谷浓度的平均值均高于倍能组,经统计学检验,两组患者的血药峰、谷浓度无显著差异(P峰浓度=0.289,P谷浓度=0.888)。美平组患者平均治疗天数为 10.875 d,倍能组患者为11 d,经统计学检验,组间比较无显著差异(P = 0.856)。以 f% T>MIC大于 70% 为治疗靶值,初始给药剂量下美平组 PK/PD 达标24 例次(22 例患者),达标率为 88.00%,总有效率为 68.00%;倍能组PK /PD 达标 13 例次(13 例患者),达标率为 92.86% ,总有效率为71.43%。倍能组患者未见皮疹、肝功能损伤、肾功能损伤、血小板异常、中枢反应等不良反应发生,美平组血小板异常发生率为 8.00% (2 /25),组间比较无显著差异(P>0.05)。
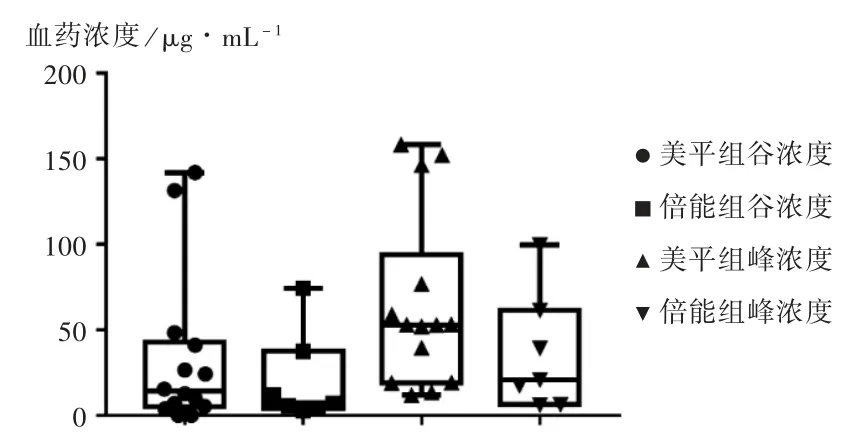
图1 每8 h 1 g 标准剂量下两组患者血药峰谷浓度比较Fig.1 Comparison of peak and valley concentration of blood drug between the two groups at the standard dose(1 g per 8 h)
表2 两组患者感染指标比较()Tab.2 Comparison of infection indexes between the two groups()

表2 两组患者感染指标比较()Tab.2 Comparison of infection indexes between the two groups()
组别CRP(μg/mL) PCT(μg/mL) WBC(×109/L) NEUT(%)P 值t 值治疗前103.0 ±75.5 114.4 ±94.0 P 值t 值t 值P 值t 值P 值倍能组(n =14)美平组(n =25)0.002 0.762 4.309 0.308治疗前16.9 ±8.8 48.1 ±48.0 13.507 3.306 0.000 0.003治疗前13.9 ±4.5 10.9 ±6.8 10.770 1.005 0.000 0.325治疗前82.7±8.6 81.2 ±6.6 2.212 2.170 0.047 0.040 t 值P治疗后77.3 ±76.3 102.0 ±94.8 0.472> 0.05治疗后9.9 ±9.7 10.8 ±10.7 0.331> 0.05治疗后10.7 ±5.3 9.8 ±4.6 0.290> 0.05治疗后70.0±21.9 76.1 ±11.3 0.315> 0.05
表3 两组患者肝肾功能指标比较()Tab.3 Comparison of liver and kidney function indexes between the two groups()

表3 两组患者肝肾功能指标比较()Tab.3 Comparison of liver and kidney function indexes between the two groups()
注:与美平组治疗后比较,*P > 0.05。Note:Compared with those in Meiping group after treatment,*P > 0.05.
ALT(U /L) AST(U /L) TBiL(μmol/L) SCr(μmol/L)组别P 值t 值治疗前51.3±39.3 43.6±16.9治疗后52.9±28.4*61.1±37.6 t 值P 值t 值P 值t 值P 值倍能组(n =14)美平组(n =25)-1.882 0.083 0.082 0.935治疗前47.4±15.3 46.4±28.3治疗后56.9±25.9*79.8±54.1-1.711-0.329 0.111 0.746治疗前15.3±7.2 28.5±12.3治疗后15.0±9.7*25.6±20.1-1.290 0.005 0.221 0.996治疗前87.1±45.2 193.0±168.3治疗后94.1±68.4*117.7±98.0-1.139-1.477 0.279 0.401
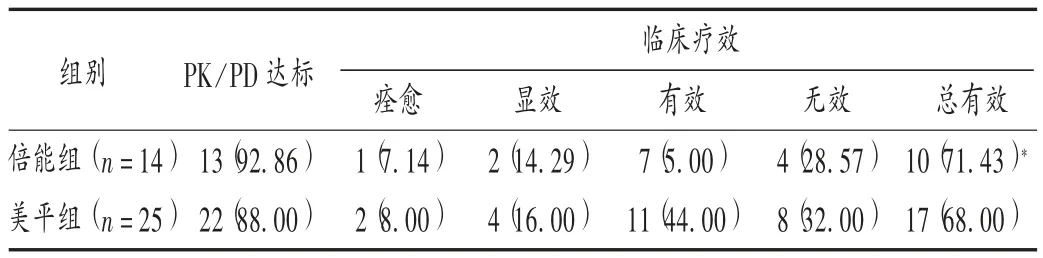
表4 两组患者PK/PD 达标和临床疗效比较[例(%)]Tab.4 Comparison of standard reaching of PK /PD and clinical efficacy between the two groups[case(%)]

表5 两组患者细菌学疗效比较[例(%)]Tab.5 Comparison of bacteriological efficacy between the two groups[case(%)]
3 讨论
本研究中选取了我院2020 年4 月至2021 年1 月使用美罗培南的患者39 例,在药师不干预的情况下,倍能和美平的初始剂量均由临床医师决定。
倍能组患者治疗后 WBC,CRP,NEUT% ,PCT 水平均显著下降(P< 0.05),美平组患者治疗前后的WBC与CRP 无显著差异,但并不能说明治疗一定无效。查询美平组患者的病历资料,并结合临床症状,发现17例患者病情好转。分析原因,可能是白细胞介导的炎性反应不仅由细菌感染引起,应激状态下也会引起白细胞水平升高。且本研究中患者大多为重症监护病房(ICU)患者均经历外科手术,术后处于应激状态,可导致CRP水平升高。同时,CRP 受多种因素影响,当心脏损伤时CRP 水平会升高。故WBC 和CRP 在诊断感染时的特异性不高,只能作为辅助参考。
由细菌清除率、治疗天数和治疗结果可见,两组患者的细菌清除率较现有文献[6]报道结果均偏低。可能是因为本研究中患者多为ICU 患者,病情危重,免疫功能低下,接受手术或机械通气等侵入性操作更多,住院时间更长,且ICU 环境相对封闭,适宜的温湿度都为病原菌生长繁殖提供了有利条件,多种高危因素同时存在,是耐药菌的聚集地,部分细菌已定植于患者体内,无法清除[7]。美平组和倍能组患者的平均治疗天数比较无显著差异(P>0.05)。
两组患者在使用每8 h 1 g 标准剂量时的血药峰、谷浓度并无显著差异,但美平组的血药峰、谷浓度均略高于倍能组,这可能由制剂或药物溶剂导致。有研究表明,原研药美罗培南较仿制药美罗培南在体内对肾脱氢肽酶更稳定[8];另外,溶剂不同的pH 可能会影响药物在体内的解离平衡。同时,两组都出现了 f% T>MIC大于70%,但实际治疗无效的结果。这可能是因为耐药菌的MIC 远超 16 μg/mL,体内分布不均,血药浓度并非感染部位的血药浓度。在不能准确测得感染靶部位血药浓度的情况下,需在到达抗菌阈值前,尽可能保持较高的谷浓度,应保证 f% T>MIC超过 70%[9],达到更好的治疗效果。但较高浓度可能引起中枢毒性、肾毒性、肝毒性、甚至感染艰难梭菌等问题,且文献[10-11]已证实美罗培南的肾毒性和神经毒性与血药浓度相关。因此,美平和倍能在提高血药浓度、达到理想疗效时要注意药品不良反应,应重视血药浓度监测的重要性。
两组患者治疗前后的肝肾功能指标比较无显著差异,安全性好。提示倍能与美平都未对患者的肝肾功能造成影响,但文献[12-13]均报道美平致患者出现严重肝功能损伤。美罗培南是一种经由肾脏代谢与排泄的药物,故应严密监测患者的肝肾功能。
综上所述,美平和倍能治疗重症感染的临床疗效及安全性比较均无显著差异。在相同平均治疗天数下,倍能价格远低于美平,为了减轻患者与医保的经济负担,临床医师应改变国产药不如进口药的观念,合理推广倍能的使用。

