NaAlO2包覆LiNi0.4Co0.2Mn0.4O2材料用于提高锂离子电池正极材料电化学性能*
桂娇康,张海朗
(江南大学 化学与材料工程学院,江苏 无锡 214122)
0 引 言
随着科技日益进步的发展,人们对于可便携式的电子设备如智能手机,笔记本电脑等的需求也越来越多,近年来,锂离子电池作为一种新型的可移动电子设备受到了越来越多的关注和应用。开发更高的能量密度以及优异的长循环性能的电池材料已经迫在眉睫。目前全球新能源汽车发展十分迅猛,最近国务院正式发布了文件,文件资料表明:新能源汽车新车销售总数要2025年末达到汽车的新车的销售总数的20%以上,与20年相比增长率将接近40%,且未来仍呈现上升趋势[1]。
1 实验部分
1.1 材料制备
LiNi0.4Co0.2Mn0.4O2电池活性材料主要由共沉淀法制得。先称取一定化学计量比为4∶2∶4的NiSO4·6H2O、CoSO4·4H2O、MnSO4·H2O溶于蒸馏水中形成1.0 mol/L溶液。以3 mol/L NaOH溶液为沉淀剂,2 mol/L NH3·H2O溶液为络合剂,以一定量去离子水为底液,于55 ℃的条件下加入反应釜中,同时将过渡金属盐溶液、NaOH溶液和NH3·H2O溶液缓慢泵入,并严格控制pH=11。将得到的沉淀物溶液静置并老化过夜。洗涤、过滤,将得到的LiNi0.4Co0.2-Mn0.4O2(OH)2前驱体在120℃的干燥箱中干燥一天以便去除前驱体中的水分。将制得的前驱体与Li2CO3按照1∶0.54(Li过量8%)的摩尔比准确称取,在玛瑙研钵中充分混合并研磨,在500 ℃、6 h条件下放入马弗炉中进行预烧结。预烧结后冷却取出并继续研磨,研磨后在850 ℃进行高温烧结12 h后自然冷却取出,得到LiNi0.4Co0.2Mn0.4O2活性正极材料,标记为LNCM-0。将制得的材料加入一定量的无水乙醇当中,在常温下先进行搅拌,另称取包覆量为0.5%,1.0%和1.5%(质量分数)的偏铝酸钠加入无水乙醇中在常温下进行搅拌1 h。将搅拌后的偏铝酸钠逐滴加入搅拌正极材料的烧杯中,并在80 ℃的水浴锅中蒸发溶剂。蒸发完毕后,将得到的材料在马弗炉中500 ℃下加热6 h。自然冷却后研磨得到NaAlO2包覆的正极材料,根据包覆量为0.5%,1.0%和1.5%(质量分数)将材料分别标记为LNCM-0.5,LNCM-1,LNCM-1.5和LNCM-1.5。
1.2 电化学测试
将LiNi0.4Co0.2Mn0.4O2正极活性材料、乙炔黑以及聚偏氟乙烯(PVDF)按照质量比为80∶12∶8研磨均匀好,并加入一定的N-甲基吡咯烷酮(NMP)制成浆料,随后涂覆在铝箔上;将制好的极片于真空干燥箱中80 ℃干燥72 h以上。随后将极片冲压成直径约为14 mm左右的电极片,采用不锈钢壳作为正负极电池壳 ,以锂片为负极,聚丙烯微孔膜为隔膜,用体积比为1∶1∶1的浓度为1 mol/L的LiPF/EC+DMC+EMC为电解液,以及用不锈钢材质的垫片和弹片,在充满高纯度氩气的手套箱中进行组装电池。将制备好的电池静置48 h以上,在电池测试系统上在0.1 C(1 C=160 mAh/g),3.0~4.6 V的条件下进行50圈的充放电测试。电池分别在0.1,0.2,0.5,1,2,5 C和最后返回到0.1 C下进行倍率测试。在电化学工作站上在2.5~4.6 V,100 μV扫描速率下进行循环伏安测试。
1.3 材料表征
X射线衍射仪(D8, 德国布鲁克)以Cu靶Ka射线源(λ=0.15406 nm),在衍射角为10~90°,扫描速率为4°/min设定条件进行X射线衍射分析(XRD)。用S-4800型扫描电子显微镜(SEM)观察材料的微观结构,用X射线能谱仪(EDS)(Noran System Six, 美国)检测元素的含量。采用电池测试系统(LandCT2001A,武汉金诺)对纽扣电池进行测试。在电化学工作站(IM6E,德国Zahenr)上进行循环伏安(CV)测试(2.5~4.6 V,扫描速率100 μV/S)和阻抗测试,频率范围是100 kHz~0.01 Hz,振幅大小为5 mV。
2 结果与讨论
2.1 NaAlO2包覆对材料形貌的影响
图1是不同NaAlO2包覆量的材料在5 000倍率下的SEM图。图1(a)—(d)分别表示包覆量为0%、0.5%、1%和1.5%(质量分数)的样品。可以清晰看出,包覆和未包覆的二次颗粒整体都是接近于球形,球形颗粒大约均在15 μm左右。图1(a)中材料颗粒表面比较光滑,有着较为清晰的轮廓和边界。当包覆量为0.5%(质量分数)(图1(b))时,材料表面整体仍显光滑,与未包覆样相比无明显区别,表面有些地方有一些细小颗粒,对比分析可得知这些是包覆上去的NaAlO2。包覆量为1%(质量分数)(图1(c))时,表面颗粒增多,光滑度也随之降低。当包覆量为1.5%(质量分数)(图1(d))时,材料表面逐渐模糊,小颗粒更多,说明包覆量过多,使得材料表面发生了一些变化。综合可看出包覆量为1%(质量分数)时材料形貌相对较好,包覆的也略微均匀。图2是包覆量为1%(质量分数)的材料的EDS图谱。
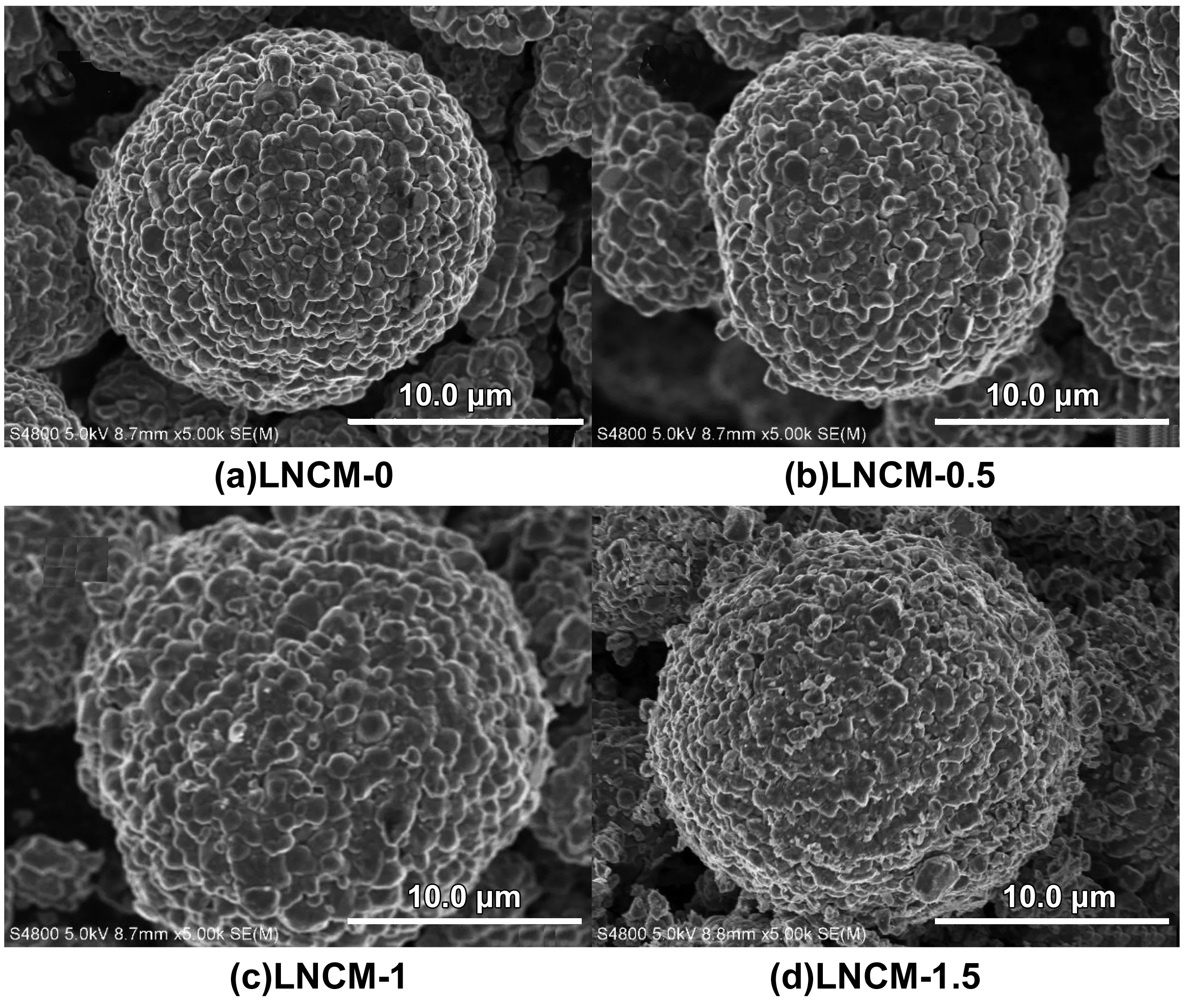
图1 不同包覆量的样品扫描电镜图像Fig 1 SEM images of samples with different coating amounts
从图2可见,O,Ni,Co,Mn元素的分布情况基本一致,说明材料元素分布均匀,并且通过谱线图2(g)中发现检测到了Na元素和Al元素,元素的分布也较均匀,综合结果SEM图和EDS谱图表明NaAlO2成功均匀的包覆在了正极活性材料上。

图2 LNCM-1内部横截面各元素的面扫描元素分布图及材料LNCM-1的EDS图谱Fig 2 Surface scanning element distribution of each element in the internal cross section of LNCM-1 and EDS spectrum of the material LNCM-1
2.2 NaAlO2包覆对材料结构的影响
图3是活性材料经过不同量NaAlO2包覆过的XRD图谱。由图可知,所有的样品图谱峰形整体一致,未发现明显杂峰,有着和α-NaFeO2一致的典型层状结构[22],表明经过NaAlO2包覆后不会影响材料的层状结构。XRD图谱中006/102这对峰以及108/110这对峰的劈裂程度可以反应层状结构的有序性[23-24]。由图可以看出,所有材料这俩对峰劈裂程度均较明显,且包覆过的材料峰的劈裂程度愈加明显。包覆量为1%(质量分数)材料的XRD图谱中劈裂的更加明显,峰形也比较尖锐,强度也较大,表明经过NaAlO2包覆后,材料结构的有序性增加,有利于材料的结构稳定性。

图3 不同包覆量样品的XRD图谱Fig 3 XRD patterns of samples with different coating quantities
表1是不同包覆量的材料的晶胞参数。I(003)/I(104)峰的比值与阳离子混乱度大小有关[25- 26]。数值越大,混乱度越低,电化学性能通常会越好。由表中数据可知,所有材料的I(003)/I(104)数值均高于1.2,表明材料的混乱度较低,且观察到包覆量从0到1%,I(003)/I(104)数值在增大,包覆量在1.5%时数值略有下降,充分说明适当的NaAlO2包覆可以有效地降低材料的离子混乱度,不会使过多的过渡金属离子占据了锂的位置从而影响锂离子在充放电过程中的扩散。 晶胞参数c/a的值也能突出材料的层状特性[27],通常比值越高,材料层状性能越好。由表中给出的数据可以看出,LNCM-1的c/a值最高,为4.970。衍射峰(006)峰和(102)峰的强度之和与(101)峰的强度之比定义为R因子[28],材料的层状结构越有序,R的数值则越小。结果表明LNCM-1.0的R值最小,为0.448,而原始样品的R值为0.556。综合以上数据来看,LiNi0.4Co0.2Mn0.4O2材料经1%(质量分数)的NaAlO2包覆后有着比较好的层状结构特性,可以推测材料的电化学性能会有所提升,这在后面会得到证实。
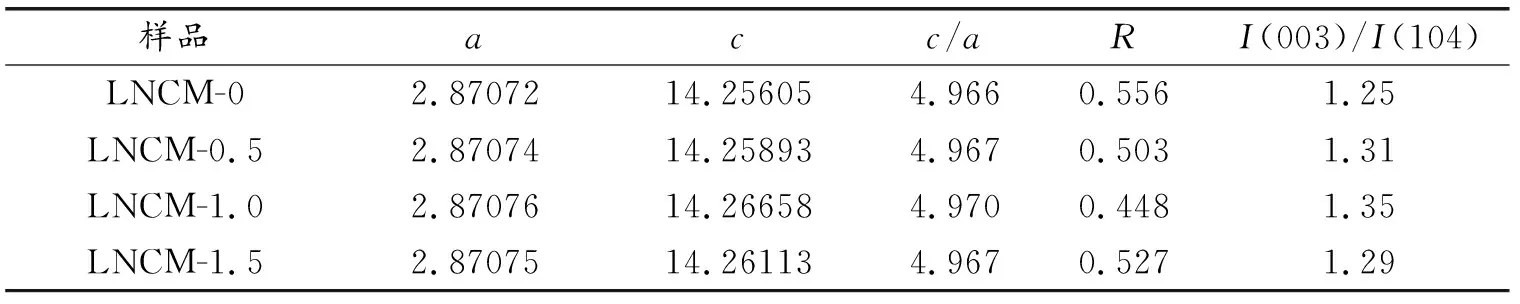
表1 不同材料的晶胞参数Table 1 Cell parameters of different materials
2.3 NaAlO2包覆材料电化学性能的影响
为表明NaAlO2包覆前后对LiNi0.4Co0.2Mn0.4O2材料电化学性能的影响结果,对不同包覆量的材料进行了相关电化学测试。图4是LNCM-0 、LNCM-0.5、LNCM-1和LNCM-1.5在0.1C,3.0~4.6 V条件下的首圈以及第50圈充放电曲线图。由图可得知,包覆前与包覆后的材料的首圈充放电图形整体趋势一致, 放电平台基本维持在3.8 V左右。表明偏铝酸钠包覆后不会影响材料的整体充放电行为。LNCM-0 、LNCM-0.5、LNCM-1和LNCM-1.5各自的充放电分别为215.26和182.3 mAh/g,216和183.5 mAh/g,216.5和184.3 mAh/g,215和179.6 mAh/g,对应首圈库伦效率分别为84.68%,84.81%,85.12%和83.53%。从图中数据可知,NaAlO2含量逐渐增加时,材料的首圈库伦效率有所增加,并比较分析出包覆量为1%(质量分数)时,首圈库伦效率达到最大,原因可能是适量的NaAlO2包覆在材料表面上可以抑制电解液在较高电压自身发生的氧化分解。经过50圈的循环后,所有样品的循环曲线如图5(b)所示。可见在经过50圈的循环后,包覆量为1%(质量分数)的样品仍保持着较高的放电容量,为167.6 mAh/g,容量损失最小(18.9 mAh/g)。而原样只有152.2 mAh/g,所损失的容量为所有样品中最大(29.3 mAh/g)。
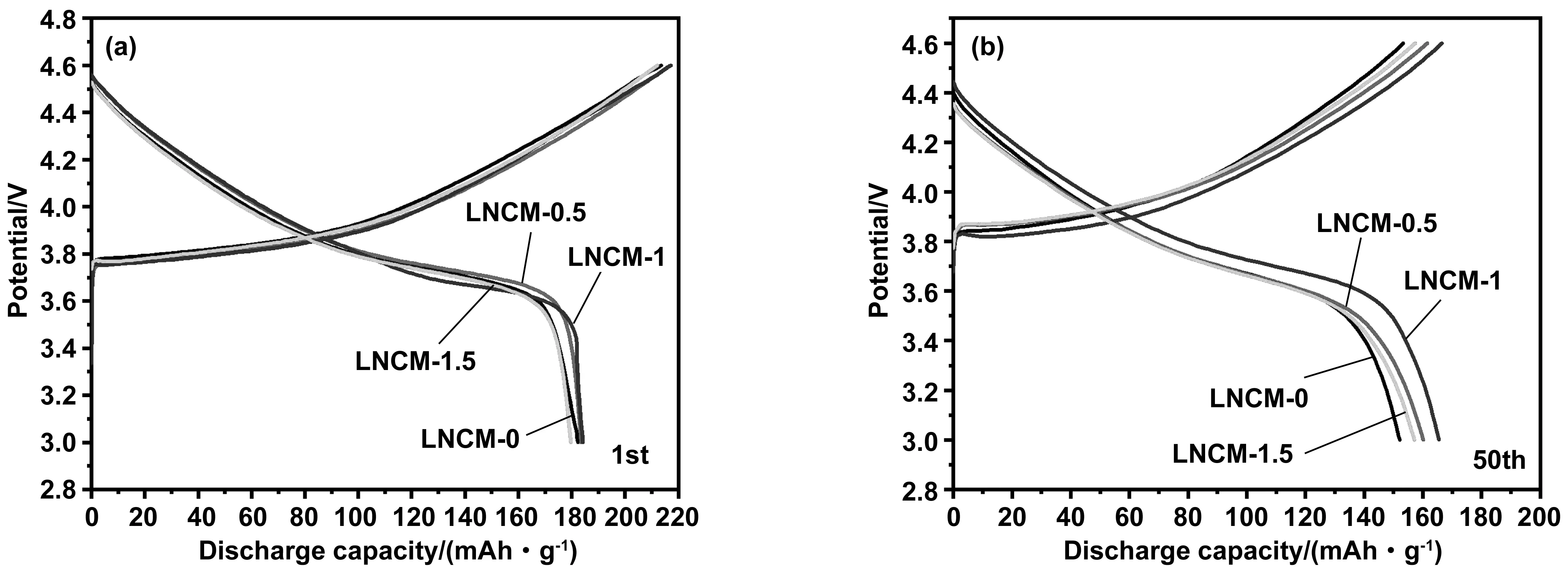
图4 不同NaAlO2包覆量的材料的首圈及第50圈充放电曲线图Fig 4 Charge-discharge curves of the first and 50th turns of materials with different NaAlO2 coating amounts
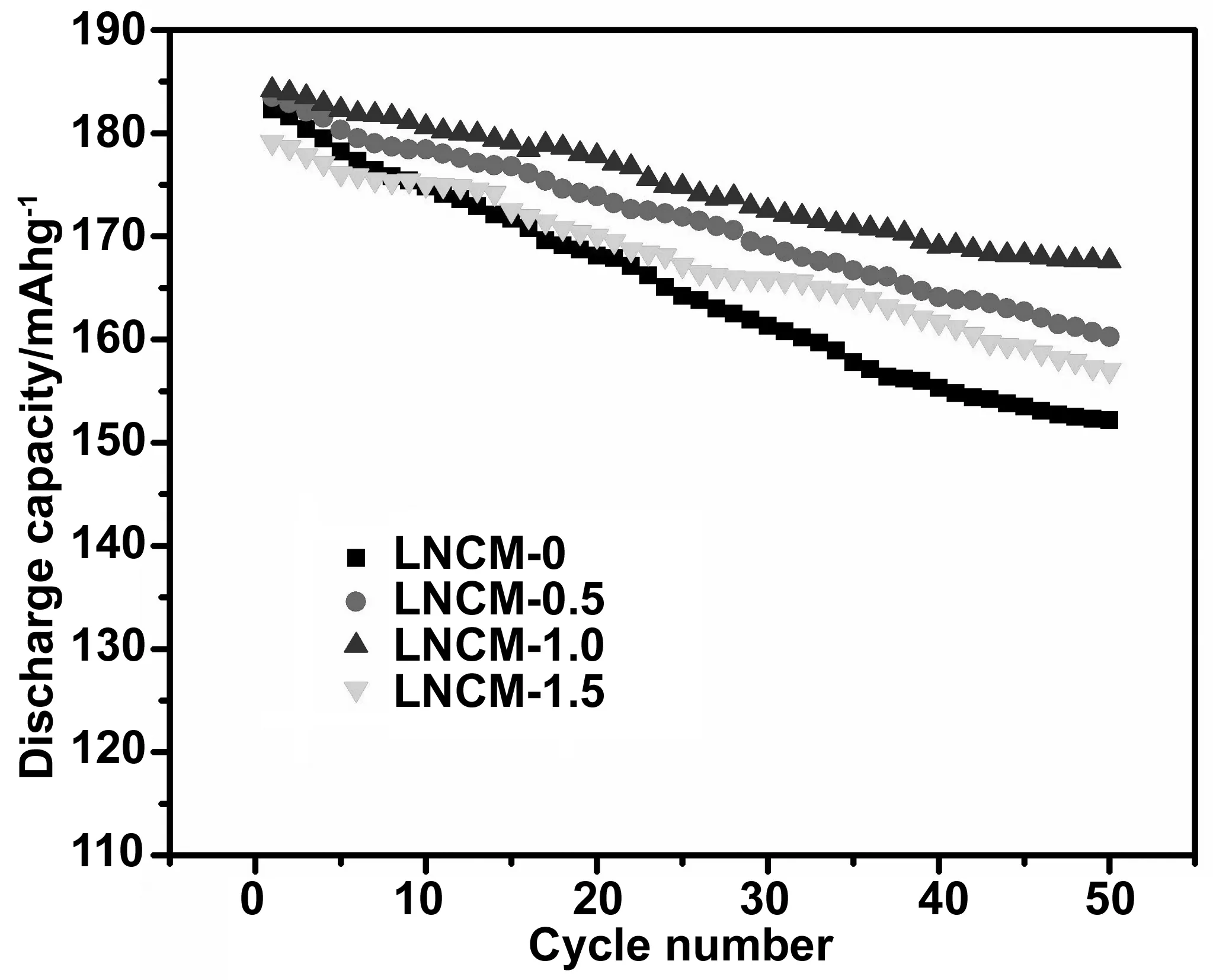
图5 不同材料在0.1 C下的循环性能曲线Fig 5 Cyclic performance curves of different materials at 0.1 C

图6 不同材料的倍率性能曲线Fig 6 Multiplier performance curves of different materials
图5是各个不同包覆量材料在0.1C,充放电电压3.0~4.6 V的条件下的循环曲线。由图可以看出,未经包覆的材料在经过50圈的循环之后,容量有着明显的下降,由最初的182.3 mAh/g下降到152.17 mAh/g,容量保持率只有83.47%。LNCM-0.5、LNCM-1、LNCM-1.5的初始容量分别为183.5、184.2和179.1 mAh/g,经过50圈的循环之后,各容量也均有一定的下降,分别为160.28、167.61和157.03 mAh/g,容量保持率分别为88.9%、90.99%和87.68%。经过包覆后的材料容量保持率有着较明显的提升,且随着包覆量的增加,容量保持率也在增加。这是因为在电池充放电的过程中,电解液会发生副反应产生HF[29],HF与活性材料发生氧化还原反应,造成活性材料的损失,并且电解质也会有一定程度的分解,使得材料的循环性能大大下降。而在活性材料表面包覆一层NaAlO2后会使得电解液与活性材料两者之间的接触面积有所减小,降低HF侵蚀正极材料的程度,从而减少了副反应的发生,使得材料在循环性能上有较大提升。材料从包覆量0.5%增加到1%(质量分数),保持率在上升,最高为90.49%,说明NaAlO2作为包覆层可以有效地提升材料的电化学性能,但NaAlO2量过多时,可以看出材料的循环性会有一定的降低,表明过多的NaAlO2反而会抑制活性材料中锂的插入和嵌出,使得循环性能有所降低。综上可知,NaAlO2包覆量为1%(质量分数)的LiNi0.4Co0.2-Mn0.4O2有着最佳的循环性能。图(6)是NaAlO2不同包覆量的材料在充放电电压为3.0~4.6 V,分别在0.1、0.2、0.5、1、2、5和0.1C不同倍率下各自循环5圈的充放电曲线图。由图可知,包覆前的样品在不同倍率下衰减较快,且随着倍率的不断放大,包覆前与包覆后的容量差距也愈发明显,其中高倍率下包覆量在1%(质量分数)时与包覆前的样品容量区别最为明显。随着包覆量的增加,不同倍率下容量减少的程度越小。但包覆量过高(在1.5%(质量分数)时),放电初始比容量反而比包覆量为0%时要低,当倍率为0.5C时,LNCM-1.5的放电比容量最后超过了LNCM-0。经过0.1,0.2.0.5,1,2和5C不同倍率下循环后,最后又在0.1C倍率下进行了5圈的循环,LNCM-0 、LNCM-0.5、LNCM-1和LNCM-1.5的容量保持率分别为87.40%、93.50%、94.36%和92.64%。表明NaAlO2包覆LiNi0.4Co0.2-Mn0.4O2材料对其电化学性能上有着很大的提升,不仅体现在高比容量上,在不同倍率的循环性能上更是如此。这主要得益于适当的NaAlO2能够形成很好的包覆层[30-31]抑制了电池在循环的过程中活性材料与电解液发生的副反应,提升了材料的倍率性能。
图7是不同样品的充放电第二圈的循环伏安(CV)曲线图。从图中可以看出,不同包覆量的材料的CV曲线整体一致,随着包覆量的增加(从0~1%(质量分数)),峰形逐渐尖锐,其中包覆量1%(质量分数)的样品的峰形最佳,表明经过NaAlO2包覆后材料的结晶度有所提升。与纯样相比较,LNCM-1的氧化峰左移,还原峰在右移,氧化还原峰数值分别为3.934和3.643 V,ΔV=0.291 V,而LNCM-0分别为3.975和3.602 V,ΔV=0.373 V,LNCM-0.5和LNCM-1.5的ΔV分别为0.368和0.377 V。比较分析可知,LNCM-1的电位差最小[32],表明经NaAlO2包覆后材料极化减小,材料的可逆性有所提高,这在前面材料的循环曲线图已经得到验证,且LNCM-1的氧化峰面积也大于其他材料,表明LNCM-1相比较原样,放电容量有所增加。

图7 不同NaAlO2包覆量的LiNi0.4Co0.2Mn0.4O2的CV曲线图Fig 7 CV curves of LiNi0.4Co0.2Mn0.4O2 with different NaAlO2 coating amount
为了进一步研究在循环过程中包覆过后的材料其表面对阻抗的大小,计算了包覆前后电阻的大小和锂离子的扩散系数,对LNCM-0以及LNCM-1样品在0.1C下循环的第3圈和第50圈进行了交流阻抗测试(EIS)如图8的(a)和(c)所示,并计算了阻抗实部与ω-1/2的关系,如图8的(b)和(d)所示。锂离子扩散系数相关计算公式如下:
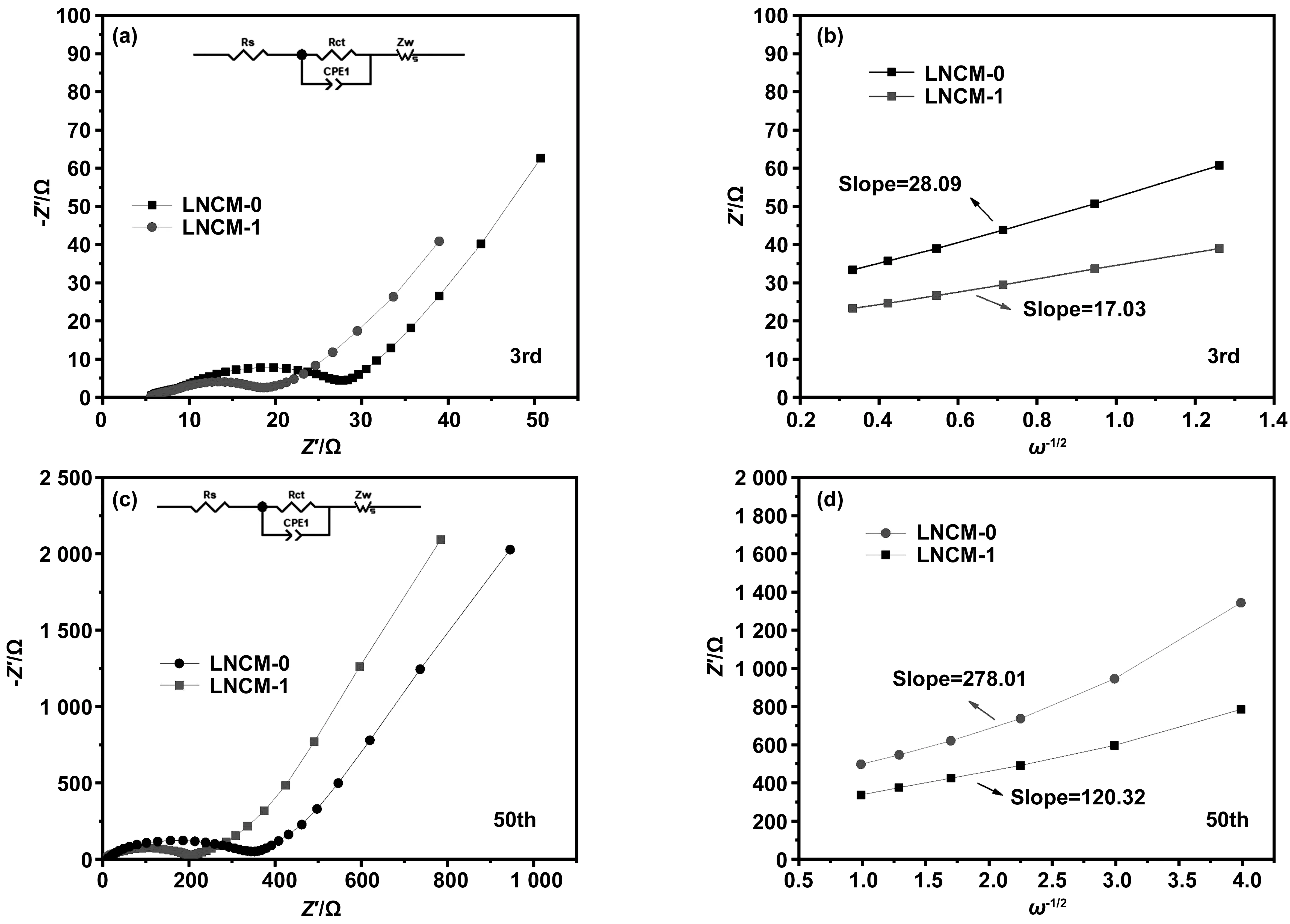
图8 LNCM-0和LNCM-1材料在0.1 C下2.5~4.6 V电压范围内循环第3圈和第50圈的电化学阻抗谱图Fig 8 Electrochemical impedance spectroscopy (EIS) of lncm-0 and LNCM-1 materials in cycle 3 and cycle 50 in the voltage range of 2.5-4.6 V at 0.1 C
DLi+=0.5(RT/An2F2Cσ)2
Z′=Rsei+Rct+σω-1/2
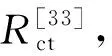

表2 LNCM-0 和LNCM-1样品在第3圈和第50圈循环下相关阻抗大小以及锂离子扩散系数Table 2 Relative impedance magnitude and lithium ion diffusion coefficient of LNCM-0 andLNCM-1 samples in the 3rd and 50th cycles
3 结 论
(1)通过共沉淀法制得Ni0.4Co0.2Mn0.4(OH)2前驱体,并用Li2CO3作为锂源煅烧合成LiNi0.4Co0.2Mn0.4-O2,用NaAlO2成功包覆了LiNi0.4Co0.2Mn0.4O2。经过电化学表征,经过比较分析,包覆量为1%(质量分数)的LiNi0.4Co0.2Mn0.4O2展现了最佳的优异性能。
(2)在经过50圈0.1C,3.0~4.6 V的充放电后,LNCM-1材料的放电容量仍有167.6 mAh/g,容量保持率为90.49%,而原样只有152.7 mAh/g,保持率只有84.4%,且LNCM-1材料的倍率性能也要优于原始样品。主要原因是NaAlO2在活性材料的表面形成了一层薄薄的包覆层,有效地阻止了材料的与电解液发生的副反应,减少了电池极化,使在充放电过程中降低了电池的欧姆阻抗增加的速度,增大了锂离子的扩散系数。
(3)NaAlO2作为一种快离子导体,在电池充放电过程中,有利于锂离子的脱出和嵌入,增加了LiNi0.4-Co0.2Mn0.4O2材料的循环性能和倍率性能,此结果还可以应用于其他电池正极材料进行相关的研究。

