CdTe和CdTe/CdS量子点与叶酸分子荧光相互作用
李光旻,刘淏洋,杨 洋,刘洪飞*,费学宁,刘 伟
(1.天津城建大学 理学院,天津 300384; 2.中企众鑫(天津)工业设计有限公司,天津 300384)
1 引 言
Ⅱ-Ⅳ主族核壳结构无机量子点(QDs)由于其高量子产率、优异的光稳定性等特点,已广泛应用于生物标志物、荧光成像等领域[1]。Finn等发现CdSe量子点通过包覆CdS壳层结构可以有效地提高发光强度,同时量子点的光致发光量子产率随CdS壳层厚度的增加而增大[2]。Cheng等[3]通过ZnS壳层的覆盖,提高了CuInS2量子点的发光效率。Zhang等发现水溶性CdTe/CdSe/ZnS量子点的光致发光量子产率高达84%,是制备的发光半导体纳米晶的最佳结果之一[4]。Fadi等发现具有核/壳/壳结构的CdTe/CdS/ZnO的光致发光产率是ZnO量子点的3倍[5]。
叶酸是一种水溶性B族维生素,是机体细胞生长和繁殖所必需的物质。最近研究表明叶酸可以作为一种荧光猝灭剂,应用在生物传感、生物识别等方面,具有巨大的潜力和前景。Li等研究了叶酸对掺杂Mn2+的ZnS量子点磁性纳米复合材料的猝灭效应,发现纳米复合材料与叶酸之间的电子转移可能是导致这种猝灭的原因[6]。Chakravarty等[7]观察到叶酸与PVA色氨酸CdTe量子点(PTQ)之间通过电子或能量转移发生荧光猝灭。用FA-NHS进一步处理GSH修饰的ITO,其荧光强度明显降低,这与叶酸的猝灭作用相对应,Jiang等在溶液中观察到叶酸对CdTe纳米粒子的荧光猝灭作用[8]。
很多研究主要集中在量子点与叶酸分子发生耦合作用引起荧光猝灭方面,而不同量子点结构对叶酸荧光猝灭的影响研究较少。本文讨论了CdTe和CdTe/CdS核壳结构量子点与叶酸分子的荧光相互作用,重点分析了叶酸分子对CdTe和CdTe/CdS核壳量子点的荧光猝灭作用及其机理。
2 实 验
2.1 样品制备
2.1.1 CdTe QDs制备
在氮气环境下,向三颈烧瓶中加入0.06 g碲粉(Te)和0.06 g硼氢化钠(NaBH4)。然后,在室温下加热溶液并在40 ℃下水浴加热并用磁力搅拌30 min以形成紫色NaHTe前体溶液。然后加入0.2 g氯化镉(CdCl2)和0.3 g半胱氨酸(Cysteine,C3H7NO2S),在磁力搅拌过程中溶解于45 mL去离子水中,之后滴加NaOH调节pH值至10,再加热回流至100 ℃,将溶液和NaHTe前体注入三颈烧瓶中2 h后得到酒红色Cys-CdTe QDs溶液。
2.1.2 CdTe/CdS QDs制备
CdTe回流2 h后,将溶液冷却至60 ℃。同时,分别称量0.24 g的硫化钠(Na2S)和0.22 g的氯化镉(CdCl2),超声溶解于5 mL去离子水中,将制备好的Na2S和CdCl2溶液缓慢加入CdTe溶液中,80 ℃加热回流 1 h,得到Cys-CdTe/CdS-QDs溶液。
2.2 实验方法
取数支试管,将配置好的浓度为0.05 mol/L的Cys-CdTe量子点溶液在298,304,311 K的温度下保温,并在溶液中滴加浓度为0.98×10-5~6.89×10-5mol/L 的叶酸分子溶液,摇匀混合。所有实验均采用对照实验。
2.3 样品表征
采用RF-5301PC荧光分光光度计对材料进行荧光光谱分析(SHIMADZU,Japan),采用Nicolet iS5光谱仪(Thermo Electron Corporation)进行FT-IR光谱分析,采用HITACHI U-3010分光光度计进行紫外-可见吸收光谱测试。材料晶面结构采用BDX330X射线衍射仪测量,表面结构利用日立H-600透射电子显微镜进行成像。
3 结果与讨论
3.1 Cys-CdTe和 Cys-CdTe/CdS 量子点材料表征
Cys-CdTe/CdS量子点的XRD如图1(a)所示。立方结构Cys-CdTe量子点的XRD图谱(JCPDS 15-0770)中(111)、(220)和(311)3个主峰位置,在图中用红线表示,分别位于23.8°、39.6°和 46.8°。由图中可知,CdTe/CdS的XRD图示中3个主峰位置相对于CdTe量子点均向高角发生了移动,表明形成了CdTe/CdS核壳结构[5]。图1(b)比较了半胱氨酸分子和Cys-CdTe/CdS量子点的傅里叶变换红外光谱(FT-IR)。当半胱氨酸分子与CdTe/CdS量子点表面结合时,在2 500 cm-1(wvS-H)的信号消失,表明半胱氨酸分子的巯基与镉离子发生了键合。Cys-CdTe/CdS量子点3 400 cm-1处的宽吸收主要来自于CdTe/CdS量子点表面半胱氨酸羧基与氨基之间的氢键[9]。Cys-CdTe/CdS量子点的TEM图像如图1(c)所示。Cys-CdTe/CdS量子点晶格紧密堆积,其平均尺寸为3.9 nm;相邻晶面间的平面间距分别为0.37 nm和0.33 nm,与CdTe和CdS的d(111)值相匹配。Cys-CdTe/CdS量子点的吸收光谱如图1(d)所示,可以观察到以600 nm为中心的激子吸收峰对应于1.65 eV的禁带宽度。图1(d)中嵌入了CdTe量子点的紫外-可见吸收光谱。由图中可见,CdTe量子点的紫外吸收位置在590 nm附近,相比CdTe量子点,CdTe/CdS量子点的紫外吸收位置发生了一定程度的红移,也可以作为形成CdTe/CdS的证据。合成的Cys-CdTe/CdS量子点结构示意图如图2所示。
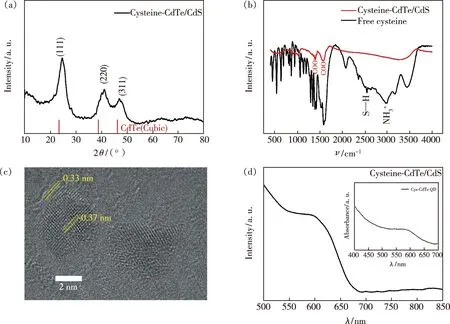
图1 Cys-CdTe/CdS量子点的X射线衍射图(a)、傅里叶变换红外光谱(b)、TEM图像(c)、紫外-可见光谱(d)。Fig.1 (a)X-ray diffraction pattern.(b)Fourier transform infrared spectra.(c)TEM image.(d)UV-Vis spectrum of Cys-CdTe/CdS QDs.
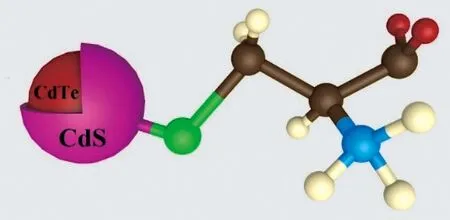
图2 Cys-CdTe/CdS量子点结构示意图(其中绿色为S元素,褐色为C元素,白色为H元素,蓝色为N元素,红色为 O元素)Fig.2 Structure diagram of Cys-CdTe/CdS QDs(in which green is element S,brown is element C,white is element H,blue is element N and red is element O)
3.2 荧光猝灭特性
不同浓度叶酸分子滴定CdTe量子点的荧光光谱如图3所示,上述测量在298 K下进行,激发波长为358 nm。由图3(a)所示,CdTe量子点荧光发射光谱峰位在620 nm,随着叶酸分子的滴定,CdTe量子点荧光强度降低。当叶酸分子的浓度达到6.89×10-5mol/L 时,荧光强度降低到了初始值的24%,表明叶酸分子对CdTe量子点有明显的荧光猝灭作用。此外,叶酸分子滴定会导致CdTe量子点荧光发射峰位发生约35 nm的蓝移(见图3(b))。这主要是由于猝灭剂与量子点之间形成的络合结构降低了局域环境的极性所致[10-12],具体机理解释见文章后续分析。
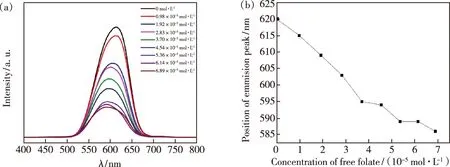
图3 不同浓度叶酸分子滴定CdTe量子点。(a)荧光光谱;(b)发射峰位置。Fig.3 Titration CdTe QDs with different concentrations of folate molecules.(a)Fluorescence spectra.(b)Emission peak position.
图4(a)为CdTe/CdS核壳结构量子点在滴定相同浓度叶酸分子时的荧光光谱。如图所示,CdTe/CdS核壳结构量子点荧光光谱发射主峰位于652 nm,相比CdTe量子点荧光光谱主峰红移了32 nm,这主要是由于CdS包壳结构所带来的量子点尺寸效应,同时也是CdTe/CdS核壳结构形成的另一个证明。如图4(b)所示,随着叶酸分子的浓度增加,CdTe/CdS量子点荧光发射峰的位置略有波动。以上结果表明,叶酸分子不会带来CdTe/CdS核壳结构量子点显著的荧光猝灭作用,同时也不会导致荧光光谱蓝移。
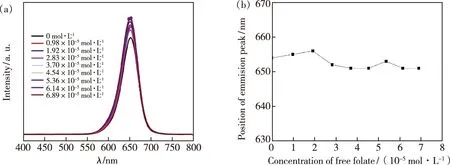
图4 不同浓度叶酸分子滴定CdTe/CdS量子点。(a)荧光光谱;(b)发射峰位置。Fig.4 Titration CdTe/CdS QDs with different concentrations of folate molecules.(a)Fluorescence spectra.(b)Emission peak position.
3.3 Stern-Volmer方程
为了进一步研究叶酸分子滴加引起不同结构量子点荧光猝灭特性的差异,我们采用Stern-Volmer方程进行计算,其形式如下[13]:
(1)
其中,F和F0分别是量子点在具有给定叶酸分子滴定浓度的溶液和没有叶酸滴定条件下溶液中的发光强度,KSV是动态猝灭常数,Kq是动态猝灭速率常数。动态猝灭的最大值约为2×1010L/(mol·s)。[C]为叶酸分子浓度;τ0是荧光的平均寿命,大约为1.9×10-9s。不同温度下叶酸分子对CdTe荧光猝灭的Stern-Volmer曲线如图5所示。结果表明,3种温度下的Stern-Volmer曲线均与叶酸分子滴定浓度和F0/F呈线性关系,且拟合直线的斜率随温度升高而减小,这正是静态荧光猝灭的特征。相关计算信息及参数见表1。
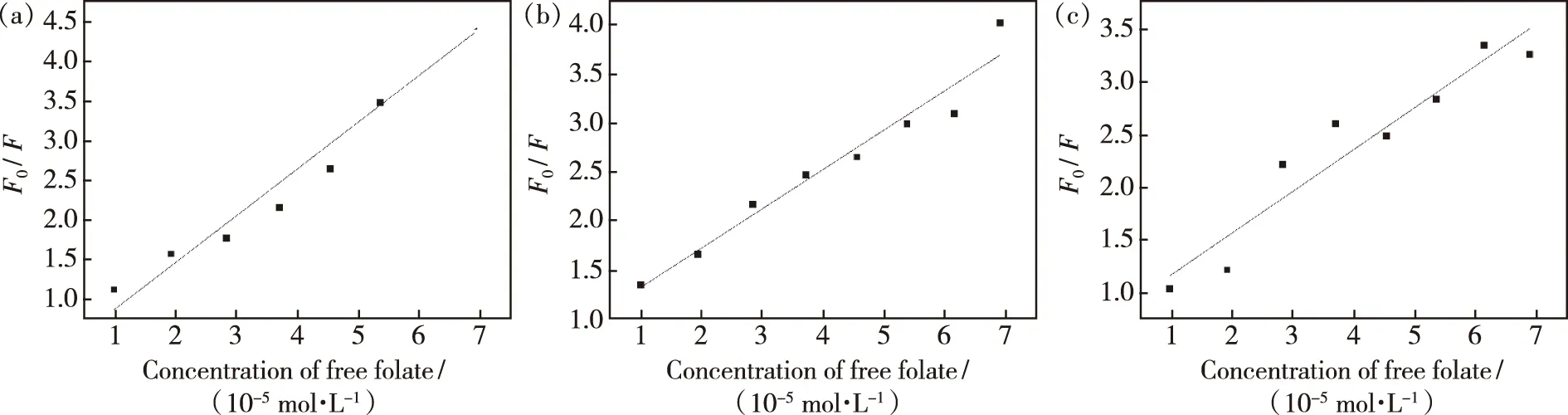
图5 不同温度下叶酸分子滴定CdTe量子点的Stern-Volmer曲线。(a)298 K;(b)304K;(c)311 K。Fig.5 Stern-Volmer curve of folate molecular titration CdTe QDs at different temperatures.(a)298 K.(b)304 K.(c)311 K.
由表1可知,当测试温度升高至311 K时,KSV从58 904 L/mol 减小至39 505 L/mol,这表明猝灭过程是以静态猝灭为主。更重要的是,在3种不同温度下Kq处在1012L/(mol·s)数量级,远大于动态猝灭常数的最大值2×1010L/(mol·s),进一步表明叶酸分子对CdTe量子点的荧光猝灭作用并非动态猝灭,而是静态猝灭。为了进一步验证叶酸分子对CdTe量子点带来的静态荧光猝灭作用,我们对加入叶酸分子前后的CdTe量子点溶液进行了荧光寿命测试。
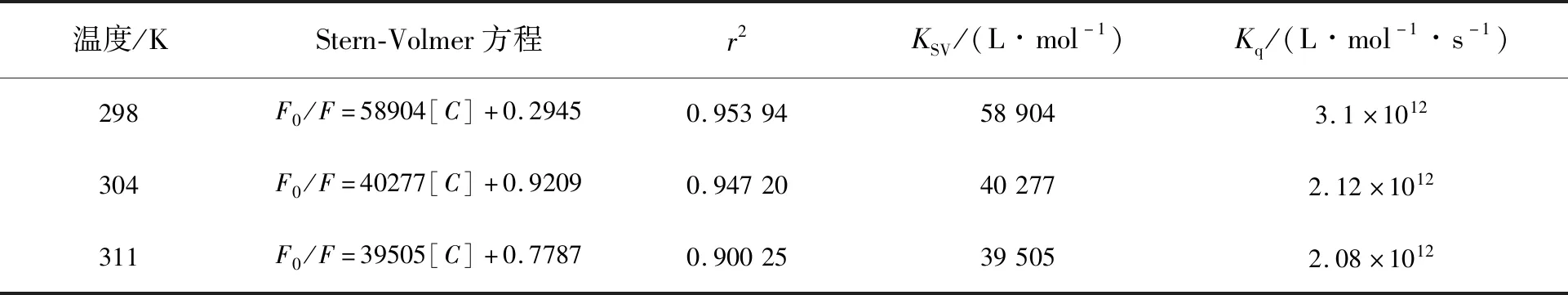
表1 不同温度下叶酸分子滴定CdTe量子点的Stern-Volmer方程及相关参数Tab.1 Stern-Volmer equation and related parameters of folate molecular titration of CdTe quantum dots at different temperatures
图6为CdTe量子点溶液加入叶酸分子前后的荧光寿命谱,荧光寿命测试采用375 nm激发光。如图所示,加入叶酸分子前后的CdTe量子点荧光寿命几乎保持不变,这再次表明叶酸分子对量子点的荧光猝灭属于静态猝灭[14-15]。为了研究静态猝灭下材料的耦合状态,我们对叶酸与Cys-CdTe量子点的结合常数和结合位点数目进行了分析,其中结合常数和结合位点数由双对数方程确定:
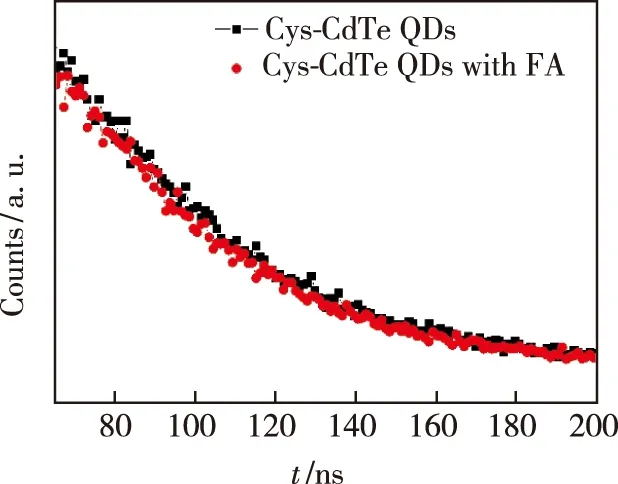
图6 加入叶酸分子前后Cys-CdTe量子点溶液的荧光寿命谱Fig.6 Fluorescence life of Cys-CdTe QDs and Cys-CdTe QDs with folate
(2)
其中Kb表示结合常数,n表示结合位点数,在298 K条件下的拟合曲线如图7所示。
由图7可知,在298 K下,lg[(F0-F)/F]与lg[C]成线性关系,结合Stern-Volmer方程,叶酸分子滴定CdTe量子点只会带来静态荧光猝灭,而并非静态猝灭和动态猝灭混合。根据叶酸-CdTe量子点体系在298 K时的双对数方程可知,结合位点数(n)约等于1.65,这表明叶酸分子与CdTe量子点的结合比率为1.65∶1,进一步验证了两者之间发生了强烈的耦合作用,进而产生了络合结构。为了验证络合结构的产生,我们对CdTe量子点加入叶酸之后的紫外-可见光谱进行了研究。
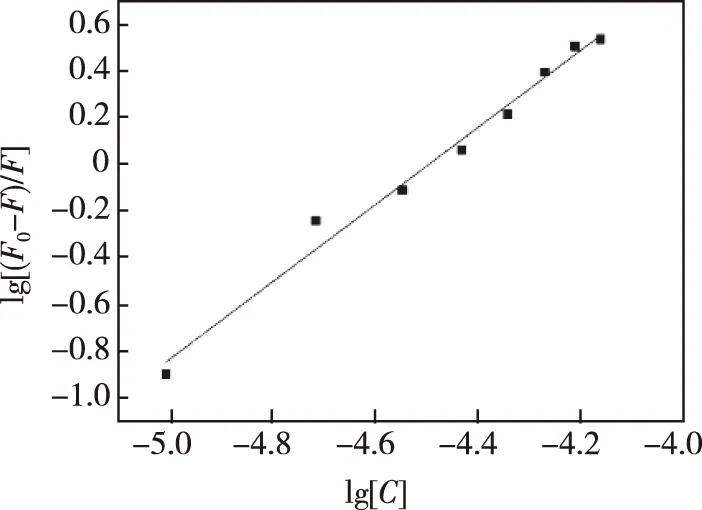
图7 lg[(F0-F)/F]-lg[C] FA-CdTe体系在298 K时的曲线Fig.7 Curve of lg[(F0-F)/F]-lg[C] of folate-CdTe system at 298 K
如图8所示,与CdTe量子点和叶酸分子紫外-可见光吸收光谱的数学叠加相比,CdTe量子点在加入叶酸分子之后,吸收光谱发生了变化,在232 nm附近紫外吸收增加,这表明在CdTe量子点和叶酸分子之间形成了非荧光络合结构[11]。
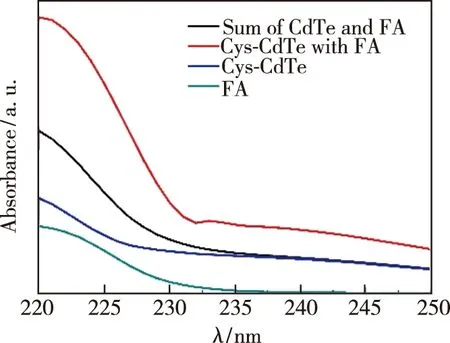
图8 Cys-CdTe量子点、叶酸、量子点加入叶酸后的紫外-可见光谱。Fig.8 UV-Vis spectra of Cys-CdTe QDs,folate,and Cys-CdTe QDs with folate.
3.4 机理分析
以上结果表明,叶酸分子给CdTe量子点带来的荧光猝灭是一种典型的静态荧光猝灭行为,而在CdTe/CdS核壳体系中,我们没有观察到叶酸分子对量子点引起的荧光猝灭现象。研究表明CdTe量子点中暴露在空气中的不饱和Te原子易被氧化[16],从而形成空穴陷阱。而在CdTe量子点表面包覆CdS壳层可以钝化CdTe量子点的表面缺陷,消除量子点表面的阴离子和阴离子悬挂键,抑制CdTe量子点的氧化[17],进而减弱叶酸分子与CdTe量子点表面的静电相互作用,抑制了荧光猝灭效应。叶酸分子滴定会导致CdTe量子点荧光光谱有明显的蓝移,说明荧光分子与猝灭剂之间存在静电相互作用,荧光分子与猝灭剂之间可能形成非发光基态络合结构。这种复合物导致局部环境的极性降低,通过减少非辐射跃迁缩短Stokes位移。为了验证我们的推测,进行了热力学计算:
(3)
ΔG=ΔH-TΔS,
(4)
其中,K是猝灭常数,H是焓变,S是熵变,R是普适气体常数,T是温度,G是吉布斯自由能变化。我们拟合了lnK与1/T的关系。最后计算了熵变(ΔH)和焓变(ΔS)分别为-27.75×103J·mol-1·K-1和11×103J·mol-1,根据计算结果,发现吉布斯自由能变化(ΔG)为-27.1×103J·mol-1。ΔG<0说明叶酸分子带来CdTe量子点的荧光猝灭是自发的。同时,焓变(ΔH)<0,熵变(ΔS)>0,说明叶酸分子与CdTe量子点的相互作用主要是静电作用[18]。叶酸分子含有两个羧基和一个氨基,因此叶酸分子与半胱氨酸诱导剂可能通过端层羧基与氨基间的静电作用进行偶联进而形成了络合结构,引起荧光光谱的蓝移。
4 结 论
本文在水相条件下合成了Cys-CdTe量子点和CdTe/CdS核壳量子点。叶酸分子会引起CdTe量子点荧光猝灭现象,经Stern-Volmer方程计算表明该猝灭作用是静态猝灭效应。实验研究表明CdTe量子点的荧光强度与叶酸分子的浓度有良好的线性关系,可用于制备叶酸浓度快速测定的荧光探针。CdS壳层结构可以有效削弱叶酸分子与CdTe量子点之间的静电相互作用,进而抑制荧光猝灭效应。研究也表明叶酸分子与CdTe量子点作用会带来荧光光谱峰位的蓝移,热力学计算表明叶酸分子与CdTe量子点之间通过静电作用形成了络合结构,导致基团的局部极性降低。本研究为进一步研究生物分子与量子点的相互作用提供了一定的帮助和启示。

