“主供血管先行”的双针联合射频消融治疗肝脏巨大血管瘤的效果观察
崔虎啸 侯森* 秦贯军 孙筱强 赵朋伟
肝血管瘤是一种常见的肝脏良性肿瘤,发病率为0.4%~20%[1]。大多数肝血管瘤的直径<5 cm,直径≥10 cm 者称之为肝脏巨大血管瘤[2],早期多无明显的临床症状,随着肿瘤增大则出现一系列消化道症状。肝血管瘤的治疗方法有多种,其中射频消融(radiofrequency ablation,RFA)具有创伤小、恢复快等优势,更易于被广大患者所接受。对于直径>10 cm 的肝脏巨大血管瘤,治疗时易出现残留,部分需要再次治疗,增加患者的痛苦。为了扩大消融面积,提高治疗效果,需要进行技术或技巧上的改进。通过回顾性分析肝脏巨大血管瘤射频消融治疗的病例资料,现分析总结经验如下。
1 资料与方法
1.1 临床资料 选取2012 年6 月至 2018 年6 月于本院行射频消融治疗的肝脏巨大血管瘤患者28 例。纳入标准:经上腹部增强CT 或增强MRI 等检查确诊为肝脏血管瘤;血管瘤直径≥10 cm,并伴有上腹部不适等临床症状,或虽无临床症状但持续复查发现血管瘤逐渐增大者及具有较大心理压力者,或虽无症状但血管瘤位于紧邻肝门部、胆囊旁、肝被膜下血管瘤等特殊部位;患者自愿选择彩超引导下经皮穿刺肝血管瘤射频消融术。其中,男8 例,女20 例;年龄25~64 岁,平均46.2 岁;共有28 个病灶,Ⅱ段2 个、Ⅳ段2 个、Ⅴ段4 个、Ⅵ段5 个、Ⅶ段7 个、Ⅷ段8 个;肿瘤直径10.0~15.2 cm,平均12.5 cm;18 例患者主诉有不同程度的上腹部不适,7 例患者处于不同程度的焦虑状态,3 例无症状。
1.2 仪器设备 射频消融治疗仪(LDRF-120s,绵阳立德电子有限公司),工作频率400 kHz;手术电极,单极冷循环射频消融电极针(型号:LDDJS3-0200300A,绵阳立德电子有限公司)。
1.3 治疗方法 采用全身麻醉,患者取平卧位或左侧30°卧位,对于血管瘤紧邻胃肠道、膈肌的患者建立人工腹水或胸水以隔离开周围脏器,再进行射频消融。彩超引导下,经右侧肋间隙或剑突下,将单极冷循环射频消融电极针经皮穿刺进入腹腔,经过部分正常肝组织再行穿刺至供应瘤体的肝动脉血管处,消融、阻断血供,再将射频针穿刺至瘤体深处边缘,之后再取第2 支射频针穿刺进入至瘤体对侧部分。超声监视下布针位置满意后,根据瘤体的直径设置消融时长,同时对两处穿刺部位进行消融治疗,然后分别逐步退针进行消融。对于较大的瘤体,需要更换另一个消融层面,进行交叉重叠消融。
1.4 观察指标 术后患者的生命体征、腹部体征、小便量及颜色变化;术后第3、7 天复查血常规及肝肾功能;术后第1、3、6、12 个月复查上腹部增强CT 或MRI 检查,了解病灶消融情况。
1.5 疗效评价 (1)患者一般情况:术中、术后的反应及并发症,上腹部症状改善情况;(2)疾病缓解率[3]:完全缓解(CR),指肿瘤完全坏死,并维持4 周以上;部分缓解(PR),指肿瘤坏死≥50%或病灶最大垂直两径乘积缩小≥50%,并维持4 周以上;增强CT 或增强MRI 检查显示病灶无强化即为肿瘤完全坏死。疾病缓解率=(CR+PR)/总例数×100%。
2 结果
28 例患者均顺利完成RFA 治疗。彩超引导下经皮RFA 共28 例,28 个肝巨大血管瘤病灶,平均治疗时间为61.9 min。其中,21 例患者在RFA 术后出现一过性发热,体温37.8 ℃~39.1 ℃;25 例患者术后出现ALT和AST 升高,ALT 68~422 U/L,AST 78~413 U/L;一过性肉眼可见血红蛋白尿19 例;无出血、胆漏、肾功能不全等并发症发生。所有患者术后均获得随访,随访时间12~36 个月,平均18 个月,期间无远期并发症发生。28 例患者中,病灶完全消失有22 例(79%),病灶缩小>50%共6 例(21%),无病灶缩小<50%的病例,亦无病灶缩小之后再复发者。经RFA 治疗,完全缓解22 例,部分缓解6 例,缓解率为100%。典型病例,见图1-3。
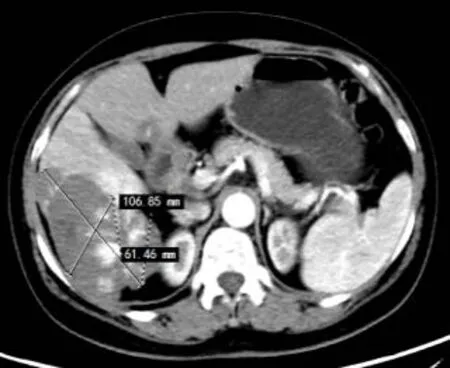
图1 射频消融前:肝血管瘤最大截面106.85 mm×61.64 mm

图2 射频消融后1个月复查:肝血管瘤发生凝固性坏死,消融后瘤体最大截面77.59 mm×49.07 mm
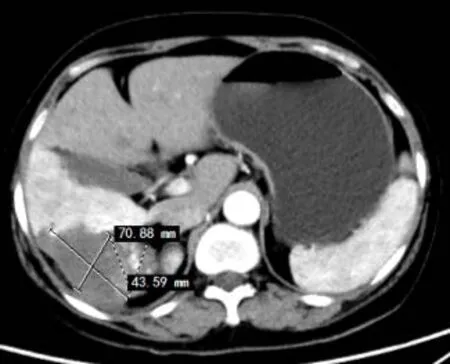
图3 射频消融后3个月复查:肝血管瘤发生凝固性坏死,消融后瘤体最大截面70.88 mm×43.59 mm
3 讨论
肝血管瘤多为单发,瘤体生长缓慢,症状多不明显,无恶变倾向,自发破裂者罕见[4],常见于成年女性。主要治疗方法包括肝移植术、肝部分切除术、肝血管瘤剥除术、微波或射频消融、肝动脉介入栓塞治疗等。首选为手术切除,但由于手术创伤和术中失血量较大,不易被患者所接受。腹腔镜下行肝部分切除具有住院时间短、切口美观及感染率低等优点,但对于肝巨大血管瘤,腹腔镜下切除难度较大,对术者的腔镜技术要求也较高,且瘤体血供丰富,稍有不慎即可能出现难以控制的出血,导致手术风险增加[5]。大多数肝脏巨大血管瘤有多支动脉供血,肝动脉介入栓塞一部分供血动脉后,其他血管可形成代偿,继续为瘤体供血,会影响疗效或复发,而若追求完全栓塞,则可能面临过度栓塞的风险,导致肝功能损害、胆管损伤等严重并发症,因此肝动脉介入栓塞仅作为辅助或备选治疗方法[6]。近年来,肝肿瘤的射频消融治疗在各级医院广泛开展,具有创伤小、恢复快、费用少、可重复性强等优势。目前,肝脏血管瘤应用RFA 治疗的手术指征尚存在争议,多数学者认为较小的、无症状的肝脏血管瘤不需进行治疗。崔彦等[7]认为,若肝脏血管瘤的直径≥10 cm,出现临床症状,随访期间发现增大趋势较为明显,或血管瘤位置较特殊,或见肿瘤多发,或与肝恶性肿瘤鉴别困难等情况,均应予以积极处理。笔者亦认为,对于直径≥10 cm 的肝脏巨大血管瘤,若其位于紧邻肝门部、重要管道旁、胆囊旁、肝被膜下等特殊位置,任由血管瘤继续生长将使得解剖关系更为复杂,或增加疾病风险,此种情况建议手术治疗,而对于心理负担较重的患者,建议应用RFA 等微创手段治疗。
RFA 治疗肝脏巨大血管瘤易出现残留,部分患者需再次治疗,反而增加患者痛苦。肝血管瘤是由许多扩张的大小不等的血窦组成,为肝动脉分支的畸形,血供全部来自肝动脉[8]。为了扩大消融面积和提高治疗效果,笔者所在治疗中心应用多针组合射频消融技术联合主供血管射频消融技术治疗肝脏巨大血管瘤,28 例患者均顺利完成治疗,无出血、胆瘘、周围脏器损伤等严重并发症发生。其中,21 例患者术后出现一过性发热,体温最高达39. 1 ℃,经对症处理逐步下降至正常;25 例患者的血清谷丙转氨酶、谷草转氨酶水平均有所升高,经过保肝、降酶治疗后逐步降至正常;19例患者出现不同程度的肉眼血尿,予以碱化尿液、大量补液后恢复正常。所有患者术后均获得随访,无任何远期并发症。经治疗完全缓解22 例,部分缓解6 例,缓解率为100%。经验总结如下:①在治疗过程中先消融肝血管瘤主供血管及其所在区域,阻断瘤体供血,降低“热沉效应”,可提高消融效率,同时减少血红蛋白的破坏,降低血红蛋白尿的程度及发生率;②考虑到保留肿瘤血供是肝血管瘤局部复发或生长的关键因素,术中先行消融破坏血管瘤供血血管,使瘤体失去血供,即使有病灶残留,瘤体通常也会逐渐缩小或保持稳定;③双针联合射频消融避免了首次消融后对再次穿刺的影响,缩短了手术时间,降低了麻醉风险。

