茶园土壤真菌群落组成及影响因素研究
万人源,马会杰,蒋 宾,杨丽冉,周大鹏,和明珠,杨广容
(1云南农业大学茶学院,昆明 650201;2恩施州农业科学院,湖北恩施 445000;3宜宾职业技术学院,四川宜宾 644003)
0 引言
土壤是茶树赖以生存的基质,茶园土壤养分状况是影响茶叶产量品质的重要因素[1-2]。茶树在长期适应热带和亚热带高温、高湿气候条件和土壤强淋溶生态环境的过程中,形成了其如喜温喜湿、喜酸嫌钙、喜铵厌硝、聚铝富锰等特性,茶园土壤特殊的生态环境造就了其独特的微生物群落结构[3-4]。微生物群落的组成结构、活性及多样性很大程度上决定了土壤中的营养元素循环和土壤的肥力,是反映土壤质量及评价土壤生态系统可持续性的重要生物学指标[5-7]。
大量研究表明,茶园土壤微生物真菌类群有:鞭毛菌亚门、接合菌亚门、子囊菌亚门、担子菌亚门、半知菌亚门,其中茶园有益微生物有固氮微生物、菌根真菌、茶树病原拮抗真菌等,并且,茶园土壤真菌群落的结构与数量随着植被种类、土壤肥力与pH、季节与降水、茶树品种、植茶年限、耕作、施肥管理等因子的改变而发生相应的变化[3,8-11]。茶树是富含多酚的植物,研究表明:富含低分子酚类化合物的凋落物会增加所有微生物的生物量,尤其是真菌[12-13];目前已从茶园土壤中分离出很多的真菌优势菌种,如:如青霉菌、木霉菌、曲霉菌、白僵菌、绿僵菌、镰刀菌等,其中很少有茶树根部的病原菌,它们中的一部分昆虫病原真菌类群,是茶园病虫害生物防治的重要种群[14-16]。因此,研究茶园土壤真菌及细菌群落结构对茶园生产可持续发展具有重要意义。
为提高茶叶产量和品质,中国茶叶栽培化肥和农药施用不断增长,茶叶的种植面临许多挑战,如茶园土壤酸化、肥力退化及茶园生态系统生物多样性下降及病虫害滋长爆发等,严重威胁茶叶生产的持续发展[17-18]。提高茶叶种植的效率和可持续性已成为中国乃至世界茶叶生产的必然趋势。目前关于云南不同类型茶园土壤真菌及土壤环境质量,尤其古茶园的研究报道比较少。本研究通过真菌扩增子测序技术,检测澜沧江下游南糯山、景迈山和布朗山3座古茶山的森林、现代茶园和古茶园土壤的真菌群落组成,并结合土壤养分状况测定,分析土壤真菌群落与环境因子间关系,以期为揭示不同类型茶园土壤真菌群落结构及其与茶园土壤环境质量关系提供理论依据。
1 材料与方法
1.1 土壤采样与处理
1.1.1 取样位点概况 土壤采样点分别位于云南省西双版纳州勐海县代表性3座古茶山:景迈山(大平掌)、布朗山(贺开村)和南糯山(半坡竹林小组),各古茶山均以森林土壤为对照,现代茶园和古茶园土壤为研究对象,共9个样本,分别为:森林土壤(S1、S2、S3)、现代茶园土壤(X1、X2、X3)和古茶园土壤(G1、G2、G3)。各茶园均为生态茶园,除景迈山和布朗山现代茶园每年进行土壤翻耕外,其他茶园均处于免耕状况,茶园栽培管理均为不施肥、不施农药的有机茶园或生态茶园,茶园的生态环境概况见表1。
1.1.2 采样方法与处理 土壤样品采集时间为2018年5月中旬,具体采集及处理方法与杨广容等[19]土样采集与处理相同。一部分土样(约20 g)装入无菌袋并及时贮样于液氮灌中保存,在-86℃低温保存,供分子生物学研究。另一部分剩余土壤(约500 g)置于室内自然风干,碾磨并过2 mm或0.15 mm筛用于土壤pH、碱解氮、速效磷、速效钾、有机质、全氮、全磷和全钾测定。
1.2 土壤化学性质及养分含量测定与统计分析
土壤pH采用1:2.5土水(质量比)用玻璃复合电极法测定;阳离子交换量(cation exchange apacity,CEC)用乙酸铵交换提取—蒸馏法;有机质(soil organic matter,SOM)用重铬酸钾容量法—外加热法;全氮(total nitrogen,TN)用浓硫酸—双氧水消煮—凯氏定氮法;全磷(total phosphorous,TP)用硫酸—双氧水消煮—钼锑抗比色法;全钾(total potassium,TK)用浓硫酸—双氧水消煮—火焰光度法;有效氮磷钾:碱解氮(alkalihydrolyzable nitrogen,AHN)用1 mol/L NaOH碱解扩散法;速效磷(available potassium,AP)即Olsen-P用0.5 mol/L NaHCO3溶液浸提—钼蓝比色法;速效钾(available potassium,AP)用乙酸铵浸提—火焰光度法[20]。
土壤化学性质数据处理用SPSS 21.0软件对实验数据进行分析,采用单因素方差分析(oneway-ANOVA)和多重比较(LSD)法进行差异显著性检验和多重比较分析(α=0.05和0.01),本研究土壤采样位点基本概况及养分状况见表1(表中数据均为mean±SD)。
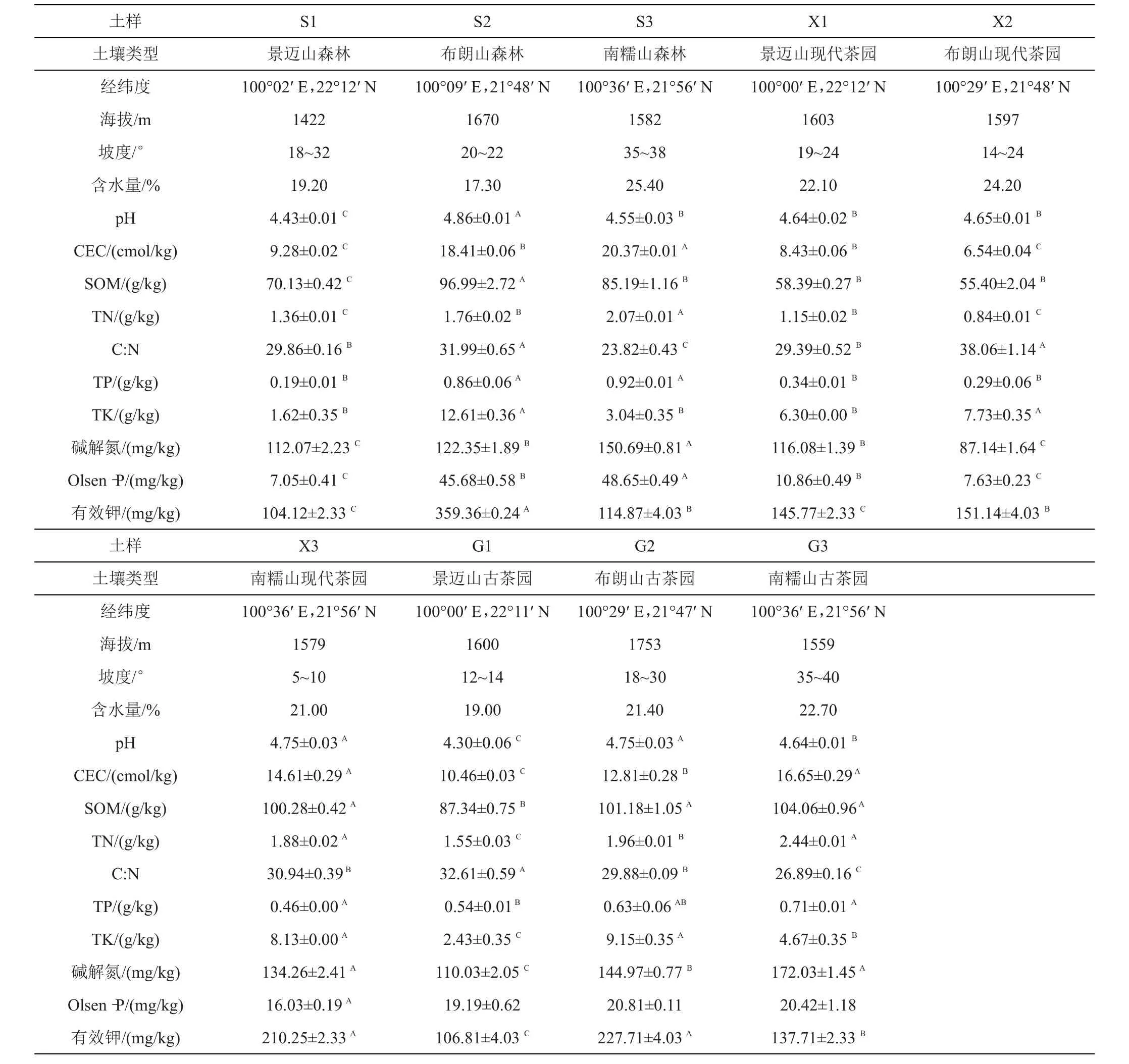
表1 土壤采样位点基本情况及养分状况
1.3 土壤真菌宏基因组测序及研究方法
1.3.1 土壤样品DNA提取 土壤DNA提取采用SDSGITC-PEG法[21],并作适当改进。称取0.5 g土样于2 mL离心管中,所加试剂均按照比例减少20倍,加入氯仿-异戊醇后离心速度为15000 g,10 min。
1.3.2 18S rDNA基因扩增与测序 18S rDNA基因扩增:用18S rDNA基因引物ITS3-KYO2F和ITS4R进行PCR扩增,引物及序列见表2。

表2 研究中使用的引物
测序:对扩增产物切胶回收,用QuantiFluorTM荧光计进行定量。选择符合测序要求的样品18Sr DNA送基迪奥生物科技有限公司(广州)在IlluminaHiseq2500的PE250模式机上进行真菌扩增子测序,并根据官方说明构建测序文库。
1.3.3 土壤真菌18S rDNA基因组多样性的高级生物学信息分析 数据质量控制与Tags拼接:参照杨广容等人的方法[19]进行。
Tags丰度统计:利用Mothur(v.1.34.0)软件包对tag序列进行去冗余处理,从中挑选出unique tag序列,并对unique tag进行丰度分布统计;最后使用基于Naive Bayesian方法分类器rdp classifier工具对tag进行物种注释[22]。根据序列长度变化,选择Confidence Threshold为0.5适当参数进行物种分类与丰度分析。为更好地获得样品中物种多样性信息,利用Mothur(v.1.34.0)软件包计算0.03距离下(97%的相似度)物种分类单元(OTU,Operating Taxonomic Unit)数量及其丰度。
OTU注释及聚类:采用众数原则,先统计该OTU中所有tags的物种注释信息,如果66%的tags都支持同一个物种分类单元,那么该物种分类就作为该OTU的物种分类信息,否则则在递归到上一级分类单元进行统计,直到满足要求。结合OTU的物种注释信息以及OTU在不同样品中的表达信息,获得所有样品的OTU的表达谱。通过绘制样品在0.03距离下的OTU稀释曲线(rarefaction curve)来评价测序量是否足以覆盖所有类群,并间接反映样品中物种的丰富程度及聚类情况。当曲线趋于平缓或者达到平台期时也就可以认为测序量趋于饱和。结合OTU物种注释信息及OTU在不同样品中的表达谱,统计界、门、纲、目、科、属和种各个分类水平上各样品的表达情况,获得物种分类表达谱、Alpha多样性指数和覆盖度,并选取丰度较高的部分物种分类单元(OTU),应用R软件统计绘制最佳分类水平上的物种分布堆叠图及聚类分析。
土壤真菌群落组成多样性与环境因子间的冗余分析(RDA,Redundancy Aanalysis):用Canoco5.0进行主成分PCA分析,及其真菌群落结构与环境因子相关性冗余分析。
2 结果与分析
2.1 不同土壤类型真菌群落丰度及多样性分析
3座茶山9个样品土壤真菌18S rDNA测序序列经数据过滤,获得高质量的、有效的read数:森林土壤依次为:93083(S1)>51070(S2)>6334(S3);现代茶园土壤为:71249(X1)>69308(X3)>56485(X2);古茶园土壤则为:68570(G1)>65514(G3)>61709(G2)。经统计不同类型土壤样品真菌群落在各个分类水平上的tag序列数及物种分类单元OTU(从上往下)为:界(100%)>门(97.74%)>纲(57.77%)>目(56.48%)>科(55.60%)>属(48.14%)>种(35.64%),在此情况下选择“属”作为9个样品的最佳分类水平。图1为样品在0.03距离下的OTU稀释曲线(a)及样品间bray距离层级聚类图(b)。从图1(a)可知,景迈山森林(S1)、现代茶园(X1)和古茶园(G1)土壤真菌数目均高于布朗山和南糯山的森林(S2和S3)、现代茶园(X2和X3)和古茶园(G2和G3)土壤真菌数,并且S1>X1>G1,而布朗山与之相反S2<X2<G2,南糯山森林(S3)土壤OTUs指数明显低于其他土壤。图1(b)则表明,3座茶山非茶园土壤(S1、S2和S3)真菌群落的物种结构比较相似而聚为一类;同一茶山的景迈山现代茶园(X1)与古茶园(G1)、南糯山现代茶园(X3)与古茶园(G3)土壤的真菌种群结构相近,首次聚类为一类,而布朗山的现代茶园(X2)与古茶园(G2)真菌群落组成差别较大,但通过二次、三次聚类与其他两座茶山的茶园土壤聚为一大类。总体表明,森林土壤与茶园土壤真群落菌组成差异性最大,其次是不同茶山之间。
表3为不同类型土壤真菌群落Alpha多样性分析结果,表明:所建立真菌文库的覆盖率达95.39%~99.19%,说明研究所建立的文库可比较真实有效地反映样本环境真菌的多样性。研究9个土壤样本真菌群落的Alpha多样性统计表明,chao1和ACE指数变化趋势与OTU指数相一致;森林土壤中真菌Shannon指数为:南糯山(S3,4.07)>布朗山(S2,3.99)>景迈山(S1,3.92),与之相一致,不同茶山的茶园土壤的Shannon指数呈现:古茶园为南糯山(G3,4.11)>布朗山(G2,3.90)>景迈山(G1,2.35)。与图1相结合表明:除景迈山外,茶园土壤真菌群落丰度和多样性水平普遍高于森林土壤。
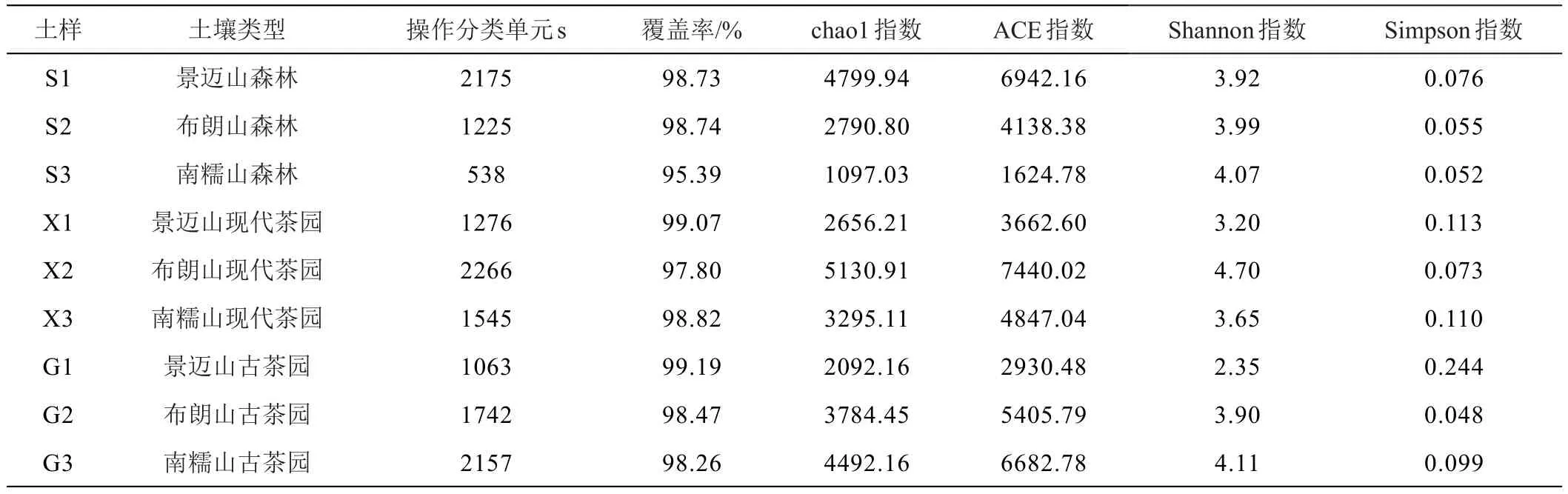
表3 不同土壤样本真菌Alpha多样性统计
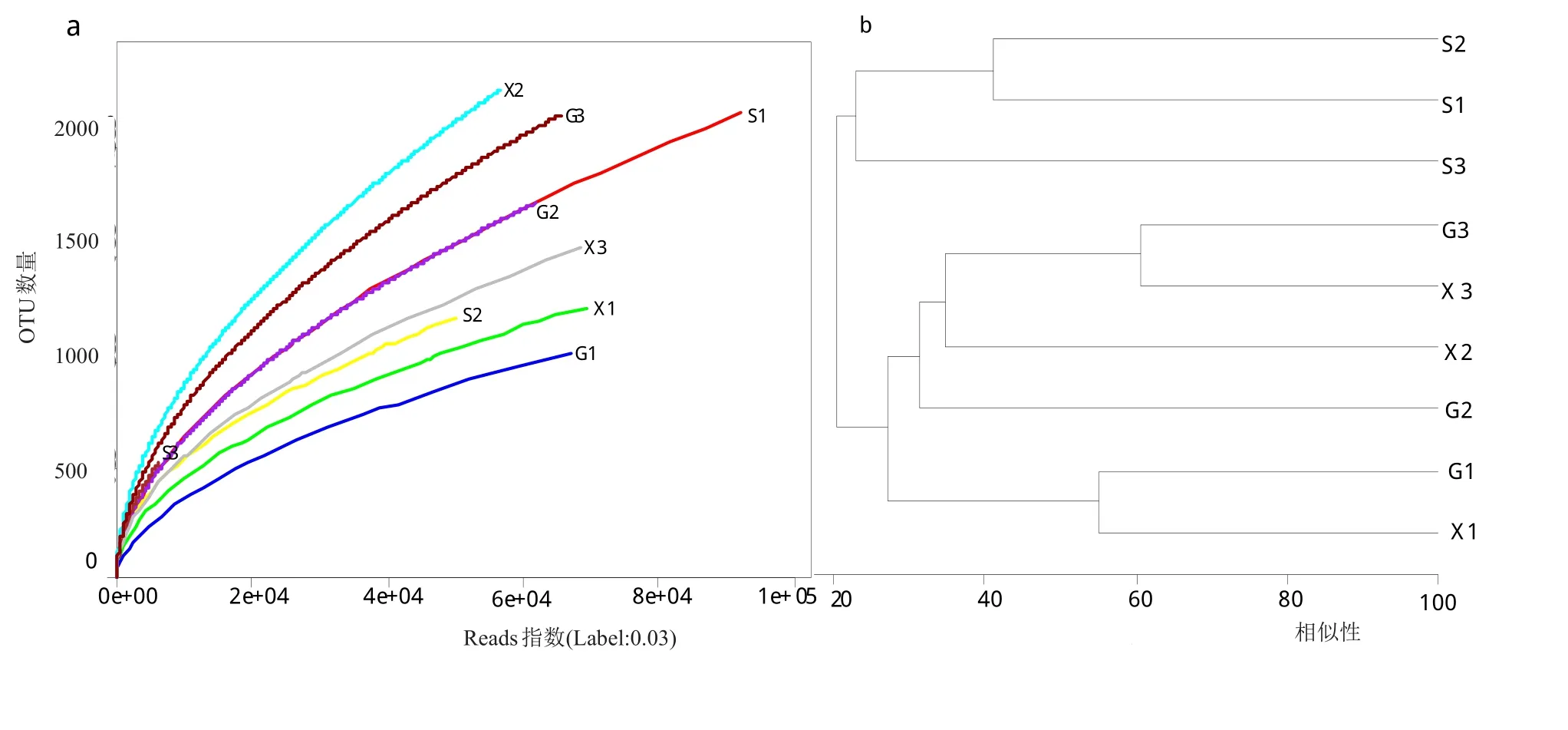
图1 各土壤真菌的OTU稀释曲线图及OTU的bray距离聚类分析图
2.2 不同分类水平上土壤样本真菌群落组成分析
根据OTU物种注释信息,9个样本土壤真菌群落组成归属于为5个门、117属、806种以及未知序列(UnClassified)。表4为不同类型土壤真菌5个门分布概括,分别是子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接 合 菌 门 (Zygomycota)、壶 菌 门(Chytridiomycota)和球囊菌门(Glomeromycota),它们占土壤真菌种类的97.17%~99.67%,其中,子囊菌门和担子菌门是优势菌门,在9个土壤中丰度占比分别高达42.60%~74.10%和20.58%~49.15%,其次是接合菌门为1.57%~14.92%。
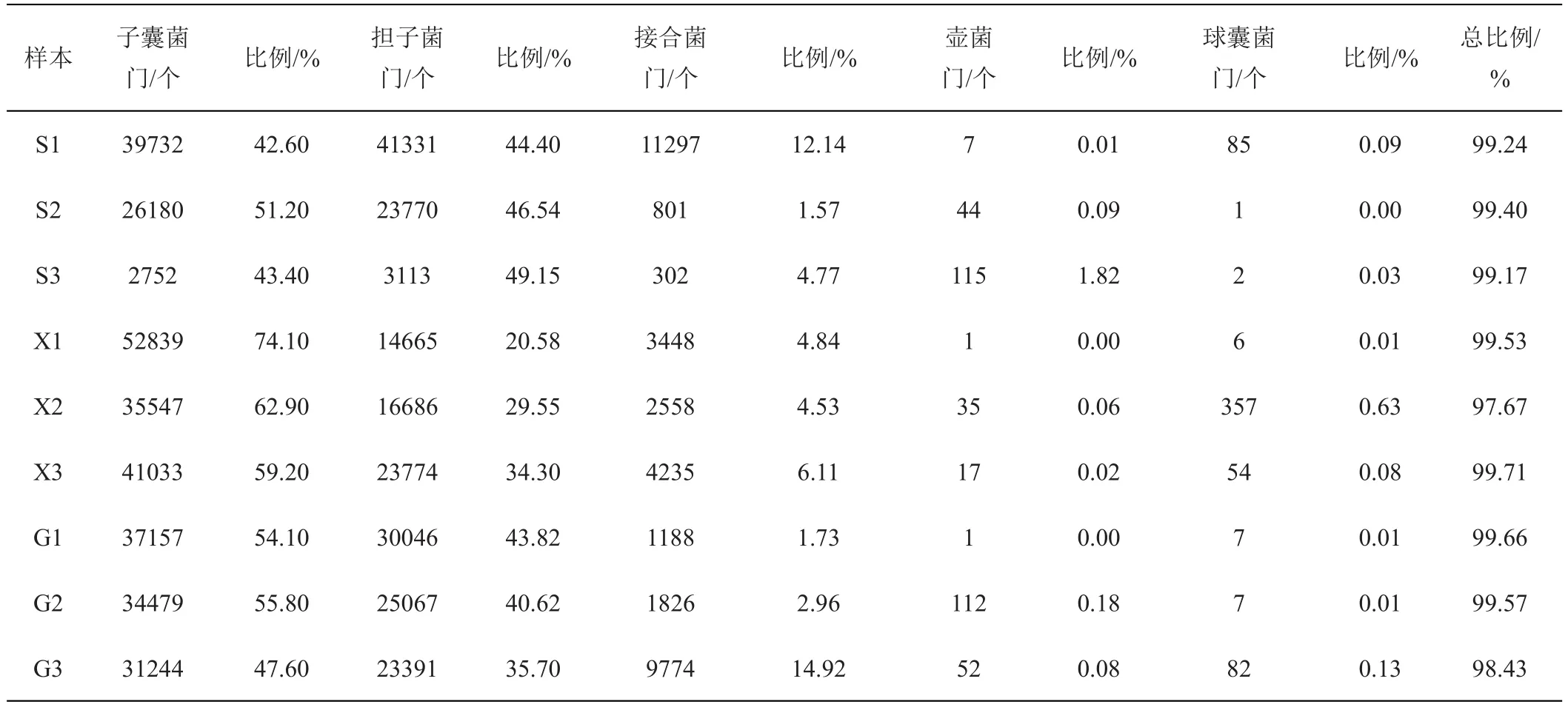
表4 不同土壤样本门类水平reads数目及所占比例
图2为本研究最佳分类水平上的物种分布堆叠图及聚类关系分析。由于涉及真菌群落的种类很多,图2仅对物种至少在一个样本中包含tags数量达到总tags数量的1%作为阈值的29个属(其中两个为未知真菌属Unclassified)进行作图。在属最佳分类水平上,3座茶山森林土壤(S1,S2和S3)的真菌群落组成聚为一类,说明它们的物种类型比较接近,与之相一致,现代茶园土壤X1和X3与古茶园土壤G2和G3能够通过首次、二次聚类为一类,说明景迈山和布朗山的4个茶园土壤真菌群落组成较为相似。而X2和G2虽然与其他4个茶园土壤最后聚为一来,表明布朗上的茶园土壤与南糯山和景迈山的茶园土壤差异较大。
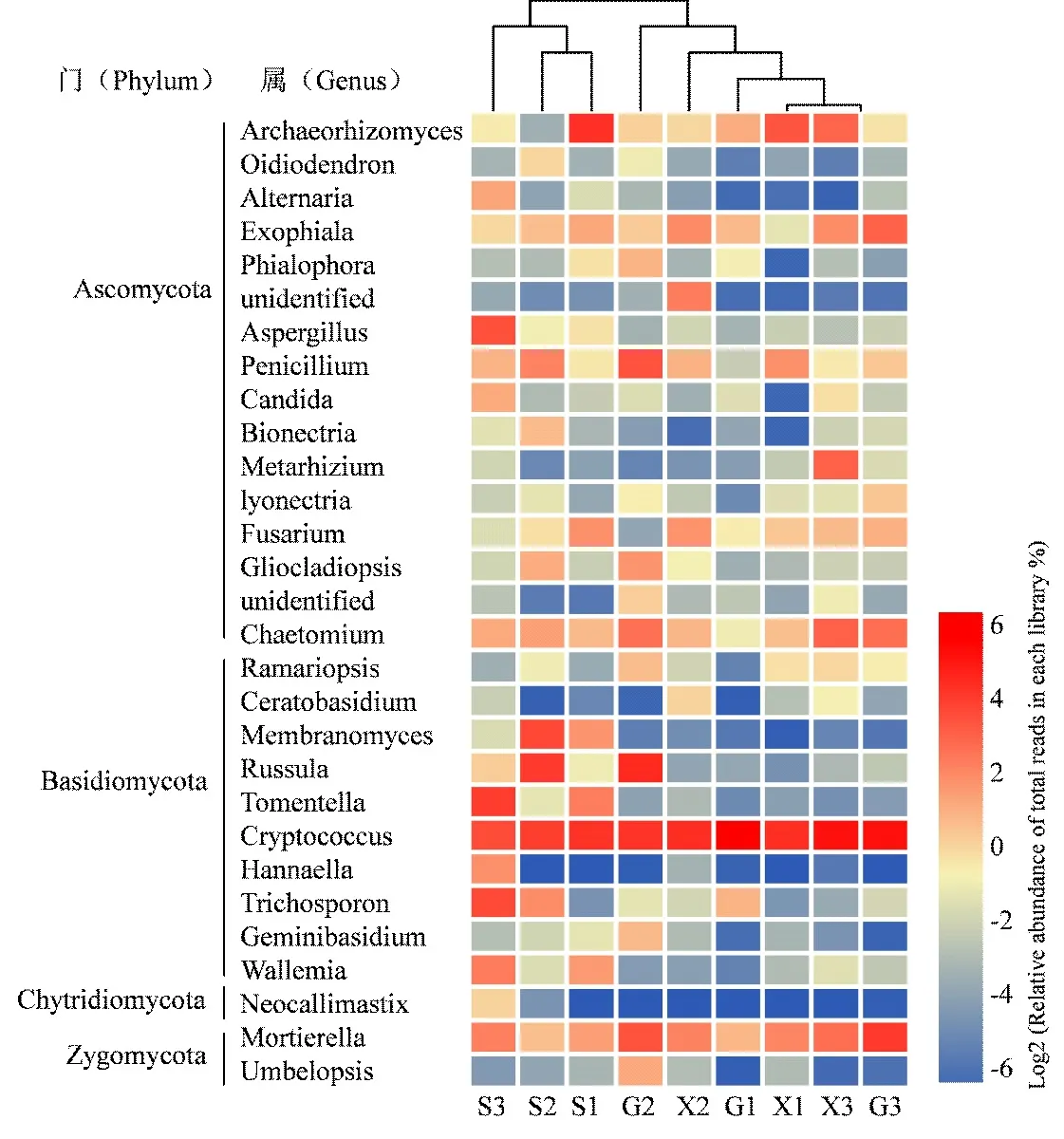
图2 属最佳分类水平上的真菌物种分布堆叠图及聚类分析
对所有土壤样品测得的OTUs所对应的生物分类学信息进行统计分析表明,隐球菌属(Cryptococcus)、Archaeorhizomyces和被孢霉属(Mortierella)在森林和
茶园土壤中分布均比较广泛;而曲霉菌属(Aspergillus)、革菌属(Tomentella)和Membranomyces与红菇菌属(Russula)分别在南糯山森林土壤S3与布朗山森林土壤S2分布优势明显;茶园土壤优势真菌类群多样性比森林土壤有所提高,外瓶霉属(Exophiala)、毛壳菌属(Chaetomium)、镰刀菌属(Fusarium)和青霉属(Penicillium)均演变为优势菌属。
2.3 不同类型土壤真菌群落多样性与土壤环境因子的冗余分析(RDA)
为进一步阐明不同类型土壤pH值和碳氮磷钾养分对真菌群落分布的影响,先通过Canoco5.0软件进行去趋势对应分析,分析结果表明适合做冗余分析(RDA)。从表1中选取6个存在显著相关关系的土壤环境指标与土壤真菌多样性指标作RDA如图3所示。X1、S2、G2、X3和G3茶园土壤样本比较靠近第一排序轴,即这5个土壤样本真菌群落多样性比较接近。其次,C:N与代表土壤真菌数量的(ACE和Chao1)2个指数均呈显著性正相关,说明土壤碳氮比水平提高,有利于森林和茶园土壤真菌数量增加;与之相反,土壤SOM、AHN和Olsen-P与ACE和Chao1呈显著性负相关关系,即土壤有机质和有效氮磷水平提高不利于增强其真菌数量和群落丰度增强。虽然,6个土壤环境因子pH、SOM、C:N、AHN、Olsen-P和AP与土壤真菌群落丰度和多样性之间有一定的相互关系,但与pH、C:N和Olsen-P的相关性明显高于SOM、AHN和AP。
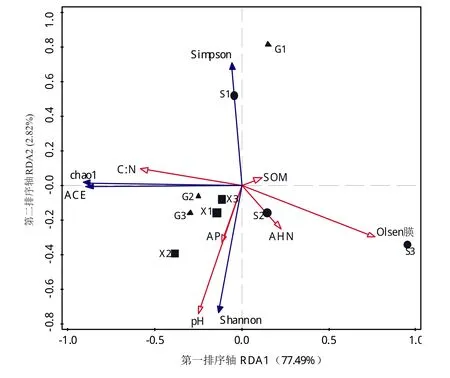
图3 不同类型土壤真菌群落结构多样性与土壤环境因子间的冗余分析
2.4 不同类型土壤真菌群落组成与土壤环境因子间的冗余分析
选择属最佳分类水平真菌群落丰度占比大于2%的菌属作为RDA物种输入变量,利用Canoco5.0软件对真菌群落特征和经过变异膨胀因子筛选后的6个土壤环境因子进行RDA分析如图4。首先,第一、二排序轴解释量分别达到35.21%和19.52%,说明6个土壤环境因子pH、SOM、C:N、AHN、Olsen-P和AP是显著影响样本土壤真菌群落分布的环境因子。其次,3座茶山森林土壤由于地理分布区域距离较远,土壤母质及植被等差异较大,各森林土壤的主要优势真菌类群差异较大。最后,3座茶山的6个茶园土壤样本的象限分布看,6个茶园土壤优势真菌的群落结构比较接近,其中,X2、G1和G2的真菌类群结构分别与S3和S2相近,X1、G3和X3的优势真菌类群有绿僵菌属(Metarhizium)、 Archaeorhizomyces、镰 刀 菌 属(Fusarium)、隐 球 菌 属 (Cryptococcus)、被 孢 霉 属(Mortierella)和外瓶霉属(Exophiala)和未能鉴定的(Unclassified)属群,并且这些真菌属的分布丰度与茶园土壤SOM、AHN、AP、Olsen-P和pH呈显著的正相关关系。
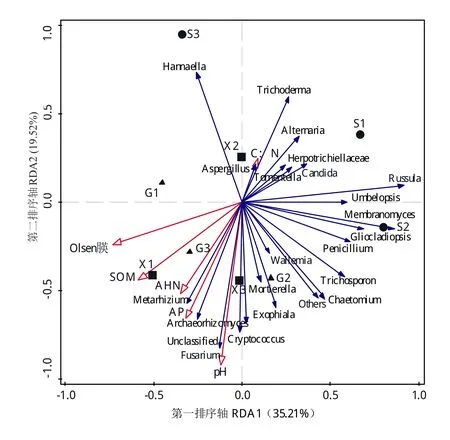
图4 不同类型土壤真菌群落组成与环境因子间的冗余分析
3 结论
茶园土壤真菌群落结构在门分类水平与森林土壤相似,以子囊菌、担子菌、接合菌、壶菌和球囊菌5个门为 主 ,并 且 Cryptococcus、Archaeorhizomyces和Mortierella 3个属分布较为广泛。影响茶园土壤真菌群落多样性和丰度的主要因素比较复杂,从宏观的生态环境范围看茶山土壤母质及植被状况是重要影响因素,其次是植茶年限的长短,随着茶树种植茶园土壤真菌 类 群 有 向 Cryptococcus、Archaeorhizomyces、Fusarium、Exophiala、Mortierella和Metarhizium 等属群演替的趋势;在微观的土壤理化特性和养分状况上看,土壤pH、C:N及碳氮磷钾肥力水平与茶园土壤真菌群落结构及多样性关系较为密切。
4 讨论
茶园土壤真菌群落结构受多方面影响,除茶树叶片凋落物本身特性外,还与茶树根系分泌物数量、土壤有机质含量和pH等有关[23-24]。本研究的土壤样本在pH 4.30~4.86之间,属于适宜茶树生长范围,研究结果表明,大多数茶园土壤的真菌群落结构和多样性与pH、SOM、有效氮磷钾(AHN、Olsen-P和AP)和C:N呈显著相关关系,其中,SOM、有效氮磷含量与真菌数量和多样性呈负相关(图3),而大部分优势真菌属丰度与土壤C:N也是负相关关系(图4)。本研究中森林土壤与茶园真群落菌组成差异性最大,其次是不同茶山之间,再次为同一茶山不同植茶年龄的茶园之间(图1)。本研究中导致森林和茶园土壤真菌群落结构与优势菌群丰度间的差异的主要原因可能是:一是不同茶山土壤母质及植被差异较大,二是供试土壤在pH 4.50左右,当土壤pH<5.0时,对耐酸性较强的真菌的生长繁殖影响不大,三是本试验的土壤肥力水平较高,可供腐生真菌生长所需基质(纤维素等)相对较多。
关于森林和茶园土壤真菌群落结构,本研究从不同类型土壤中鉴定到真菌群落基本分属于:子囊菌、担子菌、接合菌、壶菌和球囊菌5个门,其中前3个门为优势菌门(表4),各茶山现代茶园和古茶园土壤的优势真菌属的数目和丰度均比森林土壤高(图2和图4),3个森林土壤优势真菌群落数目与种类差异较大,并以毛壳属、隐球菌属、毛孢子菌属、青霉属、木霉属、曲霉菌属等在不同森林土壤中分布比较广泛。而茶园土壤的优势真菌类群则以Archaeorhizomyces、隐球菌属、外瓶霉属、绿僵菌属、镰刀菌属、毛壳菌属、被孢霉属等类群为主;此外,青霉属、木霉属和曲霉菌属在布朗山茶园土壤(X2和G2)中分布也比较丰富,说明不同茶山的茶园土壤优势真菌群落的差异明显。本研究与季凌飞、袁赛艳和胡雲飞[9-11]等前人的研究结果比较相似:在不同施肥、茶树修剪枝叶还田及季节条件下,茶园真菌群落结构主要由子囊菌门、担子菌门、接合菌门、壶菌门和球囊菌门构成,茶园及农田长期施肥可能会促使土壤中的真菌群落多样性降低,群落结构主要朝子囊菌、担子菌和接合菌3个方向演替,并且,不同植被覆盖可能会导致土壤真菌群落组成的差异,在土壤pH的主控效应可能存在于不同植被覆盖体系间,而在同一作物土壤中,土壤有机碳、碳氮比以及速效氮磷钾可能强烈的影响微生物群落结构,这与本研究的RDA分析结果相一致(图3和4):茶园土壤真菌群落的分布丰度与土壤SOM、AHN、Olsen-P、AP和pH呈显著相关关系。
本研究表明,森林与茶园土壤优势真菌群落结构与多样性差异除受地理分布、植被类型、土壤养分、施肥与修剪等影响外,还与茶树栽培及年限密切相关。张玥等[23]研究也表明:随着植茶年限的增加,茶树根际土壤肥力增加和真菌群落数量增加,有利于茶树生长代谢的真菌种群增多。前人研究已发现,木霉(Trichoderma spp.)、青霉菌(Penicillium spp.)、曲霉菌(Aspergillusspp.)、嗜 热 侧 孢 霉 (Scytalidium thermophilum)、镰 刀 菌 (Fusarium spp.)、球 囊 霉 属(Glomus)、球孢白僵菌(Beauveria bassiana)、绿僵菌(Metarhizium anisopliae)等真菌在茶园土壤中广泛分布,它们对茶树凋落物、修剪物、根系分泌物中的木质素和多酚等有较强的降解作用,可提高土壤肥力和活性,并作为茶园生防真菌对茶园土壤清洁、茶树小绿叶蝉、茶卷叶蛾等昆虫和螨类及根腐病等方面都可能发挥重要作用[5,13-16,24-25]。所以,茶园土壤特征性优势真菌群落可作为茶园土壤健康的重要标志,在开展茶园间套作遮荫树和其他作物增加茶园土壤微生物群落数量和多样性,促进茶园土壤养分循环与健康[26-27],合理利用茶树修剪物及茶厂废弃物还田和增施有机肥提高茶园土壤有机质及微生物数量和改良土壤理化性质,增强土壤微生物的代谢活性[23,28],已逐步成为国内外茶园土壤微生物研究与肥力可持续性和茶树病虫害防治的重要领域[29-30]。

