菝葜多糖分离纯化工艺研究
梅明,周进,张毅,马良鹏,杨明,胡松*
(1.武汉市第一医院 药学部,湖北 武汉 430030;2.江西中医药大学 现代中药制剂教育部重点实验室,江西 南昌 330004)
菝葜为百合科植物菝葜的干燥根茎,具有利湿去浊、祛风除痹与解毒散瘀的功效[1-2],始载于《名医别录》,现收载于《中国药典》2015版一部[3]。实验研究表明,菝葜有效成分为皂苷、黄酮、有机酸及多糖等,其总提取物有镇痛、抗炎、抗感染、降血糖及增强机体免疫力等作用,临床上广泛用于妇科慢性疾病的治疗,如慢性盆腔炎、附件炎等[4]。目前关于菝葜有效成分的研究主要集中在皂苷类与黄酮类成分,然而近年来多糖类成分越来越被人们所重视,且有报道表明菝葜多糖具有明显的免疫调节等作用[5-6],这为开展菝葜多糖类成分的研究提供了依据。本文对菝葜多糖进行了醇沉工艺与大孔吸附树脂纯化工艺研究,为其进一步开发利用提供了依据。
1 仪器与材料
1.1 实验仪器
FA1104型万分之一电子天平(上海天平仪器厂);Mettler AE240型十万分之一电子天平(德国Mettler公司);UV-1700型紫外-可见分光光度仪(日本岛津公司); KQ3200型超声清洗器(昆山市超声仪器有限公司);SZ93型旋转蒸发仪(上海亚荣生化仪器厂);DZF6020型减压干燥箱(上海乔跃电子有限公司)。
1.2 实验材料
无水葡萄糖对照品(中国药品生物制品检定所,批号110833-201205,纯度≥99%);菝葜(批号121028)购于四川新荷花饮片有限公司,由成都中医药大学卢先明教授鉴定为百合科植物菝葜的干燥根茎;HPD-100型、D101型大孔吸附树脂(成都市科龙化工试剂厂,批号分别为20130305、20120305),AB-8型大孔吸附树脂(南开大学化工厂,批号030605);甲醇、浓硫酸、苯酚等均为分析纯(成都市科龙化工试剂厂);水为超纯水。
2 方法与结果
2.1 菝葜多糖的含量测定
2.1.1 对照品溶液的制备
精密称取已在105 ℃干燥至恒重的葡萄糖对照品10.3 mg,置于100 mL棕色容量瓶中,加纯水定容,制成含无水葡萄糖0.103 mg/ mL的对照品溶液。
2.1.2 供试品溶液的制备
称取菝葜药材适量,加入10倍量的体积分数80%乙醇,水浴回流3次,每次1.5 h,滤过,残渣在水浴上挥干,然后加12倍量的纯水,提取3次,每次提取2 h,提取温度为80 ℃,定容,即得提取液,备用。
2.1.3 线性关系考察
以空白溶剂为随行对照,精密量取2.1.1项下对照品溶液适量,在波长200~700 nm范围内进行扫描,发现在490 nm处有特征吸收峰,确定检测波长为490 nm。分别精密吸取0.50、0.60、0.70、0.80、0.90与1.00 mL对照品溶液,分别置于10 mL具塞试管中,精密加水分别补至2.00 mL,各加入质量分数为5%的苯酚溶液1 mL,摇匀,迅速精密加入硫酸7 mL,摇匀,放置10 min,置40 ℃水浴中保温15 min,取出,冰浴5 min,迅速冷却至室温,以相应的试剂作为空白,在490 nm波长处测定,以质量浓度为横坐标,吸光度为纵坐标,制作标准曲线。计算回归方程,回归方程为:y=14.89x-0.029(r=0.999),结果表明,无水葡萄糖在0.026~0.052 mg/mL范围内样品质量浓度与吸光度线性关系良好。
2.2 醇沉工艺研究
2.2.1 醇沉静置温度考察
取菝葜多糖水提液适量,减压浓缩至每毫升水提液含生药1.0 g,备用。量取3份浓缩液,加入乙醇,使乙醇体积分数达到80%,分别于25、8与2 ℃ 条件下,静置12 h,抽滤得醇沉物,70 ℃干燥,分别得多糖粗品,计算多糖出膏率并测定多糖纯度[7-9],结果见表1。

表1 静置温度考察
结果表明,25、8和2 ℃静置效果没有较大差异,故采用室温25 ℃静置醇沉即可。
2.2.2 醇沉静置时间考察
精密量取4份浓缩液,各50 mL,加入乙醇,使乙醇体积分数达到80%,于室温25 ℃条件下,分别静置6、12、24与48 h,抽滤得醇沉物,70 ℃干燥,分别得多糖粗品,计算多糖出膏率并测定多糖纯度,结果见表2。
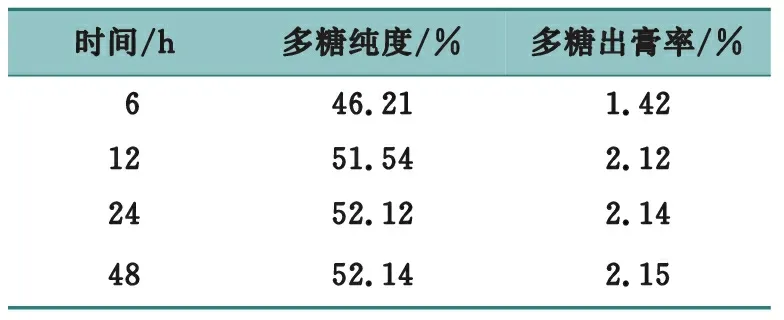
表2 静置时间考察
结果表明,随着静置时间的延长,多糖纯度与多糖出膏率逐渐增加,静置12 h即可达到较理想效果,结合工业扩大生产实际考虑,确定醇沉静置时间为12 h。
2.2.3 药液质量浓度考察
取4份菝葜多糖水提液,分别稀释或浓缩至每毫升水提液含生药0.5、0.8、1.0、1.2 g的药液,加入乙醇,使乙醇体积分数达到80%,室温静置12 h,抽滤得醇沉物,70 ℃干燥,分别得多糖粗品,计算多糖出膏率并测定多糖纯度,结果见表3。
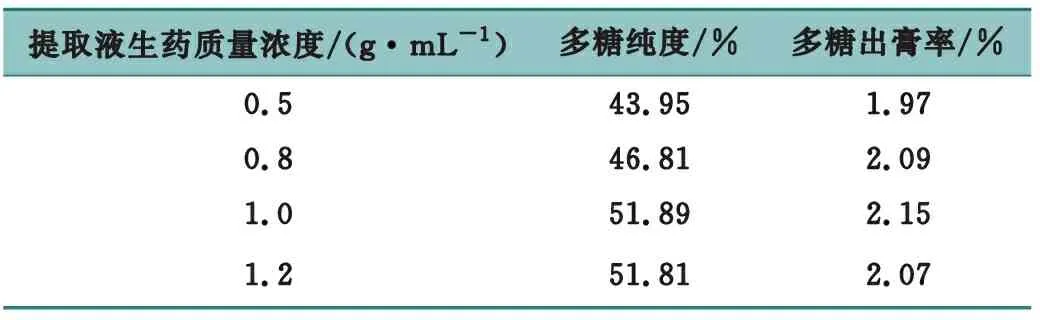
表3 提取液生药质量浓度考察
结果表明,当生药质量浓度为1.0 g/mL时,醇沉效果较好。
2.2.4 乙醇体积分数考察
精密量取4份浓缩液各50 mL,加入乙醇,使乙醇体积分数分别达到60%、70%、80%、90%,室温静置12 h,抽滤得醇沉物,70 ℃干燥,分别得多糖粗品,计算多糖出膏率并测定多糖纯度,结果见表4。

表4 乙醇体积分数考察
结果表明,乙醇体积分数为80%时,多糖纯度与多糖出膏率均较为理想,因此,确定菝葜多糖的乙醇体积分数为80%。
2.2.5 醇沉次数考察
精密量取3份浓缩液各50 mL,加入乙醇,使乙醇体积分数分别达到80%,分别醇沉1、2、3次,室温静置12 h,抽滤得醇沉物,70 ℃干燥,分别得多糖粗品,计算多糖出膏率并测定多糖纯度,结果见表5。
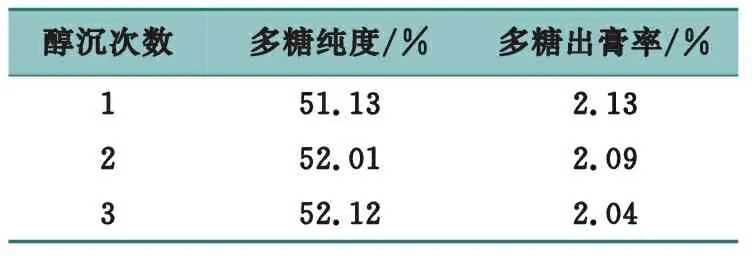
表5 醇沉次数考察
结果表明,随着醇沉次数的增加,多糖纯度略有升高,但多糖出膏率呈下降趋势,综合考虑多糖纯度、多糖得率等,确定最佳醇沉次数为1次。
2.2.6 验证实验
综合前述实验考察结果,确定最佳醇沉工艺为将提取液浓缩至每毫升含生药1.0 g,加入乙醇,使乙醇体积分数达到80%,醇沉1次,室温25 ℃静置12 h,抽滤得醇沉物,70 ℃干燥,即得,3次验证实验结果见表6。

表6 验证实验结果
结果表明,多糖醇沉后平均纯度为51.77%,平均出膏率为2.12%,结果较为稳定,说明该醇沉工艺稳定可行。
2.3 大孔吸附树脂纯化工艺研究
2.3.1 大孔吸附树脂预处理

2.3.2 大孔吸附树脂静态吸附与解吸考察
准确称取已被预处理过的AB-8型、HPD100型、D101型大孔吸附树脂各2 g,置锥形瓶中,分别加入2.0 mg/mL的菝葜粗多糖溶液50 mL,于20 ℃恒温条件下,置磁力搅拌器上充分搅拌24 h,充分吸附后,测定残液中多糖质量浓度,并计算吸附量与吸附率。再将上述经过静态吸附的大孔吸附树脂,置于具塞的锥形瓶中,各加入50 mL蒸馏水,20 ℃恒温条件下,置磁力搅拌器上充分搅拌24 h,过滤,测定解吸残液中多糖质量浓度,并计算解吸率。计算公式如下:吸附率=(C0-C1)/C0×100%,解吸率=C2V2/(C0-C1)V1×100%,式中,C0为吸附液初始质量浓度,C1为吸附后质量浓度,C2为解吸残液质量浓度,V1为加入粗多糖溶液体积,V2为加入蒸馏水体积,结果见表7。
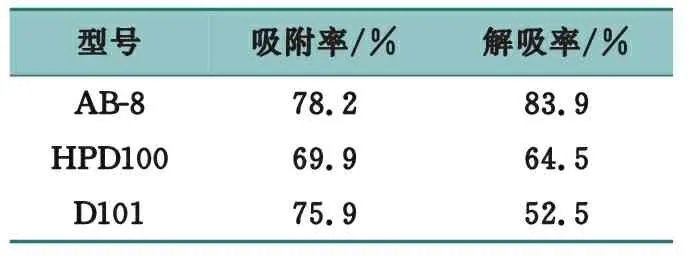
表7 大孔吸附树脂静态吸附率及解吸率结果
结果表明,相比HPD100型与D101型大孔吸附树脂,AB-8型对菝葜多糖的吸附率与解吸率均较高,故选择AB-8型对菝葜多糖进行纯化。
2.3.3 上样液质量浓度考察
准确称取3份已被预处理过的AB-8型大孔吸附树脂,柱体积为30 mL,湿法装柱,配制1.0、2.0与4.0 mg/mL(以粗多糖计)的上样液,按2 BV/h的流速,上样1 BV,以2 BV/h的流速用纯水进行洗脱,收集洗脱液并定容,按拟定方法测定洗脱液中多糖质量浓度并计算吸附率,结果表明上样液质量浓度为2.0 mg/mL时,多糖吸附率较大,因此确定上样质量浓度为2.0 mg/mL,见图1。
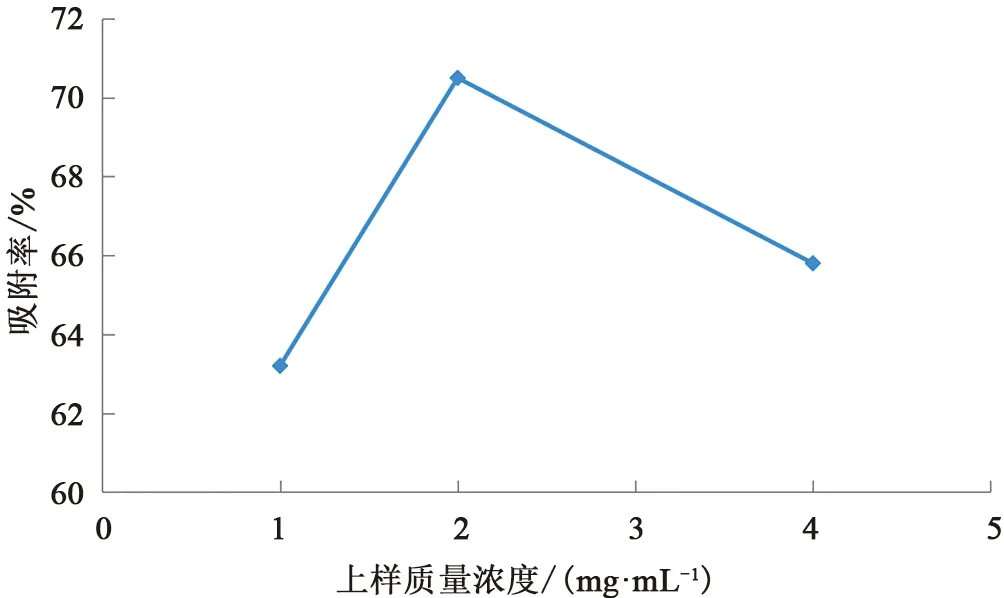
图1 上样质量浓度考察结果Fig.1 Investigation result of sample concentration
2.3.4 上样流速考察
准确称取5份已被预处理过的AB-8型大孔吸附树脂,柱体积为30 mL,湿法装柱。取2.0 mg/mL(以粗多糖计)的上样液1 BV,分别以1、2、3、4、5 BV/h的流速进行上样,以2 BV/h的流速用纯水进行洗脱,收集洗脱液并定容,按拟定方法测定洗脱液中多糖质量浓度并计算吸附率。结果多糖吸附率分别为65.3%、70.2%、67.1%、61.3%与55.2%,表明过大或过小的上样流速都不利于多糖吸附,综合考虑确定以2 BV/h的流速进行上样。
2.3.5 上样量考察
准确称取5份已被预处理过的AB-8型大孔吸附树脂,柱体积为30 mL,湿法装柱。取2.0 mg/mL(以粗多糖计)的上样液,以2 BV/h的流速进行上样,分别上样1、2、3、4、5 BV,再用纯水以2 BV/h的流速进行洗脱,收集洗脱液并定容,按拟定方法测定洗脱液中多糖质量浓度并计算吸附率,结果见表8。
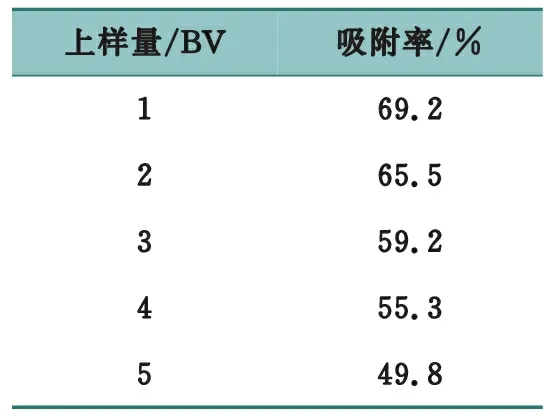
表8 上样量考察结果
结果表明,上样量为1 BV时,多糖吸附率较大,因此确定上样量为1 BV。
2.3.6 洗脱溶剂考察
准确称取5份已被预处理过的AB-8型大孔吸附树脂,柱体积为30 mL,湿法装柱。取2.0 mg/mL(以粗多糖计)的上样液,按2 BV/h的流速,上样1 BV,再分别用纯水、10%乙醇、15%乙醇、30%乙醇与40%乙醇以2 BV/h的流速进行洗脱,收集洗脱液并定容,按拟定方法测定吸光度值,结果见表9。
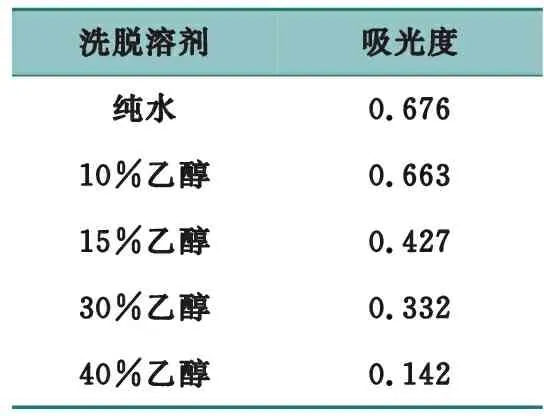
表9 洗脱溶剂考察结果
结果表明,随着乙醇体积分数的增加,洗脱效率反而降低,因此,确定洗脱溶剂为纯水。
2.3.7 洗脱速率考察
准确称取5份已被预处理过的AB-8型大孔吸附树脂,柱体积为30 mL,湿法装柱。取2.0 mg/mL(以粗多糖计)的上样液,按2 BV/h的流速,上样1 BV,再分别以1、2、3、4、5 BV/h的流速,用纯水进行洗脱,收集洗脱液并定容,按拟定方法测定洗脱液中多糖质量浓度并计算解吸率,结果表明洗脱速率对多糖解吸率有一定影响,当洗脱速率为3 BV/h时,解吸率大,因此,确定洗脱速率为3 BV/h,见图2。
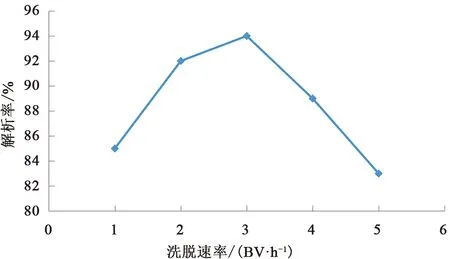
图2 洗脱速率考察结果Fig.2 Investigation result of elution rate
2.3.8 洗脱溶剂用量考察
准确称取5份已被预处理过的AB-8型大孔吸附树脂,柱体积为30 mL,湿法装柱。取2.0 mg/mL(以粗多糖计)的上样液,按2 BV/h的流速,上样1 BV,以3 BV/h的流速用纯水进行洗脱,每1 BV收集洗脱液并定容,按拟定方法测定洗脱液中多糖质量浓度并计算解吸率,结果表明洗脱剂用量为3 BV时,多糖已能充分洗脱,因此综合考虑时间等因素,确定洗脱剂用量为3 BV,见图3。

图3 洗脱溶剂用量考察结果Fig.3 Investigation result of elution amount
2.3.9 验证实验
准确称取3份已被预处理过的AB-8型大孔吸附树脂,柱体积为30 mL,湿法装柱。取2.0 mg/mL(以粗多糖计)的上样液,按2 BV/h的流速,上样1 BV,以3 BV/h的流速用3 BV的纯水进行洗脱,收集洗脱液并定容,按拟定方法测定洗脱液中多糖质量浓度。再精密吸取一定体积的洗脱液置恒重后的蒸发皿中,减压浓缩至一定体积,70 ℃干燥,在干燥器中冷却0.5 h,迅速称重,计算多糖纯度,结果见表10。

表10 验证实验结果
结果表明,大孔吸附树脂纯化后,多糖平均纯度为60.48%,平均得率为1.03%,工艺稳定可行,可用于菝葜多糖的分离纯化。
3 讨论与结论
大孔吸附树脂分离技术能从中药及其复方提取液中通过物理吸附有选择性地吸附有效成分,从而对中药中有效部位或有效成分实现分离、纯化和富集[17-18]。多糖作为菝葜中的主要活性成分之一,对其分离纯化工艺的研究具有一定的现实意义。本实验通过对菝葜多糖醇沉工艺与大孔吸附树脂纯化工艺的研究,确定了菝葜多糖的最佳纯化工艺。通过对醇沉静置温度、醇沉静置时间与药液质量浓度等因素的考察,优化醇沉工艺,使菝葜多糖的纯度达到了51.77%;通过大孔吸树脂种类、上样液浓度与洗脱溶剂等因素的考察,优化大孔树脂纯化工艺,将菝葜多糖的纯度提高到了60.48%。以上研究使纯化后的菝葜多糖符合《药品注册管理办法》[19]中关于中药注册申报的相关要求,为菝葜药材的进一步开发利用奠定了基础。

