金枪鱼加工副产物发酵液对植物的抗菌促生长活性
王一凡,王志高,易 冲,吴 越,张泽坤,王坤美,罗红宇
(浙江海洋大学食品与药学学院,浙江舟山 316022)
目前,全世界范围内人们对海洋资源的开发不断扩大,但是在对海产品的捕获和加工中,大量低商业价值的原料和水产副产物未能得到充分利用,并且随着渔业加工业的快速发展,水产加工副产物数量急剧增加[1]。例如,单在欧盟水产加工中产生的副产物数量估计为每年500 万t,其中超过60%的副产物来自各种鱼片、烟熏鱼的加工,此外鱼罐头工业、甲壳类和软体动物生产加工过程中,也有大量的废弃物产生[2]。在中国,2019 年水产品产量达为6 450 万t[3],但其中只有40%用于加工,利用率低于50%[2]。目前国内对这些低值资源的处理有两大问题,一是资源的浪费,蛋白质、矿物质和油脂等大量营养物质的利用不足,二是处理如此多的高污染有机物会造成严重的环境和经济问题。因此,有效提高低值水产资源的利用率以及研发清洁环保处理技术和方法具有重要的意义。
此外,化肥和农药的使用对植物的生长和环境都有非常大的影响,越来越多的人考虑将生物制剂用于农业生产中[4]。DAO,et al[5]使用1 个5 L 的带状反应器对水产废弃物进行了大规模的生物降解,发现了土壤短芽孢杆菌Brevibacillus agri、蜡样芽孢杆菌Bacillus cereus、2 种地衣芽孢杆菌Bacillus licheniformis、副短芽孢杆菌Bacillus parabrevis等5 种潜藏在的水产废弃物中的降解菌,并将其转化为液体肥料;KIM,et al[6]研究利用土壤短芽孢杆菌、蜡样芽孢杆菌、两种地衣芽孢杆菌和副短芽孢杆菌将鱼类废弃物进行发酵将其转化为肥料;LEWER,et al[7]在刺糖多糖孢Saccharopolysporasp.的发酵过程中分离出发酵过程中产生的毒素,利用分离出来的毒素生产出多杀菌素杀虫剂;JEMIL,et al[8]发现由斑马蓝蛋白水解物通过发酵得到的水解物中获得抗菌活性与一种蛋白水解细菌(拮抗内生细菌A21)的抗菌活性一致。目前越来越多生物制剂被应用于农业生产中,本文将生物制剂运用到水产加工副产物中,探究发酵液对植物的抗菌促生长活性,可提高水产加工副产物的利用率,促进农业发展,实现现代化绿色生产。
生物肥料被誉为环保、低成本的产品,可以有效解决粮食生产过程中的不安全问题[9]。由于EM 菌(包含光合菌、酵母菌、乳酸菌等有益菌类)在种植、畜牧等行业中的应用非常广泛。本实验课题组前期从低值水产品中分离的菌株(发酵菌株)和EM 菌同样有发酵作用,为了探究EM 菌和发酵菌株代谢产生的活性物质的抗菌特性,利用琼脂扩散法评价发酵液的抗菌活性,利用盆栽实验初步评价发酵液的抗病害能力,并考察了发酵液抗菌活性的稳定性,为发酵菌活性代谢产物的分离纯化和结构鉴定,进一步开发生物肥料奠定了理论基础。
1 材料与方法
1.1 材料和试剂
1.1.1 实验原料
市售有机液肥家庭浓缩营养液(样品A)、水产加工副产物(主要是金枪鱼Thunnus albacores,含少量棘头梅童鱼Collichthys lucidus等加工副产物,包含鱼头、鱼骨、内脏等),由岱山县绿康源海洋生物技术有限公司生产提供,将副产物粉碎至1 cm×1 cm 以内,装入聚乙烯包装袋于-20 ℃冰箱中保存备用。
1.1.2 实验菌株
发酵菌株:施氏假单胞菌Pseudomonas stutzeri、类芽孢杆菌Paenibacillussp、黑曲霉Aspergillus niger、季也蒙假丝酵母Candida guilliemondii、枯草芽孢杆菌Bacillus subtilis separated,本课题组从低值渔获物和加工副产物中分离并进行了鉴定;EM 菌岱山绿康源海洋生物科技有限公司提供;抗菌活性测试菌株:枯草芽孢杆菌Bacillus subtilis(批号:CMCC 10002)、金黄色葡萄球菌Staphylococcus aureus(批号:CMCC 26003)、大肠杆菌Escherichia coli(批号:CGMCC 1.1100)、绿脓杆菌Pseudomonas aeruginosa(批号:CMCC 10104)、伤寒沙门氏菌Salmonella typhus(批号:CGMCC 21483)、八叠球菌Sarcinasp.(批号:CMCC 1.258)购自中国工业微生物菌种保藏管理中心(CICC)。瓜链格孢菌Alternaria cucumerina、齐整小核菌Sclerotium rolfsii、拟盘多毛孢Pestalotiopsissp.和核盘菌Sclerotinia sclerotiorum从腐败水果蔬菜中分离鉴定。
1.1.3 化学试剂
NaOH;HCl;pH 8.0 缓冲液;茚三酮均为分析纯国药集团化学试剂有限公司。多菌灵购自舟山华润万家。
1.1.4 植物种子
甘蓝型油菜种子购自舟山定海洁姬种子店。
1.1.5 设备
手提压力蒸汽灭菌器(DSX-280KB24),上海申安医疗器械厂;旋转蒸发器(RE-52AA),上海亚龙生化仪器厂;孵化器(DHP-9052),一恒科学仪器有限公司;分光光度计(721G),上海仪电分析仪器有限公司;水浴锅(HHSII-1),上海波迅工业有限公司;发酵罐(BioFlo-CelliGen115),NBS 公司。
1.2 方法
1.2.1 ABFI 和ABFII 的制备
参照SONG Ru,et al[10]方法,ABFI 的制备选用活化后的EM 菌来发酵水产副产物制得。ABFII 的制备选用经筛选过后的发酵菌株(施氏假单胞菌、类芽孢杆菌、黑曲霉、季也蒙念珠菌、枯草芽孢杆菌)对水产副产物进行发酵制得。
1.2.2 抑菌活性测定
参照魏东东等[11]方法,采用琼脂扩散法对发酵液(ABFI,ABFII)和样品A 进行抗菌活性的研究。吸取100 μL 的被测真菌孢子悬浮液(106CFU·mL-1)接种在琼脂平板上。吸取50 μL 不同浓度的ABFI、ABFII 和样品A 溶液加入直径为6 mm 孔中。将真菌培养皿在30 ℃下培养48 h;细菌培养皿在37 ℃下培养24 h,游标卡尺测量抑菌圈直径。高浓度(HC)为样品A、ABFI 和ABFII 初始浓度,低浓度(LC)是初始浓度的一半,通过稀释一倍体积制得。
1.2.3 发酵液的稳定性
本实验考察了发酵液抑菌活性对热和酸碱的稳定性。选用具有抑制效果的致病菌,采用琼脂扩散法,对不同pH 和不同温度热处理的ABFII 的抗菌活性进行了比较。在热稳定性试验中,将ABFII 分别在35、45、55、65、75、85 和95 ℃的水浴中加热处理15~30 min,然后冷却到室温得到热处理样品。在pH 敏感性试验中,用HCl (6 mol·L-1)和NaOH (6 mol·L-1)调整使ABFII 的pH 分别为2、3、4、5、6、7、8、9、10,测定9 个样品的抗菌活性。实验设置3 组平行。
1.2.4 发酵液的化学成分分析
采用茚三酮显色法[12]对ABFI 和ABFII 中的氨基酸进行定量测定,以精氨酸标准样品为校准标准,计算氨基酸浓度。在0.005 4~0.064 0 mg·mL-1范围内,获得了良好的线性关系,回归曲线为y=0.000 3 x-0.007 3(R2=0.992),y 为570 nm 处吸光度,x 为氨基酸的浓度(mg·mL-1),R2为相关系数。发酵液中蛋白质、脂肪、矿物质等均由北京Pony 谱尼测试集团有限公司测定。
1.2.5 盆栽实验
为测试ABFII 作为液体肥料的潜在用途,实验参照范瑛阁等[13]方法,以自来水为空白组,ABFII 为实验组,商业杀虫剂多菌灵为阳性对照组进行盆栽实验,一周后测量蔬菜最大和最小叶片的长度和直径。将自来水、ABFII 和1 g·mL-1的多菌灵喷洒100 mL 在斑点植物的叶子上,24 h 后,接种腐败孢子拟盘多毛孢于叶片上使其受侵染。7 d 后,随机采摘3 个组的叶片,放入30 mL 水的锥形瓶中搅拌1 h,从锥形瓶中吸取100 μL 溶液涂在马铃薯葡萄糖琼脂平板上。平板在30 ℃的恒温培养箱中孵育2 d,观察计数菌落的数量来评价各组抑菌效果。
1.2.6 统计学处理
每次实验重复3 次采用SPSS 22.0 统计软件进行方差分析的显著性检验。
2 结果与分析
2.1 发酵液抗菌活性评价
抗菌实验结果显示3 种发酵液的低浓度组和高浓度组对枯草芽孢杆菌、八叠球菌、沙门氏菌、金黄色葡萄球菌、绿脓杆菌、大肠杆菌均无抑制作用。
图1、2 分别是ABFI 和ABFII 对瓜链格孢菌,齐整小核菌,拟盘多毛孢和核盘菌的抗菌试验。从表1中可以得出样品A 和ABFI 对试验病原菌的增殖没有任何抑制作用,而ABFII 能不同程度地抑制瓜链格孢菌和拟盘多毛孢的增殖,其抑菌圈直径在9~15 mm 之间。

表1 样品A、ABFI、ABFII 的抗真菌实验结果Tab.1 A sample,ABFI,and ABFIII antifungal spectrum

图1 ABFI 抗真菌试验(1-LC,2-HC)Fig.1 ABFI antifungal test (1-LC,2-HC)
图2 ABFII 抗真菌试验(1-LC,2-HC)Fig.2 ABFII antifungal test (1-LC,2-HC)
本实验说明ABFII 在低高浓度时对所测瓜链格孢菌和拟盘多毛孢有明显的抑制作用,浓度越高,抑制效果越明显,同浓度下ABFII 对拟盘多毛孢的抑制更好。而ABFI 只有在高浓度时对瓜链格孢菌有抑制作用。拟盘多毛孢和瓜链格孢菌会让植物得叶斑病,使叶肉组织枯死。SONG Ru[14-15]证实了半鳍凤尾鱼胃蛋白酶水解得到的产物具有很高的抗大肠杆菌的活性。RAJANBABU,et al[16]也报道了鱼类分泌不同种类的天然肽,这些肽参与宿主的防御机制,用来防御由各种微生物引起的疾病,对革兰氏阳性和阴性菌,真菌和病毒都有一定的抑制活性。PAN,et al[17]已经证明了从鱼中提取的抗菌肽-1 对二倍体真菌(白色念球菌Candida albicans)的抗菌作用。许多文献[14-18]证明海产品提取物有抗菌活性这和我们研究ABFII 对拟盘多毛孢和瓜链格孢菌的抑制结果非常相似。然而,样品A 和ABFI 对病原菌的增殖并没有表现出显著的抑制作用,但样品A 的化学组成和ABFII 类似,所以目前样品A 是被用作肥料而不是抗菌剂[19]。EM 菌中的放线菌和乳酸菌可以分解粗纤维等大分子物质,光合细菌可以利用太阳光并且可以吸附重金属。所以常被应用在畜牧业[20-21]和污水处理[22]等方面。故ABFI 缺乏显著的抗菌活性可能是由于水产副产物中能够被EM菌发酵利用的部分较少,没有得到大量有抑制活性的物质,也可能EM 菌发酵过程产生的物质能够中和或变性其生物活性。
在3 种发酵方式中,只有ABFII 在低高浓度都对所测瓜链格孢菌和拟盘多毛孢有明显的抑制作用,而ABFI 只有在高浓度时对瓜链格孢菌有抑制作用,从表4 数据中猜测可能是由于ABFI 中蛋白质含量较低,所以猜测抑菌成分与蛋白质有关,因此选择抑菌效果较好的ABFII 测定其热稳定性和pH 敏感性并进行盆栽试验。
2.2 ABFII 的稳定性
为了确定发酵液ABFII 抑菌活性的稳定性,本文考察了不同温度和pH 对其抑菌活性的影响。
2.2.1 ABFII 的pH 敏感性
室温下测定了ABFII 在不同pH 下的抑菌稳定性。从表2 可以看出在pH 为3 和4 时ABFII 对拟盘多毛孢的抑制作用最强,抑制圈直径为20 mm,在pH 为2、5 和6 时,也表现出较强的抑制效果,抑菌圈直径为10~12 mm。ABFII 对瓜链格孢菌的抑制效果随pH 的增大呈现出先增大后减小的趋势,在pH 为3 时,抑制效果最强,抑制圈直径为14 mm,pH 为6 时,抑制效果最弱,抑制圈直径为9 mm。以不同pH 的蒸馏水作为空白组,发现不同pH 的蒸馏水对拟盘多毛孢和瓜链格孢菌的增殖没有任何抑制作用。可见,ABFII的抑菌活性受pH 的影响,在pH 为4 时,对拟盘多毛孢和瓜链格孢菌的抑制作用最强。而在中性和碱性环境下,ABFII 对拟盘多毛孢和瓜链格孢菌没有抗真菌活性。

表2 不同pH 下ABFII 的稳定性研究Tab.2 Stability of ABFII at different pH values
2.2.2 ABFII 在pH 6.12 时热稳定性
从表3 可以看出,当温度小于65 ℃时,加热发酵液15 或30 min,对拟盘多毛孢和瓜链格孢菌的抑菌圈直径范围分别为10~15 mm 和9~13 mm,说明ABFII 在温度低于65 ℃时对拟盘多毛孢和瓜链格孢菌的抗真菌活性没有影响。而当温度高于75 ℃以后,加热发酵液15 或30 min,它就失去了抗真菌能力。

表3 ABFII 对热的敏感性Tab.3 Sensitivity of ABFII to heat
热稳定性试验和pH 敏感性试验表明:pH 和温度对水产副产物发酵液的稳定性有重要影响。GOUTEFONGEA,et al[23]证明pH 高于5.8 时对溶液中蛋白质在热变性具有保护作用,本实验在pH 为6.12的条件下进行。CHARPENTIER,et al[24]还表明,在pH 低于5.8 且温度高于40 ℃时,蛋白质在溶液中的变性非常明显。ABFII 抗菌化合物的显著热变性仅在75 ℃以上时可以观察到,pH 高于5.8 是一个决定因素,其次短暂的加热时间也可能是一个决定因素。
pH 影响微生物增殖可以作用于以下几个因素:蛋白质残基(或肽残基)的电离,蛋白质的三级结构和稳定性,作为短链蛋白质,抗菌肽具有pH 敏感特性等[25]。据报道,大多数已知的抗菌肽是阳离子的,它们的作用机制与它们的阳离子特性和在溶液中与目标磷脂膜接触时适应两亲性结构的能力有关[26]。增加肽的正电荷从而提高其抗菌和溶血活性[27-28],相反,肽正电荷的减少导致抗菌活性的丧失。MATSUZAKI,et al[28-29]也证实正电荷的减少会导致静电相互作用力的减少,然后被疏水相互作用所取代。事实上,这和我们的发酵液ABFII 在酸性条件下对拟盘多毛孢和瓜链格孢菌具有抗菌活性,在碱性条件下,ABFII 的抗菌活性丧失的结论一致。从ABFII 的抗菌混合物对温度和pH 敏感实验中可以预测其活性物质是肽,对此需要更加深入的研究。
2.3 发酵液的化学组成
表4 显示发酵液样品A、ABFI 和ABFII 的化学成分。结果表明,ABFII 和样品A 的化学成分相近。ABFI 中部分化学成分含量比ABFII 和样品A 要少的多。

表4 不同发酵液的化学成分Tab.4 Chemical composition of the different fermented liquid
从发酵液化学组成实验结果可以看出利用发酵菌株发酵的水产加工副产物的蛋白质,游离氨基酸,脂肪和氮磷钾含量已和市售有机液肥含量接近,矿物元素镁铁的含量甚至超过市售肥料,钙硫硼锰铜钼的含量接近市售肥料。不仅提高了水产加工副产物的利用率,减少环境污染,甚至还可以替代市售肥料,提高经济效益。EM 菌发酵的水产加工副产物的脂肪,碳水化合物和氮磷钾含量和样品A 的含量接近,其余成分的含量相差较大。样品A 和ABFII 的化学成分接近,活性相差巨大,可能是由于ABFII 所用筛选的菌株能够产具有活性的功能物质,和发酵液稳定性试验结果预测相同。
2.4 盆栽试验结果
图3 是分别用自来水空白组和ABFII 实验组培养的甘蓝型油菜。从图3 可以看出,ABFII 培养的油菜叶片比空白组培养的明显肥大。从图4 可以看出,与空白组相比,以ABFII 作为肥料的油菜最大叶片的长度比空白组长1 cm,直径大2 cm;最小叶片的长度和直径都比空白组叶片大0.5 cm,说明ABFII 能够促进植物生长,具有一定的肥力。这和KIM[6]证明鱼的废弃物用作液体肥料有非常大的潜力的结果一致。从图5 可以看出,和用自来水处理的甘蓝型油菜相比,用多菌灵处理的油菜叶片中残留的拟盘多毛孢数量很少,抑制率达到99%,用ABFII 处理后,抑制率达到95%。
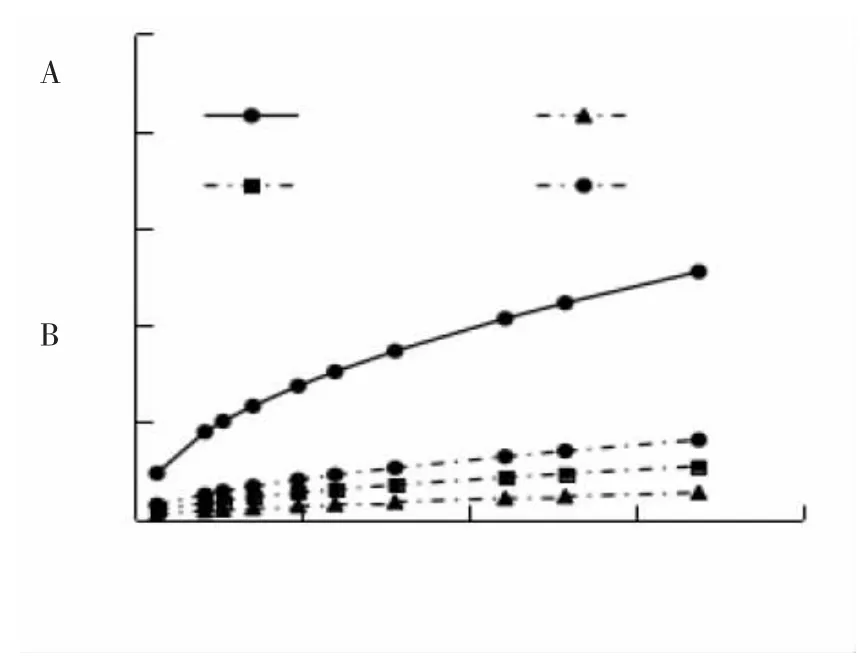
图3 ABFII 对植物生长的促进作用Fig.3 In vitro plant growth promotion effects of ABFII
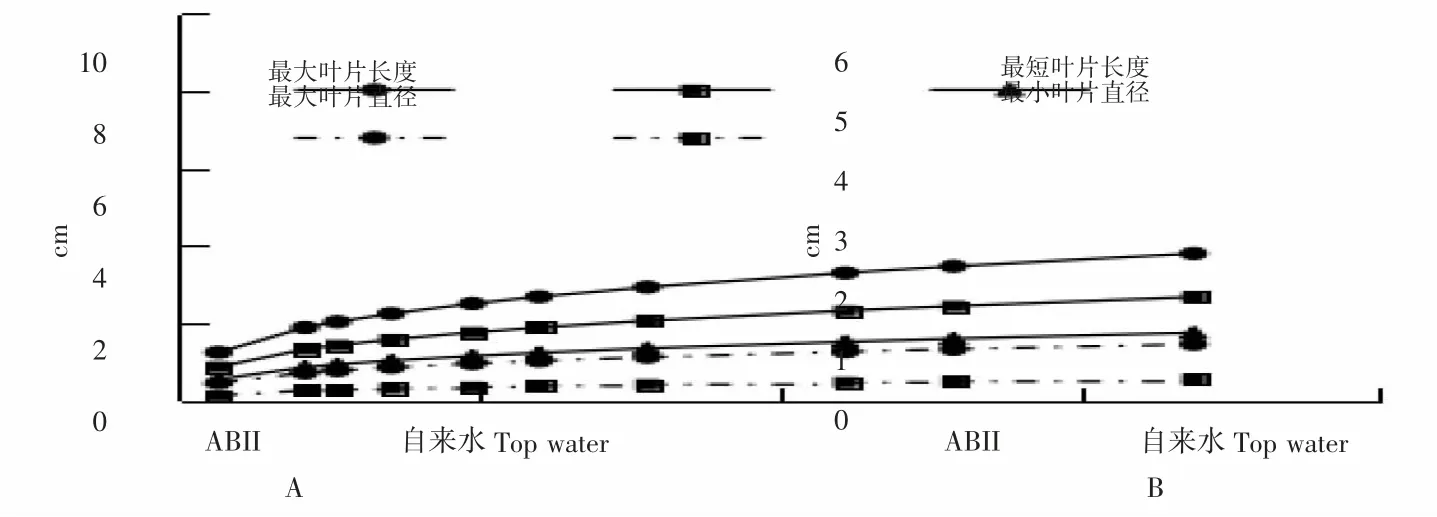
图4 ABFII 处理1 周后,A.蔬菜最大叶片的长度和直径;B.蔬菜最小叶片的长度和直径Fig.4 After one week treatment with ABFII,A.The lengths and diameters of vegetable the biggest leaves;B.The lengths and diameters of vegetable the smallest leaves

图5 残留真菌的微生物检验Fig.5 Microbiological test of the fungi remaining
盆栽实验表明经过ABFII 处理的蔬菜叶片较空白组有明显的促生长作用,在叶片长度和直径方面都有明显效果。ABFII 不仅提供了大量有利于土壤中微生物分解的小分子物质,还保留原料中植物生长所必需元素,包括必需大量氮磷钾元素和镁钙硼锰等必需微量元素,促进植物的生长[30]。同时各组叶片的真菌培养表现出ABFII 中生物活性物质可以有效抑制油菜上拟盘多毛孢的增值,接近商业杀虫剂的抑制率。这为开发天然农药提供理论基础,为园艺发展带来巨大的进步。
3 结论
在3 种水产副产物的发酵液中,只有ABFII 对拟盘多毛孢和瓜链格孢菌显示出抗菌活性。蔬菜盆栽试验也表明,ABFII 不仅具有一定的肥力,促进植物的生长,还可被用于开发成为一种天然生物农药,在园艺中作为化学农药的替代品。

