PAA、CAR及联合APACHE Ⅱ评分对重症急性胰腺炎的预测价值
杜乔慧 吴克俭 王争争
急性胰腺炎(acute pancreatitis,AP)是内科系统最常见的急腹症之一,约20%的AP患者会进展为重症急性胰腺炎(severe acute pancreatitis,SAP),后期可能发展为全身性炎症反应综合征(systemic inflammatory response syndrome,SIRS),并伴有多器官损伤,最终导致多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),更严重者出现多器官衰竭(multiple organ failure,MOF),是该病死亡的主要原因[1]。AP的总体病死率为5%,若发生感染性坏死,病死率将更高[2]。早期评估患者预后,对可能进展为SAP的高危患者密切监测,采取及时有效治疗,将有助于降低AP的总体病死率。目前已建立了多种用于SAP早期预测的生物学标志物经典评分系统,如CRP、PCT、IL-6、APACHE Ⅱ评分、Ranson评分系统、BISAP评分。但这些生物学标志物及评分系统往往相关性、特异性、敏感度不高,因此,寻找一种理想的指标来早期识别重症患者是非常重要的。
对象与方法
1.研究对象:选取2018年10月~2021年3月,在徐州医科大学附属医院确诊为AP的176例患者。其中男性119例,女性57例,患者年龄20~85岁。诊断标准:按照2012年亚特兰大修订的AP诊断标准,至少符合以下3项特征中2项:①与AP一致的腹痛(急性发作的持续性、严重的上腹部疼痛,通常放射至背部);②血清脂肪酶(或淀粉酶)至少是正常上限的3倍;③急性胰腺炎的造影增强CT或磁共振成像或经腹超声检查的特征性表现[3]。
2.纳入与排除标准:纳入标准:①临床符合2012年亚特兰大修订的AP诊断标准,并确诊为AP患者;②年龄≥18岁;③发病至入院时间≤24h且住院时间>48h。排除标准:①妊娠和哺乳期女性;②糖尿病酮症酸中毒;③合并终末期恶性肿瘤、血液病等;④慢性胰腺炎或胰腺炎清创术后患者;⑤既往有严重急慢性心血管疾病患者,入院前已存在慢性器官衰竭患者;⑥使用已知可引起C反应蛋白(CRP)、血清白蛋白(ALB)、凝血酶原时间活动度(PTA)、血小板(PLT)、淋巴细胞(LY)水平变化的药物,如抗生素、抗凝、抗血小板聚集药物;⑦发病前1个月内有免疫抑制剂、激素药物服用史的患者;⑧入院48h内即死亡的患者[4,5]。
3.分组方法:根据2012年亚特兰大修订的AP分级标准,诊断为轻症急性胰腺炎(mild acute pancreatitis,MAP)组92例,中度重症急性胰腺炎(moderately severe acute pancreatitis,MSAP)组39例和重症急性胰腺炎(severe acute pancreatitis,SAP)组45例[3]。另根据是否合并有持续性器官衰竭(persistent organ failure,POF)(器官衰竭>48h),分为SAP组45例和非SAP组(MAP与MSAP患者)131例。收集患者的相关资料,主要包括年龄、性别、吸烟史、饮酒史、体重指数[BMI,BMI =体重(kg)/身高2(m2)]、发病原因(胆源性、酒精性、高甘油三酯性、特发性)、高血压病史、糖尿病病史、其他慢性基础疾病史(吸烟史:连续或累积吸烟超过 6 个月以上[6];饮酒史:发病24h内仍存在半年以上的饮酒行为)。发病24h内及发病后48h的PTA、ALB、CRP、PLT、LY,计算PAA、CAR、PLR,进行APACHE Ⅱ评分。

结 果
1.MAP、MSAP、SAP组患者一般情况和临床资料比较:3组患者间年龄、性别、病因、BMI、有无烟酒、有无高血压、有无糖尿病及PLR0、PLR1比较,差异无统计学意义。3组患者间发病24h内和发病48h后的CAR、PAA(CAR0、CAR1、PAA0、PAA1)及APACHE Ⅱ评分比较,差异有统计学意义(P<0.05,表1)。
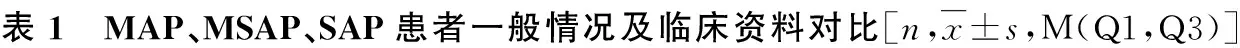
2.非SAP组与SAP组一般情况和临床资料比较:两组患者间年龄、性别、病因、BMI、有无烟酒、有无高血压、有无糖尿病及PLR0、PLR1比较,差异无统计学意义;两组患者间CAR0、CAR1、PAA0、PAA1及APACHE Ⅱ评分比较,差异有统计学意义(P<0.05,表2)。其中,SAP组的CAR0、CAR1、APACHEⅡ评分均高于非SAP组,PAA0、PAA1显著低于非SAP组。
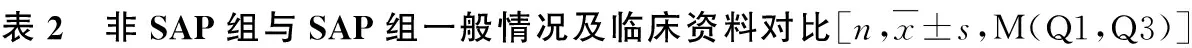
3.各项指标与SAP组相关性比较:PAA1、APACHEⅡ评分、CAR1+PAA1联合预测因子、CAR1+APACHEⅡ联合预测因子、PAA1+APACHEⅡ联合预测因子与SAP组有显著相关性,相关系数r依次为-0.524、0.535、0.548、0.577、0.593。其中PAA1与SAP组呈负相关,APACHEⅡ评分、CAR1+PAA1联合预测因子、CAR1+ APACHEⅡ联合预测因子、PAA1+ APACHEⅡ联合预测因子与SAP呈正相关(P<0.05,表3)。
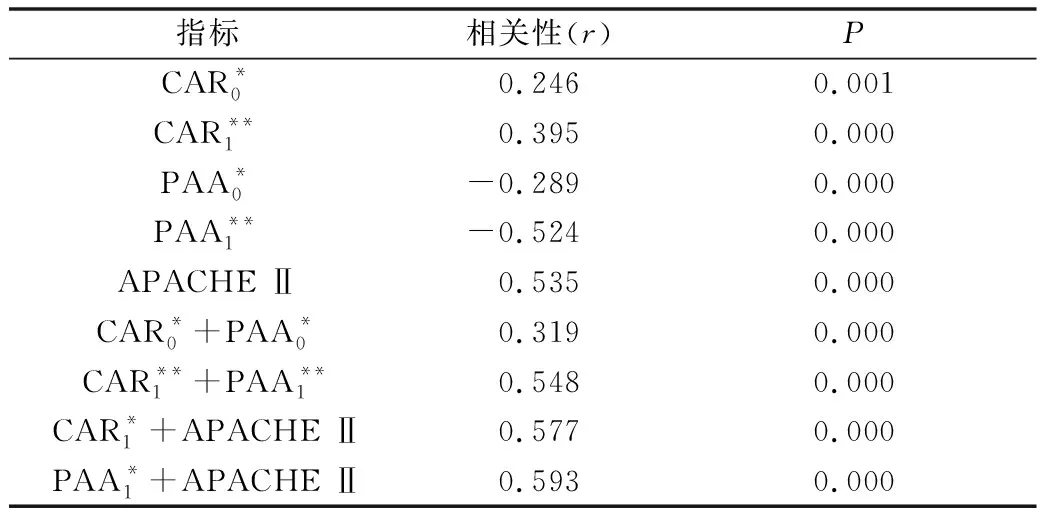
表3 CAR、PAA、APACHE Ⅱ及联合预测因子与SAP的相关性
4.Logistic回归分析筛选SAP组患者的危险因素:以是否为SAP组患者作为因变量,将单因素Logistic回归分析中的显著影响因素作为自变量,进行多因素二元Logistic回归分析结果显示,PAA1、APACHEⅡ评分为SAP组的独立危险因素,其余指标均为显著影响因素(P<0.05,表4)。
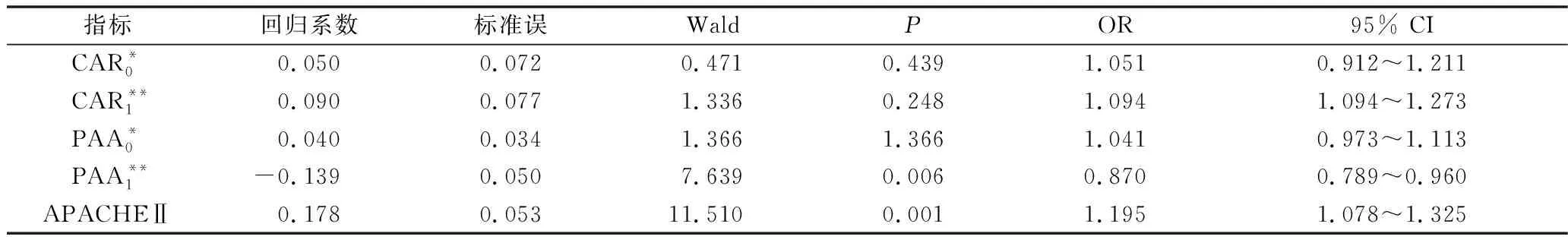
表4 多因素二元Logistic回归分析
5.ROC曲线评估各项指标对SAP组的预测价值:ROC曲线显示,CAR0、CAR1、PAA0、PAA1、APACHE Ⅱ评分、CAR1+PAA1联合预测因子、CAR1+APACHE Ⅱ联合预测因子、PAA1+APACHEⅡ联合预测因子对SAP组均有一定的预测价值。曲线下面积(area under the curve,AUC)从大到小依次为:PAA1+APACHEⅡ、CAR1+APACHEⅡ、CAR1+PAA1、PAA1,面积分别是0.892、0.882、0.863、0.857。Youden指数计算得出以下结果,单项指标中,敏感度最高的为PAA1,其次是APACHE Ⅱ评分。特异性最高的是CAR1和APACHE Ⅱ评分,特异性均为82.2%,其次是PAA1;联合预测因子的敏感度和特异性均较单项指标优异,PAA1+APACHE Ⅱ敏感度最高,CAR1+APACHE Ⅱ特异性最好,联合评估将提高对SAP组的预测价值(P<0.05,图1~图3,表5)。
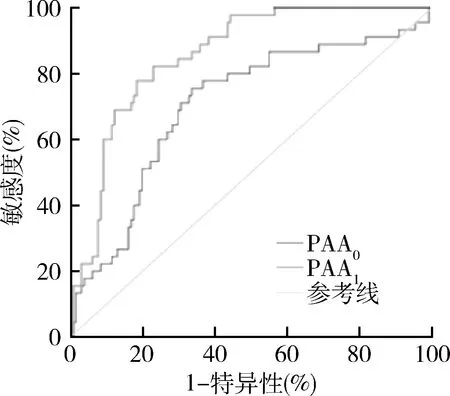
图1 PAA0、PAA1的ROC曲线较小的检验结果表示更加肯定的检验
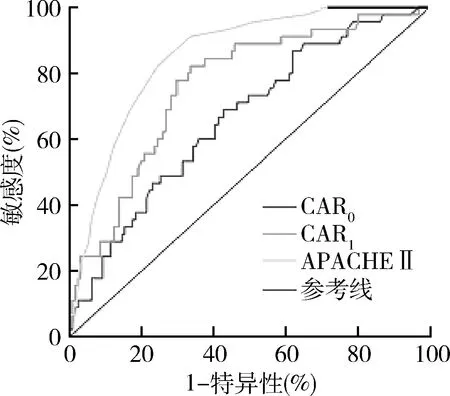
图2 CAR0、CAR1、APACHEⅡ的ROC曲线较大的检验结果表示更加肯定的检验
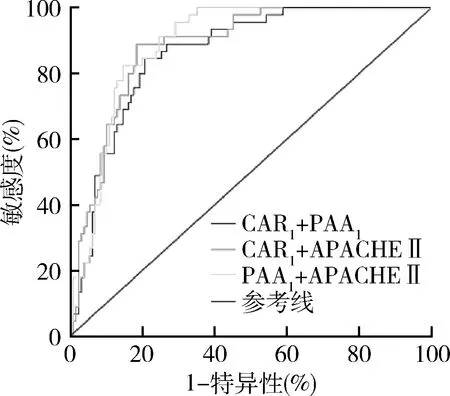
图3 联合预测因子的ROC曲线较大的检验结果表示更加肯定的检验

表5 CAR、PAA、APACHE Ⅱ及联合预测因子ROC分析结果
讨 论
急性胰腺炎是胰腺组织自身消化所致的胰腺水肿、出血及坏死等炎症性损伤。胆石症及胆道感染仍是主因,其次是酒精性AP。近年来由于国人饮食习惯改变,高甘油三酯血症导致的AP发生率上升,有超越酒精性AP的趋势,当血清甘油三酯≥11.3mmol/L时,极易发生AP,且易继发急性肾损伤(acute kidney injury,AKI)[7,8]。此外还有药物、手术导致的AP。病理生理基础与钙信号异常触发、胰蛋白酶原过早激活、内质网应激反应与未折叠蛋白反应受损和自噬受损有关[9]。尽管在诊断和治疗方面已经取得了进展,但仍有不少患者发展为SAP,需长期住院、重症监护和侵入性干预,甚至死亡,早期判断患者预后至关重要。
PTA是反映肝脏凝血功能和储备功能好坏的重要指标,正常活动度为70%~120%。当胰腺组织损伤时,机体释放组织因子、炎性介质等,其中最重要的是氧自由基和中性粒细胞弹性蛋白酶(polymorphonuclear granulocyte-elastase,PMN-E),促使血液呈高凝状态,纤维蛋白降解产物(fibrin degradation product,FDP)生成增多,大量消耗凝血因子,纤溶亢进,导致凝血和纤溶系统失衡,血液从高凝状态转变为低凝状态,导致微循环障碍,PTA降低[10,11]。SAP患者ALB消耗增加,低白蛋白水平被证明与POF、AP的1年内病死率有明显统计学相关性[12]。PAA为PTA与ALB的乘积,Li等[13]研究认为,PAA随病情加重而显著降低,特别是合并有器官衰竭的患者,此外,PAA还是AP加重的独立危险因素。本研究的相关性检验及Logistic回归分析显示,PAA1与SAP有显著负性相关,为SAP的独立危险因素。将PAA1与APACHE Ⅱ评分联合,联合预测因子在敏感度、特异性上均较PAA1及APACHE Ⅱ评分更高。
CRP是肝脏合成的正性时相蛋白,在AP症状出现的第一个48h内,以150mg/dl为临界值,预测坏死性急性胰腺炎的敏感度和特异性均>80%,且不易受抗生素、激素及免疫抑制剂干扰[14]。ALB为负性时相蛋白,具有一定的抗炎作用,当合并SIRS时,将加快ALB的分解以抵御炎性反应。CAR为CRP与ALB的比值,目前已用于预测各种疾病预后,如脓毒症、溃疡性结肠炎、恶性肿瘤等[15,16]。Stirling 等[17]AD通过病例对照研究证实CAR是AP患者总生存率的独立预测指标,可用于评估AP患者的预后。部分研究认为CAR为AP病死率的独立危险因素[4]。本研究经相关性检验证明,CAR0和CAR1与病情严重程度有较低的相关性;CAR1特异性为82.2%,CAR1与PAA1,CAR1与APACHE Ⅱ评分联合将进一步提高特异性。
PLT由骨髓造血组织中的巨核细胞产生,参与凝血过程。SAP患者凝血-纤溶系统失衡,出现微循环障碍,血小板破坏分解增加,PLT下降。AP病情进展时,机体获得性免疫系统(adaptive immune system)被激活,而淋巴细胞是免疫应答的主要细胞成分。随着感染加重,大量淋巴细胞凋亡引起机体免疫抑制,无法有效调动特异性免疫抵抗感染。PLR为PLT与LY的比值,是一种炎性指标,可以直观反映机体炎性状态和免疫水平。有研究指出,PLR可作为AP病情严重程度的预测指标[18]。Cho 等[19]研究认为,PLR为胆源性AP患者发生POF的独立危险因素。但一项109500例患者的回顾性研究未发现PLR与AP病情严重程度相关[20]。本研究经组间差异性检验发现差异无统计学意义(P>0.05),即PLR0和PLR1与AP病情严重程度无关,不能作为SAP预测指标。
综上所述,PAA1是SAP发生的独立危险因素,与病情严重程度呈显著负相关关系。将PAA1与APACHE Ⅱ评分联合、PAA1与CAR1联合将提高对SAP诊断的特异性和敏感度。CAR0、CAR1、PAA0对SAP均有中等程度的预测价值。本研究的局限性在于研究的回顾性、单中心设计可能会导致选择偏差。此外,样本量少、部分临床数据不全的患者没有纳入研究,可能导致数据分析不完整,因此今后需要开展前瞻性、多中心研究和增加样本量予以验证本研究的结论。

