高血压患者慢波睡眠时长与夜间血压水平的相关性
洪 静 姚晓光 卢 山 周克明 陈 梦 汪迎春 李南方
人类的睡眠分为快速眼动睡眠(rapid eye movement,REM)和非快速眼动睡眠(non-rapid eye movement,NREM),NREM进一步分为N1期、N2期和N3期睡眠(也称为慢波睡眠,SWS),其中SWS对于促进生长、缓解疲劳和恢复体力起着非常重要的作用[1]。在整个慢波睡眠中,以副交感神经活动为主的睡眠阶段,可引起心率减慢,血压降低,胃肠活动增加,全身肌肉松弛,但没有张力和活力[2]。
夜间血压非杓型或降低不明显是近年来新发现的心血管疾病的危险因素,其定义为夜间血压相对于白天血压下降不到10%[3]。一项纳入10项共17312例参与者的Meta分析表明,夜间血压未下降的高血压患者发生脑卒中、心血管疾病相关死亡和全因死亡的风险增加[4]。
既往在健康成年人的观察研究和血压正常的青年人群的实验研究中发现SWS慢波睡眠减少与夜间平均动脉压升高有关[5,6]。进一步研究表明,睡眠结构与夜间血压相关,其中SWS与夜间最低的血压有关[7]。同样,慢波睡眠不足睡眠总量4%的老年人患高血压的风险会提高80%[8]。Zhou等[9, 10]研究显示,慢波睡眠占睡眠时间的百分比与高血压发生率呈负相关,与中等水平的N3期睡眠(与“正常”范围重叠)比较,较低的N3期睡眠百分比与男性和女性高血压发生率增加均有关,且独立于睡眠呼吸暂停和睡眠碎片指数等混杂因素。
综上所述,尽管上述研究均显示SWS与夜间血压存在相关性,且增加发生高血压风险,但研究对象多为健康成年人或正常血压人群,高血压人中SWS与夜间血压水平的相关性尚需探讨。本研究拟通过分析高血压人群睡眠结构与夜间血压水平的关系,为治疗高血压患者提供更多的参考。
对象与方法
1.研究对象:连续纳入2019年9~11月年龄18岁以上就诊于新疆维吾尔自治区人民医院高血压中心的住院患者201例,其中男性140例,女性61例,平均年龄为48.4岁。高血压的定义参照《中国高血压防治指南2018年修订版》,即在未使用降压药物的情况下,非同日3次测量诊室血压,SBP≥140mmHg(1mmHg=0.133kPa)和(或)DBP≥90mmHg。患者既往有高血压史,目前正在使用降压药物,血压虽然低于140/90mmHg,仍应诊断为高血压[11]。排除以下情况:①急性心脏、脑血管病患者;②有脑部肿瘤、颅脑外伤或癫痫病史;③近期(3个月内)或正在使用催眠药、抗抑郁药、抗焦虑药或抗精神病药;④合并各种精神及心理疾病的患者;⑤严重心肾功能不全患者;⑥合并失眠或睡眠障碍者;⑦拒绝或不耐受整夜多导联睡眠监测和动态血压监测的患者。本研究经新疆维吾尔自治区人民医院医学伦理学委员会批准,所有研究对象均签署知情同意书。
2.一般资料收集:包括患者年龄、性别、个人史(吸烟、饮酒情况)、身高、体重和腹围等。24h动态血压监测:参考《动态血压监测临床应用中国专家共识》,采用无创性便携式动态血压仪(美国Spacelab90217),缚于非优势上臂,使用振荡法自动监测,设定日间(8:00至23:00时)每20min自动充气测量1次,夜间(23:00至次日8:00时)每30min自动充气测量1次,记录并储存所测血压值。有效数据定义为夜间血压监测期间有效读数≥80%[12]。
3.多导联睡眠监测(PSG):所有患者在无干扰的单人睡眠室内接受夜间至少连续7h以上的睡眠监测(采用澳大利亚康迪公司Compumedics-E系列)。监测前禁饮用茶、咖啡等饮料,避免使用镇静催眠药物。记录总睡眠时间、睡眠效率、睡眠结构(N1期睡眠、N2期睡眠、N3期睡眠和快速眼动睡眠时相)、睡眠呼吸暂停低通气指数(AHI)、最低氧饱和度(LSaO2)和平均氧饱和度(MSaO2)等指标。睡眠分期参照《美国睡眠医学会判读手册(2014年)》进行睡眠分期和睡眠呼吸事件等参数的判读,AHI>5诊断为睡眠呼吸暂停综合征(SA)[10]。
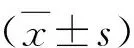
结 果
1.一般资料比较:两组患者平均年龄、BMI、入院血压、心率、腰围及Epworth评分比较差异均无统计学意义,此外两组吸烟、饮酒、阻塞性睡眠呼吸暂停(OSA)及服用降压药物的患者百分比比较,差异无统计学意义。但SWS构成比>9%的男性患者所占百分比略高于SWS构成比≤9%(79.0% vs 77.2%,P=0.041),详见表1。

2.不同慢波睡眠构成比患者夜间血压水平和睡眠相关参数的比较:SWS构成比≤9%患者夜间平均收缩压(SBP)、舒张压(DBP)水平以及夜间SBP异常读数百分比均明显高于SWS构成比>9%的患者,差异有统计学意义(P均<0.05)。两组患者总睡眠时间、睡眠1期和快动眼睡眠时期百分比比较,差异无统计学意义(P>0.05),但是SWS构成比>9%患者AHI、睡眠2期明显小于SWS构成比≤9%患者,而平均氧饱和度(MSaO2)和最低氧饱和度(LSaO2)却明显增高(P<0.05),详见表2。

3.夜间血压水平与睡眠参数的相关性分析:Pearson简单线性相关分析发现,夜间收缩压(r=0.23,P=0.001)和舒张压(r=0.19,P=0.009)均与AHI呈正相关,而SWS与AHI呈负相关(r=-0.034,P=0.000),夜间舒张压与年龄呈负相关(r=-0.28,P=0.000)。校正年龄后,夜间舒张压与SWS呈负相关(r=-0.137),但是P值仅达到临界值(P=0.054)。
4.夜间血压和相关风险因素的多因素Logistics回归分析:分别将夜间SBP是否>130mmHg和夜间DBP是否>80mmHg作为因变量,以性别、年龄、BMI、是否合并OSA和SWS构成比是否>9%为自变量构建Logistic回归模型。总体人群中,校正年龄、BMI、性别和是否合并OSA后,与SWS构成比>9%比较,SWS构成比≤9%可以使夜间DBP>80mmHg的风险增加1.38倍(OR=2.38,95%CI:1.25~4.27,P=0.008),但是并未发现SWS构成比≤9%与夜间较高的SBP相关。除此之外,相比女性,男性是夜间SBP和DBP偏高的风险因素。但是并未发现OSA夜间血压水平偏高有关,详见表3。

表3 夜间血压和相关风险因素的Logistic回归分析
讨 论
睡眠障碍不仅通过扰乱睡眠、增加觉醒次数并且随着N3期睡眠(慢波睡眠)的减少改变交感-副交感神经系统平衡,进而改变睡眠生理,引发交感神经过度活跃,从而导致血压升高[13~15]。本研究在高血压人群中发现SWS相对较短(≤9%)的患者比SWS较长的患者夜间平均SBP和DBP水平均明显升高,且男性是夜间血压水平相对增高的风险因素。
既往研究报道,与单纯高血压组及OSA组比较,OSA伴高血压组慢波睡眠期(SWS)占总睡眠时间的比例显著减少[16]。而国内另一项小样本的研究发现,年龄增加、OSAHS(55.6%)、镇静催眠药物的使用可能是影响慢波睡眠的相关因素[17]。本研究中虽然发现夜间血压水平与AHI存在相关,但是相关系数较小,进一步将年龄、性别、BMI和SWS时长等因素综合考虑后,未发现OSA与夜间血压水平较高有相关性,虽然本研究中80%以上患者合并不同程度的OSA,但是不同SWS两组间OSA患病率是相匹配的,所以未观察到OSA与夜间血压明显的相关性。
既往研究证明,由于频繁的异常呼吸事件及其对睡眠结构的影响,OSA患者的SWS数量减少[18,19]。为探讨SWS百分比能否改变OSA与高血压的关系,一项7107例OSA患者和1118例经过实验室多导睡眠图检查的原发性打鼾者中的研究发现,SWS降低与OSA患者高血压发生率更高相关,而在原发性打鼾者中则不相关。而且OSA和SWS对高血压患病率具有显著的交互作用,提示SWS的效应很可能受到OSA严重性的调节[20]。有研究表明,夜间血压长期升高可能导致白天血压持续升高,或者通过交感-副交感神经张力的持续变化或通过引起血管损伤,这被认为是夜间高血压、睡眠呼吸障碍和日间高血压之间的联系[21]。
本研究纳入人群为高血压人群,超过75%的患者正在服用降压药物,而且80%左右患者合并不同程度的OSA,但是仍发现SWS减少与夜间舒张压高存在相关性,提示降压治疗中酌情使用延长慢波睡眠的药物可能有助于控制夜间血压,但是该结果尚需进一步验证。综上所述,高血压人群中慢波睡眠减少与夜间舒张压水平较高具有相关性。

