TTF-1/p40共表达低分化非小细胞肺癌1例并文献复习
李 惠,谢 玲,黄玉洁,孙 怡,章宜芬
肺癌病死率位居全球恶性肿瘤的首位[1]。晚期患者往往失去手术机会,只能通过肺穿刺或支气管镜活检标本取得病理结果。免疫组化检测在低分化肺癌分类中具有重要作用,其中鉴别肺腺癌和鳞状细胞癌最特异的指标是TTF-1和p40[2]。如果一种肿瘤细胞群表达TTF-1,另一种肿瘤细胞群表达p40,则提示为腺鳞癌的可能性。然而,对于同一肿瘤细胞群同时弥漫表达TTF-1和p40的非小细胞肺癌(non-small cell lung cancer, NSCLC)的诊断经验较少。本文现报道1例TTF-1和p40弥漫共表达低分化NSCLC,并进行二代测序,结合文献探讨其临床病理学特征、免疫表型、诊断及鉴别诊断等,旨在提高对该类肿瘤的认识水平。
1 材料与方法
1.1 临床资料患者女性,58岁,无吸烟史,2019年8月因咳嗽半年余在外院行CT检查示左上肺占位,考虑肺癌可能;两肺多发结节、纵隔淋巴结增大,考虑转移可能。颅脑MRI检查考虑右侧额叶转移。全身骨扫描考虑T2、T3椎体转移。行纤维支气管镜活检,病理检查示非小细胞肺癌(non-small cell lung cancer, NSCLC),结合免疫组化结果考虑为肺低分化腺癌。行“培美曲塞0.75 g+卡铂0.55 g”化疗6个周期,过程顺利。化疗后CT检查示左上肺病灶较前稍饱满,肺内转移灶较前相仿,多发骨转移较前稍显硬化。MRI检查示右侧额叶转移灶退缩。后行“培美曲塞0.75 g”方案化疗,化疗后复查CT,显示左上肺病灶、左下肺部分转移灶较前增大(图1)。遂行左肺上叶和左肺下叶基底段纤维支气管镜活检,送常规病理检查及二代测序。
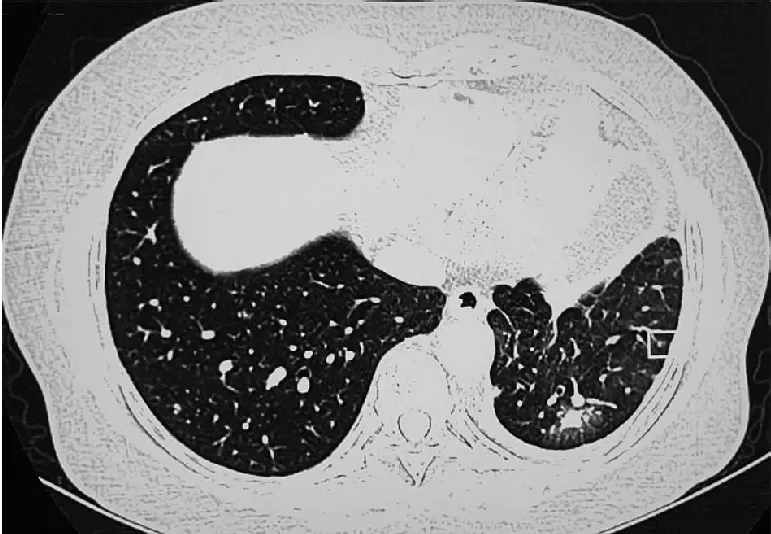
图1 CT示左肺占位
1.2 方法标本经10%中性福尔马林固定,常规脱水、石蜡包埋,3~4 μm厚切片,免疫组化染色采用EnVision两步法,一抗包括TTF-1、p40、NapsinA、CK5/6、ALK(D5F3)、PD-L1(22C3)、Syn、CgA、CD56、p53和Ki-67,其中ALK(D5F3)购自罗氏诊断产品公司,PD-L1(22C3)购自Dako公司,其余一抗及二抗购自福州迈新公司。
2 结果
2.1 眼观(左肺上叶活检标本):条索状组织3枚,长0.5~0.8 cm,直径0.1 cm;(左肺下叶基底段活检标本):灰白、灰红色组织4枚,1枚最大径0.2 cm,3枚条索状组织,长0.5~0.8 cm,直径0.1 cm。
2.2 镜检肿瘤细胞呈实体型生长,无明显的腺样结构,无角化,细胞梭形、多角形,胞质嗜酸性,核分裂象易见(图2)。
2.3 免疫表型肿瘤细胞TTF-1(图3)、p40(图4)、NapsinA和CK5/6均弥漫阳性,p53突变型阳性,Syn、CgA、CD56和ALK(D5F3)均阴性;PD-L1(22C3)TPS评分为30%;Ki-67增殖指数约70%。
2.4 基因检测二代测序结果显示EGFR基因第19外显子非移码缺失突变:c.2239_2256delTTAAGAGAAG CAACATCT(p.L747_S752del)(图5);TP53基因第5外显子错义突变:c.403T>C(p.C135R)(图6)。

图5 基因二代测序结果显示EGFR基因第19外显子非移码缺失突变
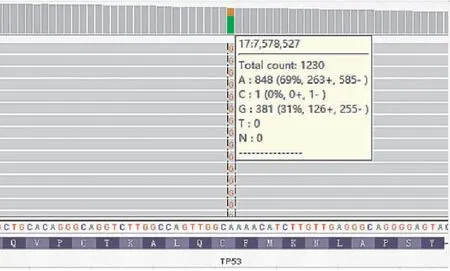
图6 TP53基因第5外显子错义突变
2.5 病理诊断肺低分化癌,结合免疫组化,考虑为TTF-1/p40共表达低分化NSCLC。
2.6 随访本例患者因肿瘤晚期无法行手术切除,化疗6个周期后培美曲塞维持治疗,目前状态尚可。
3 讨论
以往肺癌的病理诊断主要依据镜下形态学,但由于形态学诊断和免疫组化诊断具有差异性,并且对于低分化的肿瘤其形态学往往无法提示分化方向。因此,WHO(2015)肺、胸膜、胸腺和心脏的肿瘤分类作出了重要改变,将免疫组化作为肿瘤分类的依据。肺腺癌常用的免疫组化指标有TTF-1和NapsinA,鳞状细胞癌的免疫组化指标包括p63、ΔNp63/p40(本文简称p40)和CK5/6。对于形态学不能提示分化方向的非小细胞癌,如果TTF-1阳性,则肿瘤应被重新分类为NSCLC,倾向腺癌,无论是否同时表达鳞状细胞癌的标记。由于p40的特异性高,其弥漫阳性强烈提示鳞状细胞癌分化。目前的NSCLC诊断流程中,并未明确指出TTF-1/p40共表达的病例该如何进行诊断。本例活检标本病理结果显示癌细胞TTF-1和p40弥漫共表达,提示肿瘤细胞同时显示腺细胞和鳞状细胞的分化,对这样的肿瘤如何进行诊断?诊断“肺低分化腺癌”“NSCLC,具有腺癌和鳞状细胞癌的免疫表型”又或者“NSCLC-NOS”?ASLC/ATS/ERS联合制定的小标本肺癌国际多学科分类标准中建议:在低分化癌的小活检标本中,应尽量将NSCLC作进一步更细致的分类,尽量少使用“NSCLC”或“NSCLC-NOS”等术语,对于此种类型应在光镜下或采用特殊染色继续进行分类。由于NSCLC中鳞状细胞癌和非鳞状细胞癌的治疗方案不同,如何精准诊断将影响临床选择进一步的治疗方案。
目前国外有4篇文献报道了TTF-1/p40共表达低分化NSCLC[3-6]。2015年Pelosi等[3]报道1例77岁吸烟男性患者,左侧肺门活检标本形态学显示低分化NSCLC伴局部区域鳞状分化,并提出将这种TTF-1/p40共表达低分化NSCLC归类在“腺鳞癌”或具有腺鳞免疫表型的NSCLC。基因检测显示KRAS和TP53突变及FGFR扩增。患者入院后1个半月死亡。作者推测这种TTF-1/p40共表达NSCLC可能起源于某些特殊的原始干细胞,从而导致低分化和多表型。但研究结果显示该类肿瘤并不表达SALL-4和Oct-4等原始干细胞标志物。2018年Hayashi等[4]报道1例73岁吸烟男性患者,行左上肺叶切除,患者有右上肺叶大细胞神经内分泌癌和鳞状细胞癌病史,左上肺叶肿瘤组织形态学显示低分化NSCLC伴局部腺样分化,其二代测序结果显示PTEN和TP53突变。2019年Spinelli等[5]报道第3例TTF-1/p40共表达NSCLC,患者男性,51岁,行右上肺穿刺活检,就诊时已发生脑转移,分子检测显示TP53基因突变。作者认为这可能是肺癌的一种新类型,尚无法将其进一步分类为腺癌或者腺鳞癌,TP53突变代表更高的侵袭性。2020年Cabibi等[6]提出新的假说:TTF-1/p40共表达低分化NSCLC可能起源于肺终末呼吸单位(TRU)的基底储备细胞,这类NSCLC具有不同的组织遗传学谱系,临床侵袭性更强,类似乳腺的“基底样”肿瘤。认为TTF-1/p40共表达低分化NSCLC是一种尚未得到充分认识的新肿瘤,建议将其命名为“基底型TRU癌”,并期待更大规模的多中心研究,以明确其临床病理和遗传学特征以及它们与TRU基底细胞的组织遗传学联系,进一步验证它们是否构成了肺腺癌的真正亚型。
现有报道显示TTF-1/p40共表达低分化NSCLC具有以下特征:男性、年龄较大、有吸烟史、组织学分化低、具有腺癌和鳞状细胞癌的双重免疫组化特征以及缺乏典型的腺癌或鳞状细胞的遗传基因改变[7],临床进展快、预后差。与已往报道不同,本例患者女性、无吸烟史,但同样表达双重免疫组化特征,有TP53基因突变。总之,TTF-1/p40共表达低分化NSCLC可能是一种新的肺癌类别,由于已知病例数较少,有待更多的研究进一步分析其特征及分子机制,明确是否具有不同的形态特征以及不同的治疗选择[8]。

