分子对接和荧光光谱法研究保泰松与人血清白蛋白的相互作用及机制
侯利杰,张泽,申炳俊,金丽虹
(长春理工大学 生命科学技术学院,长春 130022)
保泰松(Phenylbutazone,PBZ)又名布他酮,化学名为1,2-二苯基-4-正丁基吡唑烷-3,5-二酮,是二十世纪四十年代合成的唑酮类非甾体类抗炎药物,具有一定的解热镇痛和显著的抗炎作用。在临床上PBZ被广泛用于治疗炎症性疾病,如风湿性关节炎、类风湿性关节炎、骨关节炎、强直性脊椎炎、丝虫病急性淋巴管炎和急性痛风等[1-3]。作为一种解热镇痛抗炎药物,PBZ在医疗上曾发挥过巨大的作用。然而,PBZ的副作用较大,若长期服用或剂量过大,轻者出现恶心、呕吐、腹痛、便秘等症状,重者可致消化性溃疡,可抑制骨髓功能引起粒细胞减少,再生障碍性贫血,甚至死亡[4-5]。因此,二十世纪九十年代开始,随着新的止痛和消炎药物的发现,PBZ的使用量逐渐下降,但PBZ在临床上的优势依旧未减。随着相关研究人员的不懈努力,近年来PBZ及其衍生物的新生物活性相继被发现。研究表明,4-羟基羟基保泰松具有良好的抗炎增强免疫作用和抗HIV活性,挪威Aviral公司正在进行Ⅱ期临床试验。由于PBZ在治疗结核病、急性血吸虫病和恶性肿瘤引起的发烧方面比其他解热镇痛药更有效,这为PBZ提供了新的市场。目前,PBZ临床用药安全和剂量设计重新引起了人们的广泛关注。
人血清白蛋白(Human Serum Albumin,HSA)约占血浆总蛋白的60%,是人血浆中含量最高的胞外蛋白质。HSA带有较多的极性基团,能显著可逆结合内源性和外源性化合物,在体液中承担多种物质的储存和运输功能。药代动力学研究表明,口服PBZ能迅速吸收进入血液,其血浆蛋白结合率高达98%。Sudlow和Birbett等人[6]研究发现,HSA有SiteⅠ(位点Ⅰ)、SiteⅡ(位点Ⅱ)和SiteⅢ(位点Ⅲ)三个配体结合位点。其中,SiteⅠ位于ⅡA亚域疏水腔中,该疏水腔相对较大且具有良好的弹性,SiteⅠ结合的化合物多为体积较大的分子,2个不同配体分子亦可同时结合于SiteⅠ;而SiteⅡ和SiteⅢ均位于ⅢA亚结构域。作为SiteⅠ标记探针之一,PBZ被广泛用于药物分子与蛋白质结合位点的研究中。目前,PBZ与牛血清白蛋白(BSA)结合研究已有文献报道[7],但PBZ与HSA相互作用的系统研究甚少,有关PBZ结合位点处的热点残基、作用力类型以及对HSA构象影响尚未明确。本研究利用分子对接技术结合三维、内源和同步多种荧光光谱法,在分子水平上研究了PBZ与HSA间键和模式及作用机理,获得了两者间结合常数、结合位点及周围热点氨基酸残基信息、结合距离、结合力以及对作用过程中HSA构象变化等信息。研究结果对于阐明PBZ体内储藏运输、指导临床合理用药提供更多的参考信息。
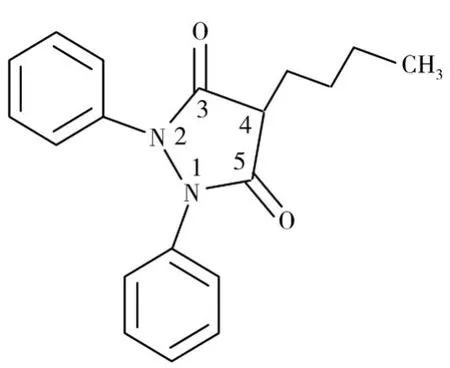
图1 PBZ分子结构式
1 实验部分
1.1 仪器与试剂
F-280型荧光分光光度计(天津港东科技发展有限公司);UV-2550型双光束紫外-可见分光光度计(日本岛津公司);DC-4006型高精度低温恒温槽(上海菁海科技有限公司);DELTA320型pH计(梅特勒-托利多仪器(上海)有限公司)。
PBZ(纯度≥99%,南通飞宇生物科技有限公司)用无水乙醇配制成2.0 mmol/L储备液,使用前用无水乙醇稀释成0.1 mmol/L。HSA(纯度≥99%,Sigma公司)储备液用0.05 mol/L Tris-HCl缓冲液(pH 7.40,0.1 mol/L NaCl)配制,浓度为0.1 mmol/L。实验用水为18 MΩ/cm超纯水,所用其他试剂均为分析纯。
1.2 实验方法
1.2.1 分子对接模拟
PBZ的3D结构由有机小分子生物活性数据(Pub Chem数据库)获得,其CID编号为4781。HSA的晶体结构取自蛋白质结构数据库(Protein Data Bank),PDB编号为1H9Z。使用Auto Dock 4.2.5.1软件对PBZ和HSA进行分子对接模拟,应用 Lamarckian Genetic Algorithm(LGA)遗传算法得到PBZ与HSA结合构象,用PyMOL2.3.1.0软件对药物和蛋白质分子构象进行可视化分析。
1.2.2 三维荧光光谱
室温下,在两个Tris-HCl缓冲体系中分别加入 0、240 μL 1.0×10-4mol/L PBZ 溶液以及 40 μL HSA储备液,获得HSA∶PBZ(浓度比)为1∶0和1∶6混合液,总体积为4 mL。充分混合后静置30 min,测量三维荧光光谱。激发波长(λex)和发射波长(λem)范围分别为210~340 nm和250~500 nm,激发波长和发射波长间隔均为5 nm。
1.2.3 荧光光谱和同步荧光光谱
配置 HSA∶PBZ(浓度比)分别为 1∶0,1∶1,1∶3,1∶5和 1∶7混合液,总体积为 4 mL,溶液获得过程同三维荧光光谱。充分混合,在298 K(或310 K)恒温水浴中静止30 min,测量荧光光谱或同步荧光光谱。其中,荧光光谱测量条件为:激发波长(λex)为282 nm或295 nm,发射波长(λem)范围为290~410 nm或310~430 nm,激发/发射狭缝为10 nm/5 nm;同步荧光光谱测量条件为:发射和激发波长间隔(Δλ)为15 nm(或60 nm),发射波长范围285~375 nm(或310~410 nm)。
1.2.4 结合距离
1.0 μmol/L HSA 和 PBZ Tris-HCl溶液分别测量荧光光谱和吸收光谱,荧光光谱测量参数同1.2.3节,吸收光谱波长范围290~410 nm。
2 结果与分析
2.1 分子对接模拟
分子模拟是研究分子之间特别是生物分子复合物(如药物与受体)之间相互作用的一种有效方法,它能获得配体和受体结合构象、位点和作用力等信息[8-10]。图2(a)为 PBZ 在 HSA 的亚结构区域ⅡA的对接图,图2(b)直观显示HSA疏水腔内有足够的空间容纳PBZ,疏水作用力在稳定复合物方面应起到了重要作用。PBZ周围4.0 Å范围内存在44个对结合作用贡献较大的活性氨基酸残基,图2(c)为PBZ与HSA部分氨基酸结合截图。44个活性氨基酸残基涉及,HSAⅡA结构域的氨基酸残基有,ⅡA-h1的Gln196、Leu198、Lys199和 Ser202,ⅡA-h1和ⅡA-h2间伸展链的 Phe206,ⅡA-h2的 Arg209、Ala210、Phe211、Lys212、Ala213、Trp214、Ala215、Val216、Arg218、Leu219和 Arg222,Ⅱ A-h3的Ser232、Val235、Thr236、Leu238和 His242,ⅡA-h4的 Arg257、Leu260和 Ala261,ⅡA-h6的 Ser287、Ile290和Ala291,除ⅡA结构域5个α螺旋中的27个氨基酸残基外,WF周围4.0 Å区域还涉及ⅠB、ⅡB、ⅢA亚结构域17个氨基酸残基,其在HSA二级结构中的具体分布为:ⅠB-h3的Glu153,ⅠB-h4的 Lys195,ⅡB-h2的Asp324、Leu327、Gly328和 Leu331,ⅡB-h3的 Leu347、Ala350和 Lys351,ⅡB-h3和ⅡB-h4间β-转角的 Glu354,ⅢA-h4的Glu450、Asp451和 Ser454,ⅢA-h5和ⅢA-h6间伸展 链 的 Ser480、Leu481和 Val 482,ⅢA-h6的Asn483。

图2 PBZ与HSA的分子对接结构模型图
2.2 HSA与PBZ体系的三维荧光
三维荧光具有高选择性,它能够获得化合物的完整荧光信息,可用于HSA构象及微环境的分析。1.0 μmol/L HSA与PBZ作用前、后的三维荧光光谱如图3和图4所示。可以看出,HSA有两个荧光谱峰(峰1和峰2)和一级瑞利散射(峰a,λex=λem)[11]。其中,峰1(λex/λem/Intensity,230 nm/340 nm/153.0)反映的是蛋白质多肽链结构等信息,峰 2(λex/λem/Intensity,285 nm/340 nm/1 329.8)则反映了HSA色氨酸和酪氨酸残基的光谱行为。随着PBZ的加入,峰a强度较HSA有所增加,这应是由于溶液中溶质粒径增大所致;峰1和峰2荧光峰强度均显著降低,其值分别为106.1和968.8,两者比值1∶9.13,有别于HSA的1∶8.69;最大发射波长都蓝移了1.0 nm。说明PBZ与HSA发生相互作用,导致HSA构象略微改变,使HSA中荧光基团微环境非极性有所增加,蛋白质粒径变大。

图3 HSA的三维荧光光谱

图4 HSA与PBZ作用后的三维荧光光谱
2.3 PBZ与HSA的荧光猝灭光谱及作用机制确定
HSA含有色氨酸(1个)、酪氨酸(18个)和苯丙氨酸(30个),这些具有芳香结构氨基酸令其具有内源荧光[12]。由于苯丙氨酸荧光量子效率(φ=0.04)远低于酪氨酸(φ=0.1)和色氨酸(φ=0.2),而酪氨酸离子化时其荧光几乎被猝灭,HSA内源荧光主要来源于ⅡA亚域疏水腔的色氨酸(Trp214)。不同浓度PBZ对HSA荧光光谱影响结果如图5(a-e)所示,而PBZ则无明显内源荧光(见图5曲线f)。由图5可知,λex=282 nm时,HSA在340 nm处内源荧光强度随PBZ浓度增加呈现有规律的下降,峰形虽没有明显变化,但荧光发射峰位蓝移4.8 nm(激发波长为295 nm时,PBZ-HSA体系的荧光光谱与其类似),表明PBZ使HSA生色团微环境极性降低,PBZ与HSA间发生了作用。

图5 PBZ对HSA荧光发射谱的影响(298 K)
PBZ诱导HSA内源荧光猝灭机理可以根据Stern-Volmer方程进行描述[13-14]:

式中,F0和F分别为PBZ加入前、后HSA内源荧光强度;Kq为双分子碰撞过程速率常数;τ0为HSA荧光寿命,约为1×10-8s;[Q]为 PBZ平衡浓度(μmol/L);KSV为Stern-Volmer猝灭常数。
282 nm和295 nm两激发波长下,由PBZ-HSA体系F0/F对[Q]的Stern-Volmer曲线图可计算获得猝灭常数(KSV),其结果如表1所示。

表1 PBZ与HSA作用的猝灭常数
可以看出,随着温度升高,PBZ-HSA体系的荧光猝灭常数KSV减少;文中实验条件下,双分子猝灭速率常数(Kq)数量级在1012,该值大于2×1010L/(mol·s)(各类猝灭剂对生物大分子的Kq)。由此推断,PBZ对HSA内源荧光猝灭过程为静态猝灭,两者间形成了复合物。
根据Förster理论,荧光物质与受体间发生非辐射能量转移亦可能导致HSA内源荧光猝灭原因之一[15]。图6为 1 μmol/L HSA 和 PBZ的荧光发射谱、吸收光谱的重叠图,采用矩形分割法可求得298 K时两光谱重叠区的重叠积分为J=2.06×10-16(cm3·L)/mol,临界距离R0=1.046 nm,能量转移效率E=0.105,结合距离r=0.65 nm。由于r<7 nm,且0.5R0 图6 HSA的荧光发射谱和PBZ的吸收光谱 荧光物质与猝灭体之间形成非荧光复合物时 ,可利用Lineweacr-Burk双对数方程[16](lg[(F0-F)/F]=lgKA+nlg[Q])得到结合常数KA和结合位点数n(如表2所示)。298 K和310 K下,结合常数KA数量级均在104,说明PBZ与HSA之间作用力适中,两者形成了较为稳定的复合物。结合位点n近似为1,表明PBZ和HSA间结合类型为1∶1。 表2 PBZ与HSA作用的结合常数及结合位点数 药物分子与HSA间可逆结合化学键主要涉及:静电作用、氢键、范德华力和疏水键[17]。由范特霍夫方程[18](lnKA=-ΔH/RT+ ΔS/R,ΔG=ΔH-TΔS)计算PBZ和HSA作用的热力学参数焓(ΔH)、熵(ΔS)和吉布斯自由能(ΔG),结果如表 3所示。由表 3可知,ΔG<0,ΔH<0,ΔS>0,说明PBZ与HSA间相互作用是一个自发吸热的过程,亦是一个熵增加的过程,二者作用的主要驱动力为疏水作用力,这与分子对接以及文献[7]结果一致。 表3 PBZ与HSA作用的热力学参数 同步荧光光谱被广泛用于多组分物质分析,它可以提供关于色氨酸(Trp214,Δλ=60 nm)和酪氨酸(Tyr,Δλ=15 nm)残基的荧光团微环境变化的有用信息,而这些荧光团与蛋白质的构象变化密切相关[19-20]。图7和图8为PBZ和HSA作用的同步荧光光谱,两步长(60 nm和15 nm)荧光强度均随PBZ浓度的增加而被明显猝灭。代表色氨酸残基的荧光猝灭程度(36.8%)明显大于酪氨酸残基(13.2%),表明HSA与PBZ结合部位更靠近色氨酸,这与PBZ为位点I的标记药物结论相符。此外,色氨酸、酪氨酸残基最大发射波长分别蓝移1.2 nm和0.3 nm,表明与PBZ作用在一定程度上影响了HSA构象,主要引起两荧光生色团微环境极性增加。 图7 PBZ对HSAΔλ=15 nm同步荧光的影响(298 K) 图8 PBZ对HSAΔλ=60 nm同步荧光的影响(298 K) 综上所述,通过多光谱技术与分子对接,研究了PBZ与HSA间的相互作用。结果表明,两者间的疏水作用力推动了PBZ-HSA复合物的形成。结合过程使HSA构象改变,色氨酸和酪氨酸残基微环境极性均有所增加,两者间结合距离为0.65 nm。此外,分子对接进一步解释并验证了光谱分析正确性,表明除ⅡA结构域28个氨基酸残基外,PBZ周围4.0 Å区域还存在ⅠB、ⅡB、ⅢA亚结构域17个氨基酸残基。PBZ与HSA间结合常数为104数量级,其值适中。本研究对预测WF与HSA结合率和其安全性评估提供一定的参考数据。
2.4 PBZ与HSA作用的结合常数和结合位点数

2.5 热力学参数及作用力

2.6 PBZ对HSA二级结构的影响

3 结论

