山桐子冬芽休眠过程及其生理生化特征
王艳梅 郭云天 陈珺肄 沈 红 杨 怀 刘 震
(1. 河南农业大学林学院,河南 郑州 450002;2. 中原地区森林资源培育国家林业局重点实验室,河南 郑州 450002;3. 浙江韵泽盈农业科技发展有限公司,浙江 衢州 324000;4. 洛阳市森林病虫害防治检疫站,河南 洛阳 471000;5. 河南省鸡公山国家级自然保护区管理局,河南 信阳 464000)
为了适应冬季的寒冷和干燥,大多温带树木在秋季就停止高生长,形成冬芽,进入休眠,为北方系冬休眠类型[1]。山桐子(Idesia polycarpa)为大风子科(Flacourtiaceae)山桐子属落叶阔叶乔木,其不仅分布于暖温带的冬芽有休眠特性,分布于亚热带的冬芽同样具有适应冬季寒冷干燥的特性;刘震等研究发现,山桐子冬芽休眠的具有主要以温度为导入诱因,具有较低的休眠深度以及5~15 ℃的低温范围可以解除休眠的休眠特性,这与温带树种的冬休眠特性有显著差异,被称为南方系冬休眠类型[1];同样横跨亚热带与暖温带的红润楠(Machilus Thunbergii),仅分布于暖温带的具有浅休眠特性[2],这类常绿阔叶树种的休眠被归为红润楠型冬休眠[1]。
永田洋等[3]根据芽萌发率结合芽的状态和环境温度将芽休眠的变化过程分为:休眠导入期、深休眠期、休眠解除期和内生长期4个阶段。树木在越冬休眠的各个时期的内源激素含量变化各不相同,影响着休眠的进程[4-8]。有关树木冬芽内源激素的变化与休眠解除的研究也较多,如杨树(Populus tremula×Populus alba)[9]、茶 树(Camellia sinensis)[10]、泡桐(Paulowniasp.)[11]和悬铃木(Platanussp.)[12]等,通过这些研究可知,ABA的积累可以促进冬芽的休眠,赤霉素能够促进休眠的解除。伴随着内源激素含量的变化,冬芽休眠过程中其他内含物也在发生着变化。抗氧化酶参与果树芽休除进程的调控[13],是低温响应和影响休眠诱导与解除的信号[14-17]。可溶性糖、蛋白质等生化物质与冬芽的休眠过程和抗寒性密切相关[18-19]。刘震等[20]发现分布于暖温带三重县的山桐子冬芽休眠比分布于亚热带冲绳县的深,并且这2种种源的山桐子只有经历足够的低温冬芽才能够萌发生长,其生长量与所经历的低温量有关。王艳梅等[21]通过探究分布与大陆性气候的不同种源山桐子冬芽休眠解除的有效低温发现其有效低温各不相同,15 ℃也具有解除休眠使冬芽萌芽的效果。目前山桐子冬芽休眠过程中冬芽内生理生化物质的变化还不明了。为此,本研究通过采集郑州气候条件下山桐子枝条进行水培来判断其冬休眠过程的同时,测定不同时期冬芽内生理生化物质的变化,以揭示南方系冬休眠类型树种冬芽休眠过程的生理生化机制。
1 材料与方法
1.1 试验材料与设计
材料采集于种植于河南农业大学林业试验站(113°42′ E,34°43′ N)4年生东京种源山桐子。该地属于暖温带大陆性气候,四季分明,年平均气温14.2 ℃,年日照时数约2 400 h,无霜期220 d,年平均降水量650.1 mm,土壤为潮土(沙壤土),微碱性。
分别在2017年9月10日、9月20日、10月10日、10月20日、10月30日、11月15日、12月1日、12月15日,2018年1月1日、1月15日、2月5日、3月1日、3月10日和3月17日从样地4年生东京种源山桐子树上采集长10 cm、基径范围在0.4~0.8 cm、带顶芽的枝条10枝,采集树体上部2~3年生枝条上的成型的芽体30个。枝条放置于光照强度为2 000 lx、光照时长24 h、温度25 ℃恒温箱内100 mL的三角锥形瓶中进行水培试验,试验用的培养液由50 mL蒸馏水和5 mL浓度为22.15 mg/L MS盐溶液组成,每3 d换1次培养液;采集的芽体用锡箔纸包裹置于液氮中带回实验室,存放于−80 ℃冰箱里,15个芽体用于生理指标的测定,主要包括:超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性、可溶性蛋白含量、可溶性糖含量,15个芽体用于内源激素含量的测定,主要包括:生长素(IAA)、脱落酸(ABA)、反式玉米素(tZR)、赤霉素(GA3)。
1.2 试验方法
不同时间采集的山桐子枝条在恒温箱内水培,主要观测不同时期枝条上顶芽萌发的时间、展叶数、萌发率、萌发高生长率和平均高生长量(对于出现高生长现象的枝条持续观察,没有出现的则不进行观察),萌发高生长率为既萌发又出现高生长的枝条占处理总枝条数的百分率,萌发率为芽萌发的枝条占处理总枝数的百分率,并将萌发率作为芽体休眠深度的判断标准[2]。
可溶性糖含量采用苯酚法测定[22];可溶性蛋白含量测定选用考马斯亮蓝G−250染色法,超氧物歧化酶(SOD)测定采用氮蓝四唑(NBT)比色法,过氧化物酶(POD)测定采用愈创木酚法,过氧化氢酶(CAT)采用高锰酸钾滴定法[23];采集测定内源激素的样品使用Agilent 1 260 InfinityⅡ液相色谱仪,采用高效液相色谱法[24]测定生长素(IAA)、脱落酸(ABA)、反式玉米素(tZR)和赤霉素(GA3)。
2 结果与分析
2.1 不同时期山桐子冬芽在25 ℃条件下萌发生长的变化
由图1可知,9月10日采集的冬芽在水培10 d后开始萌芽,11月之前的萌发率集中在46.67%~66.67%,进入11月冬芽萌发率突然降低,萌发时间也在增加,11月15日冬芽萌发率只有30%,但12月1日冬芽萌发率快速上升至90%,但冬芽萌发所需时间长达20 d,之后冬芽萌发所需时间逐渐减短,萌发率均为100%,3月17日冬芽第4天就出现萌发现象。

图1 不同时期山桐子冬芽在25 ℃条件下的萌发率Fig. 1 Germination rate of I. polycarpa winter buds in different periods at 25 ℃
由图2可知,各个时期采集水培的枝条在9月10日至1月15日的冬芽萌发后均不能进行正常生长,只有2月5日之后才开始出现生长现象,出现高生长的天数逐渐减短,萌发高生长率3月1日最高,2月5日最低,只有1株出现高生长现象,最大生长量为2.2 cm;3月1日的萌发高生长率达到60%,最大平均高生长量1.38 cm,之后3月10日和3月17日采集枝条的萌发高生长率分别为20%和30%,平均高生长量分别为1.15 cm和1 cm。

图2 不同时期山桐子冬芽在25 ℃条件下萌芽后高生长状况Fig. 2 The high growth of I. polycarpa buds in different periods after germination at 25 ℃
2.2 不同休眠期山桐子冬芽内生理生化物质的变化
2.2.1 渗透调节物质含量的变化
由图3可知,可溶性糖含量呈现W型动态变化。冬芽可溶性糖含量在9月10日至9月20日显著下降(P<0.05),在10月保持在较低水平;进入11月,10月30日至12月1日可溶性糖含量呈显著增加趋势(P<0.05),在12月1日达到最大值2.221 μg/g;12—2月可溶性糖含量开始波动下降,但仍维持在较高水平;进入3月,可溶性糖含量在3月10日达到最低值0.634 μg/g后到3月17日显著上升(P<0.05)。可溶性蛋白含量的变化与可溶性糖含量变化不同,9月20日至10月20日可溶性蛋白含量显著上升(P<0.05),在10月20日达到峰值140.64 μg/g,10月20日至10月30日显著下降(P<0.05),但仍维持在较高水平;进入11月,10月30日至11月15日可溶性蛋白含量显著下降(P<0.05),在11月15日降到最低值59.48 μg/g,之后略有上升,可溶性蛋白的含量处在较低水平;12月之后含量呈上升趋势,1月1日在达到峰值126.15 μg/g后至2月5日呈显著下降趋势(P<0.05);进入3月后,3月1日至3月17日可溶性蛋白含量显著上升(P<0.05),在3月17日达到最大值156.21 μg/g。
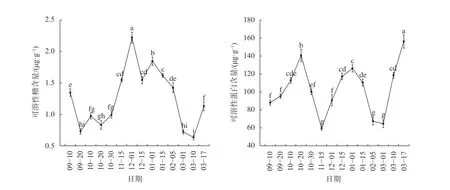
图3 不同休眠期山桐子冬芽渗透调节物质含量的变化Fig. 3 The dynamic changes of osmoregulation substancecontent in winter buds of I. polycarpa during different periods
2.2.2 抗氧化酶活性的变化
由图4可知,SOD活性呈现小幅波动的趋势,整体上变化不大。相比于SOD,POD和CAT的活性变化更为明显,9—10月冬芽内POD活性逐渐降低,10月20日至10月30日POD活性显著下降(P<0.05),在10月30日POD活性下降至最低9.48 U/(g·min);进入11月,10月30日至11月15日POD活性显著上升(P<0.05);POD的活性在12月之后继续上升,一直到2月,POD活性整体维持在较高水平;进入3月,POD活性维持在高水平,3月1日POD活性达到20.86 U/(g·min),之后3月10日至3月17日POD活性显著下降(P<0.05)。CAT的活性变化与POD活性变化在前期较为一致,10月10日至10月30日CAT活性呈显著下降趋势(P<0.05),在10月30日CAT活性下降至最低值2.5 U/(g·min);10月30日至12月1日冬芽内CAT活性显著上升(P<0.05),在12月1日活性达到13.67 U/(g·min);12月之后,芽内CAT活性再次降低,在2月5日再次达低峰值4 U/(g·min),这段时期冬芽内的CAT活性都保持在低水平;进入3月后,3月1日至3月17日冬芽内CAT活性呈显著上升趋势(P<0.05),在3月17日达到最大值31U/(g·min),恢复到9月初的高水平状态。
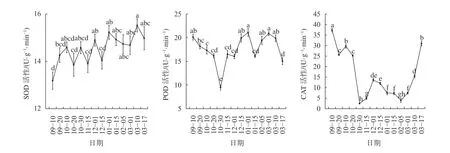
图4 不同时期山桐子冬芽抗氧化酶活性的动态变化Fig. 4 The dynamic changes of antioxidant enzyme activity in winter buds of I. polycarpa during different periods
2.2.3 内源激素含量的变化
由图5可知,山桐子冬芽在休眠过程中,IAA和ABA含量都呈现“上升—下降”的变化趋势,tZR的含量变化随越冬温度呈现季节性的变化,而在冬芽休眠过程中不同时期的赤霉素GA3含量的动态变化比较大。9月至10月中上旬ABA含量较低,在0.045 ~0.056 μg/g,10月20日至10月30日含量显著增加(P<0.05),在10月30日达到最高值;进入11月,10月30日至11月15日冬芽内的ABA含量显著下降(P<0.05),但仍维持在较高水平;12月1日至1月15日,ABA含量呈显著下降趋势(P<0.05),2月ABA含量逐渐降低至较低水平;3月之后,ABA含量维持在较低水平,在3月17日达到最低值0.011 μg/g。IAA含量的变化趋势与ABA相似,9月至10月中上旬冬芽内IAA含量稳定在较低水平,10月20日至10月30日IAA含量显著上升(P<0.05),在10月30日升至最高1.142 μg/g;11月之后,10月30日至11月15日生长素含量显著下降(P<0.05),11月15日至12月1日显著上升(P<0.05),后在12月15日显著下降降至最低值0.011 μg/g(P<0.05),之后IAA含量略有小幅波动,但始终保持在较低水平;3月之后IAA含量稳定在较低水平。
从图5中可以看出,9—10月冬芽内的tZR含量较低,基本稳定在0.022~0.061 μg/g;进入11月,10月30日至11月15日tZR含量显著上升(P<0.05),在11月15日升高到0.339 μg/g;12月1日至12月15日冬芽内tZR含量呈显著下降趋势(P<0.05),在12月15日达到最低值0.002 μg/g,之后12月15日至2月5日随着休眠的进程tZR含量呈显著上升趋势(P<0.05),在2月维持在较高水平;3月10日至3月17日冬芽内tZR含量显著增加(P<0.05),在3月17日达到最大含量为0.490 μg/g。山桐子冬芽内GA3含量的动态变化比较大,9月到10月初的冬芽GA3含量较低,10月10日至10月30日GA3的含量呈显著上升趋势(P<0.05),在10月30日达到峰值156.290 μg/g;进入11月,10月30日至11月15日GA3含量显著下降(P<0.05),11月15日至12月1日又显著上升(P<0.05),11月GA3维持在较高水平;在12月,12月1日至12月15日GA3的含量显著下降(P<0.05),在12月15日降至最低值0.123 μg/g,之后12月15日至1月15日冬芽内GA3含量呈显著上升趋势(P<0.05),2月GA3含量略有下降,但维持在较高水平;3月10日至3月17日GA3含量显著上升(P<0.05),在3月17日达最大值162.703 μg/g。
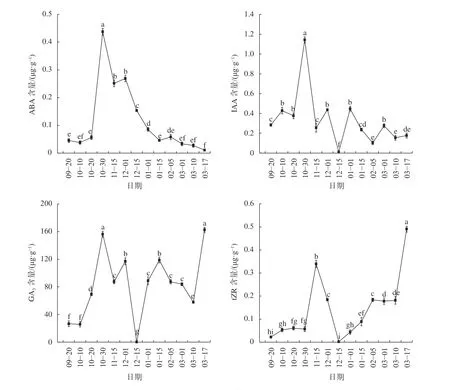
图5 不同时期山桐子冬芽内源激素含量的动态变化Fig. 5 The dynamic changes of endogenous hormone in winter buds of I. polycarpa during different periods
图6可知,将内源激素IAA、tZR、GA3、IAA+GA3+tZR分别与ABA进行比值,可以发现在整个山桐子冬芽休眠过程中,生长素IAA与脱落酸ABA之间的比值变化波动较多,10月10日至10月30日比值显著下降(P<0.05),11月比值保持在较低水平,12月之后比值波动上升,进入3月,3月10日至3月17日比值显著增大(P<0.05),在3月17日比值达到最大;而激素tZR、GA3和IAA+GA3+tZR与ABA之间的比值变化较大,相对一致,在9—11月比值变化较小,12月之后开始上升,进入3月,3月10日至3月17日比值显著增大(P<0.05),在3月17日达到最高的比值。
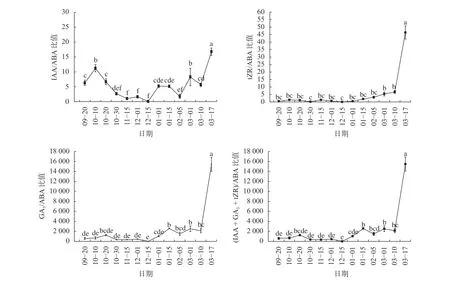
图6 不同时期山桐子冬芽内源激素比值的变化Fig. 6 Changes of endogenous hormone ratio of I. polycarpa winter buds during different periods
3 结论与讨论
3.1 山桐子冬芽休眠过程特征
根据不同山桐子冬芽萌发率的变化,可以判定东京种源山桐子休眠过程为:9—10月为芽休眠导入期,11月为深休眠期,12—2月为休眠解除期,3月进入内生长期,这与前期研究结果基本一致,只是休眠深度比三重县种源浅,比冲绳县种源深[1,20],可能是东京气候较三重温暖的原因。该休眠过程与同为南方系冬休眠类型的悬铃木和泡桐侧芽相似[25-26],区别是山桐子休眠导入期、深休眠期以及未充分解除休眠时期冬芽即使萌发,也难于抽枝,节间伸长。百合在冷藏解除休眠时,冷藏时间不足会影响顶芽萌发后的伸长[25],对于山桐子来说,分析其原因可能相比于冬芽的展叶萌发,冬芽萌发后的正常生长需要积累更多的低温量,这种休眠解除时只能萌发展叶不进行正常生长的特殊现象,将其暂称为冬芽内的“叶原基休眠”,而冬芽需要经历更长时间的低温,萌发后才能进行正常生长,这种冬芽休眠暂称为“分生区休眠”,其休眠解除期更长,只有2种休眠均解除才能保证山桐子冬芽在春季重新萌发生长。
北方系冬休眠类型的杨树(Populus×euramericanacv.‘I−214’)冬芽9月30日在日本津市(34°42' N,136°30' E)就达到了深休眠期[26],而南方系山桐子深休眠期延迟到11月,说明南方系冬休眠类型休眠导入期滞后以适应南方冬季来临较晚且较暖的气候;同时,与北方系冬休眠类型冬芽在深休眠期即使25 ℃高温条件下也不萌发相比,南方系冬休眠类型山桐子冬芽在深休眠期有一定比率的冬芽萌发,休眠深度较浅;南方系山桐子冬芽休眠解除期与北方系杨树冬芽休眠解除期相似,均在春季2—3月萌发开始重新生长。
3.2 山桐子冬芽休眠过程的生理生化特征
可溶性糖和可溶性蛋白是植物的重要的渗透调节物质,可溶性糖使细胞冰点下降,保护原生质体[18,27]。从山桐子冬芽休眠过程中可溶性糖和可溶性蛋白含量的变化趋势来看,与葡萄(Vitis vinifera)[27]和杏树(Armeniaca vulgaris)[28]的变化基本一致,不同在于可溶性蛋白含量在深休眠期降低,可能由于此时内源激素GA3、tZR和ABA含量增加,导致可溶性蛋白含量下降。可溶性糖和可溶性蛋白含量均在冬季最寒冷季节最大,以提高其抗寒性,其变化与休眠过程密切相关。
植物遇到低温会积累大量有害的活性氧(AOS),使植物体内抗氧化酶系统加强,提高植物对活性氧的耐受力[29],低温促进保护酶活性的提高[30],SOD、POD和CAT活性与梨树(Pyrus bretschneideri)花芽的休眠有很大关系[31]。本研究发现随着温度的降低,休眠深度的加深,山桐子冬芽内SOD作为清除活性氧的主要酶类,其活性一直保持在较高水平,这与油桃[32](Prunus persicavar.nectarina)[32]的芽体在休眠期SOD活性基本保持在较高水平的研究结果一致,但SOD活性在不同休眠阶段变化无显著差异;而CAT和POD作为清除H2O2的主要酶类,其活性随着温度的降低而下降,在深休眠期显著低于其他时期的活性,而后POD活性随着休眠的解除开始上升,CAT活性一直到休眠完全解除才有明显升高,这与研究北方系冬休眠类型的许多树种如杏树[33]、油桃[32]和葡萄[32]的休眠过程中,发现随着低温的累积,CAT活性在休眠初期下降,深休眠期保持较低水平,休眠后期又升高,而POD活性的变化趋势与CAT相反的结果不一致,其原因可能是相比于温带树种,山桐子在低温下的抗逆性较弱,这些结果表明低温环境对山桐子冬芽抗氧化酶活性的影响CAT最明显,POD次之,SOD影响最小,可以看出CAT和POD指标对于山桐子冬芽的休眠过程有较为明显的指示作用。。
植物激素是调控芽休眠过程的重要内部因素,内源激素之间的相互作用和动态平衡影响着休眠的进程。ABA含量在牡丹(Paeonia suffruticosa)的芽休眠期间增加,在休眠解除阶段下降[34],这与山桐子冬芽的ABA含量变化一致,ABA含量的增加诱导了芽的休眠;而在山桐子冬芽休眠导入期,IAA含量增加,高浓度的IAA不利于芽的萌发[35],之后IAA含量降至较低水平,对休眠调控作用不显著;作为促进休眠解除的赤霉素和细胞分裂素,在牡丹[34],杏[36],欧洲桦(Betula pubescens)[37]冬芽休眠导入期含量减少,随着经历低温休眠的解除,赤霉素和细胞分裂素含量增加的变化规律,与山桐子冬芽GA3和tZR在休眠期的变化有明显不同,山桐子在深休眠期GA3和tZR不仅没有降低,还有所增大,这与悬铃木冬芽休眠过程中的激素含量变化相似[12],对于未经低温解除休眠的悬铃木冬芽来说,外施赤霉素可以加深其休眠,随着休眠的解除,赤霉素的促进休眠作用才解除[38],分析其原因可能是山桐子或悬铃木冬休眠芽休眠导入与内源激素GA3含量急剧增加有关。说明南方系冬休眠类型冬芽生理活性比北方系冬休眠类型高,反映了其休眠深度较浅。内源激素之间的协调作用也影响这休眠的进程,分析发现,从休眠导入期到深休眠期,IAA、tZR、GA3、IAA+GA3+tZR与ABA的比值都在下降,说明这两个时期ABA相对含量较高,对休眠的诱导起到主要作用,而随着经历足够的低温,休眠解除促进物质量分数增加,抑制物质量分数下降,这可能是GA3和tZR含量的增加抑制了ABA含量的增加。
3.3 结论
山桐子冬芽休眠具有浅冬休眠特性,其中休眠导入期、深休眠期、休眠解除期及内生长期分别为9—10月,11月,12—2月与3月上旬。山桐子冬芽内的可溶性糖和可溶性蛋白的含量具有与休眠变化季节适应规律;POD和CAT作为山桐子冬芽内的抗氧化酶,其活性不止与抗寒性密切相关,也与休眠的促进和解除有关;ABA能够促进山桐子冬芽的休眠,在休眠解除期,tZR和GA3含量的增多可以促进休眠的解除,对ABA有抑制作用。

