2株烟草根际芽孢杆菌的分子鉴定及抗菌促生作用
曹毅 李娟 曾陨涛 陆宁 杨冬梅 商胜华


摘要:为探究分离自烟草根际的2株芽孢杆菌的种类及其抑菌促生特性,利用16S rDNA和gyrB基因序列分析法,将菌株YC2006和YC2008分别鉴定为枯草芽孢杆菌(Bacillus subtilis)和解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。菌株对烟草赤星病病原(Alternaria alternata)、烟草黑胫病病原(Phytophthora parasitica)和烟草立枯病(Rhizoctonia solani) 病原均具有明显的抑制作用,对烟草立枯病病原的抑制率分别达到60.35%和68.08%。菌液浸种处理可显著提高烟草种子发芽势,在育苗基质中添加菌剂可显著提高烟苗的株高、茎围、最大叶面积、地上部鲜质量、地下部鲜质量、总根长和总根表面积。2株芽孢杆菌对烟草主要真菌病原具有拮抗活性,同时兼具促进种子萌发和烟苗生长的作用,具有良好的研究开发应用前景。
关键词:芽孢杆菌;烟草;gyrB基因;抑菌活性;促生作用
中图分类号:S182;S572.01 文献标志码: A
文章编号:1002-1302(2021)21-0241-06
收稿日期:2021-03-05
基金项目:国家自然科学基金(编号:31660544);中国烟草总公司贵州省公司项目(编号:201603、2021XM12)。
作者简介:曹 毅(1982—),男,云南会泽人,博士,副研究员,从事微生物和植物保护研究。E-mail:yicao1001@163.com。
烟草(Nicotiana tabacum L.)是我国广泛种植的重要茄科经济作物,烟草病害严重影响烟叶产质量,常年造成的平均产量损失达10%左右[1],一直是制约烟草生产的主要因素之一,而随着气候、耕作制度和栽培方式的变化,烟草病原种类及其危害程度呈增加和上升趋势。长期以来,作物病害主要依赖化学药剂,由此导致的药害[2]、農药残留、病原耐/抗药性、生态环境影响等问题逐年凸显,利用微生物制剂或其他环境友好措施控制作物病害受到各方广泛关注。在各类生防微生物资源中,芽孢杆菌由于种类多样、遗传稳定、环境抗逆性强[3],可通过改善植物营养物质吸收、产生激素、诱导抗性和抑制病原生长等方式直接或间接促进植物生长、防治病害[4],国内外研究者利用芽孢杆菌已开发出多种对植物病原具有防治效果的生物菌剂[5],并在作物病害防治中不断发展和应用[6]。
利用微生物防治作物病害虽已取得较大的进展,但在实际生产实践中,由于外源生防菌在目标作物根系中定殖力低、土壤抑菌作用、施用成本等因素的影响,生防制剂往往防效低且不稳定,筛选根际定殖能力强的菌株资源并研究适合作物生产特点的施用方法对提高生防菌剂施用效果具有重要意义。前人研究表明,利用有益微生物处理烟草种子,可明显提高种子发芽势、生长势和种子活力,促进烟苗生长,增加其抗逆和抗病性[7];微生物添加进育苗基质中,可改善其结构与理化性质[8],提高养分供应能力,进而促进植物生长[9];同时,菌剂可在植物幼苗根部优先形成“生物屏障”[10],维持根际微生物群落平衡并抵御病原攻击[11-12]。烟草育苗集约化程度高,在种子萌发、育苗阶段使用微生物菌剂具有经济和高效的特点,规模化推广应用潜力大。目前,针对烟草和烟叶生产特点开发的微生物菌剂较少,以高效土著菌株为核心的烟用菌剂及配套使用技术仍较缺乏。
本研究以前期分离获得的2株烟草根际芽孢杆菌YC2006和YC2008为材料,采用16S rDNA和gyrB基因(DNA促旋酶B亚单位基因)序列分析法对菌株进行鉴定,通过室内和温室试验评估2株芽孢杆菌的抗菌和促生能力,以期为烟草抗病促生菌剂的开发应用提供支撑。
1 材料与方法
1.1 供试菌株、培养基和烟草品种
试验所用烟草黑胫病菌(Phytophthora parasitica)、烟草赤星病菌(Alternaria alternata)、烟草立枯病菌(Rhizoctonia solani)、芽孢杆菌YC2006和YC2008均由贵州省烟草科学研究院微生物实验室分离并保存,LB培养基和PDA培养基分别用于芽孢杆菌的活化和病原真菌培养,试验用烟草品种为K326,对照为枯草芽孢杆菌可湿性粉剂(云南星耀生物制品有限公司提供)。
1.2 主要真菌病原拮抗活性测定
用平板对峙培养法测定经活化的YC2006和YC2008对烟草黑胫病、赤星病菌和立枯病等主要真菌病害病原菌的拮抗活性,挑取经LB平板活化的单菌落接种于LB液体培养基中,摇床振荡培养(28 ℃、180 r/min)2 d得到培养液,吸取50 μL培养液缓慢滴入无菌空白滤纸片(索莱宝)中,于PDA平板中接入直径6 mm 新鲜培养的病原菌菌饼,距菌饼约2.5 cm处等距放入含菌滤纸片,以未接菌的LB培养液为对照,3次重复,28 ℃培养箱中培养 5~7 d后,测量病原菌菌落直径,计算抑制率:
抑制率=(1-接种处理病原菌菌落直径/不接种处理病原菌菌落直径)×100%。
1.3 菌株gyrB基因和16S rDNA序列分析
菌株基因组DNA采用试剂盒(DNeasy UltraClean Microbial Kit,Qiagen)并按说明书方法提取,引物由上海英骏生物技术有限公司合成:27F(5′-AGAGTTTGATCCTGGCTCAG-3′)/1492R(5′-GGTTACCTTGTTACGACTT-3′),UP-1(5′-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3′)/UP-2r(5′-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3′),分别用于菌株16S rDNA 和gyrB基因[13]的扩增;PCR扩增体系为50 μL(GoTaqTM Green Master Mix 25 μL、27F/UP-1 1 μL、1492R/UP-2r 1 μL、模板 5 μL、无核酸酶去离子水18 μL)。16S rDNA基因扩增程序为:94 ℃预变性 4 min;94 ℃变性30 s,65 ℃ 退火40 s,72 ℃延伸90 s,共35个循环;72 ℃延伸 10 min;gyrB扩增条件:94 ℃预变性 4 min;94 ℃ 变性 1 min,60 ℃退火 1 min,72 ℃延伸 2 min,共35个循环;72 ℃延伸10 min。
扩增产物经2%琼脂糖凝胶电泳检测后,送生工生物工程(上海)股份有限公司进行双向测序,利用中间引物UP-1s(5′-GAAGTCATCATGACCGTTCTGCA-3′)和UP-2rs(5′-AGCAGGGTACGGATGTGCGAGCC-3′)测通gyrB基因全长,测序拼接序列在NCBI数据库中进行BLAST比对,下载同源性在99%以上的序列,利用Mega X软件包进行多重序列比对,采用邻接法(Neighbor-Joining,Bootstrap value=1 000)构建系统发育树。
1.4 烟草种子萌发相关指标测定
取活化的菌株,接入种子培养基中,37 ℃、200 r/min 培养24 h后,制得种子液;以5% 接种量将种子液接种到2 L发酵培养基中,30 ℃条件下发酵48 h,将菌株发酵液与适量CaCO3混合,喷雾干燥后获得初制菌剂。利用平板稀释法[14]测定含菌量,菌液YC2006和YC2008的浓度分别约为4.04×1010 CFU/mL和1.83×1011 CFU/mL。将菌液浓度与对照商品化菌剂浓度调至1×109 CFU/mL,备用。
选取烟草种子(K326)放于试验设置的菌剂溶液中浸种2 h,分别以清水和商品化枯草芽孢杆菌可湿性粉剂为对照,共11个处理(表1);浸种后,种子置于铺有灭菌滤纸的灭菌培养皿中,加入灭菌清水保湿,每皿放置30粒种子,每个处理重复3次。25 ℃、光照16 h/d的人工气候室培养,从种子置床之日起每天定时(早:09:00,晚:18:00)开盖通气2次,加入灭菌清水,保证发芽床湿润。萌发指标以种子露白为准。种子萌发后逐日记录发芽数量,共记录10 d,测定并计算种子萌发指标。
发芽率=(萌发结束时已发芽种子数/供试种子总数)×100%;
发芽势:从种子置于培养箱开始至第3天,统计发芽种子数占供试种子总数的百分率。
1.5 烟草幼苗农艺性状测定
在前期试验基础上,设5个处理组,处理A:每100 g育苗基质中拌入0.5 g枯草芽孢杆菌YC2006;处理B:每100 g育苗基质中拌入2 g解淀粉芽孢杆菌YC2008;处理C:每100 g常规育苗基质中拌入1 ∶1(质量比)的1 g芽孢杆菌YC2006、YC2008;处理D:空白对照,育苗基质中不拌入芽孢杆菌(CK1);处理E:每100 g育苗基质中拌入0.5 g商品化枯草芽孢杆菌(CK2)。将种子分别播于试验设置的不同基质中,放置于人工气候室培养,培养环境设为温度25 ℃/18 ℃(昼/夜),光照16 h/d,相对湿度75%。播种45 d后,参照标准YC/T 142—2010[15],对烟苗株高、茎围、地上部鲜质量、地下部鲜质量、地上部干质量、地下部干质量及最大叶面积等指标进行测定,根系指标采用根系扫描仪(型号:EPSON 1680)及其配套的WinRhizo Pro 5.0根系分析软件测定[16]。
1.6 统计分析
采用SPSS 19.0软件进行差异显著性分析。
2 结果与分析
2.1 菌株对主要烟草病原真菌的室内拮抗活性的影响
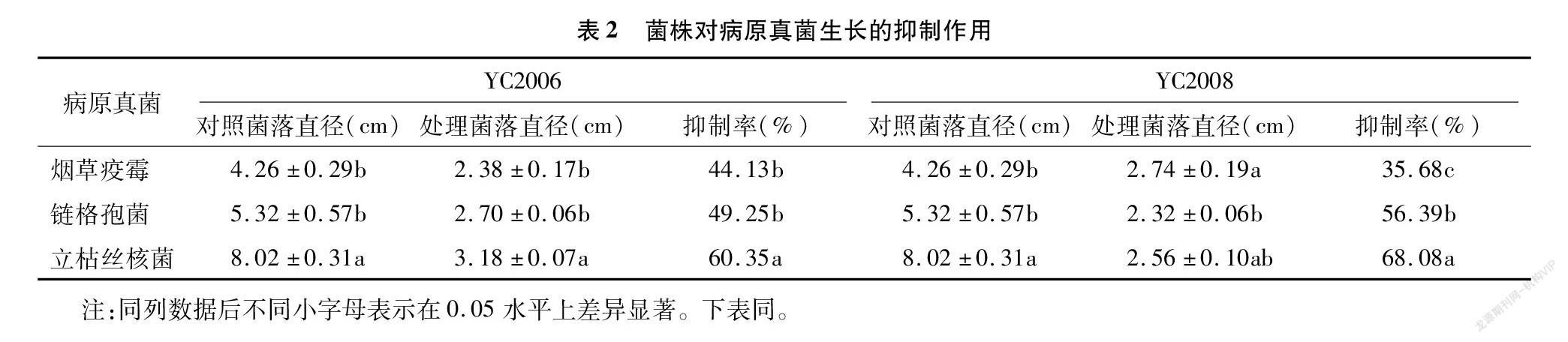
平板对峙试验结果表明(表2),YC2006和YC2008菌株对病原菌菌丝的生长具有抑制作用,对2种病原菌的抑制率达45%以上,芽孢杆菌YC2006和YC2008对烟草立枯丝核菌的抑制率最为明显,分别达60.35%和68.08%;其次为赤星病菌(链格孢菌)和黑胫病菌(烟草疫霉)(图1)。
2.2 菌株16S rDNA和gyrB基因序列系统发育分析
菌株YC2006和YC2008的16S rDNA基因测序结果经序列拼接后,长度分别为1 420 bp和 1 410 bp,采用 NJ 法分别构建2株菌的16S rRNA 基因序列系统发育树,结果见图2和图3。从16S rRNA基因序列系統发育树看,菌株YC2006和YC2008与临近的几株芽孢杆菌亲缘关系较为接近,初步将YC2006和YC2008归为芽孢杆菌属。
菌株YC2006的gyrB基因测序结果拼接后获得1 160 bp长度的序列,与GenBank 中已报道的多株枯草芽孢杆菌的gyrB基因序列同源性较高,序列相似性均达99.5%以上,采用 NJ 法构建基于gyrB基因序列系统发育树(图4),从gyrB基因序列系统发育树分析,菌株YC2006与枯草芽孢杆菌G2菌株聚为一支,有较近的亲缘关系,可信度97%,结合16S rRNA 基因的系统发育分析,将YC2006鉴定为枯草芽孢杆菌(B. subtilis);同样的方法,菌株YC2008的gyrB基因(1 170 bp)与多株解淀粉芽孢杆菌的gyrB基因序列同源性较高,序列相似性均达99%以上,系统发育树(图5)表明菌株YC2008与解淀粉芽孢杆菌(B. amyloliquefaciens,AB829604)聚为一簇,有较近的亲缘关系,结合16S rRNA 基因的系统发育分析,将YC2008鉴定为解淀粉芽孢杆菌。
2.3 菌株对烟草种子萌发的影响
室内种子发芽试验结果(表3)显示,种子经不同浓度的芽孢杆菌液浸泡处理后,YC2006 0.5%处理发芽率显著高于对照制剂;各处理发芽势显著提高,表明本试验菌剂处理可加快烟草种子的萌发进程,烟草出苗快而整齐。
2.4 菌株对烟草幼苗农艺性状的影响
由表4可知,处理A、B、C对烟草株高有促生作用,分别比清水对照提高了188%、103%、30%;各处理间茎围无显著差异,最大叶面积比对照提高了101.30%、36.46%、0.84%,处理A、B地上部鲜质量分别比对照提高了85.14%、40.09%;各处理地下部鲜质量分别比对照提高了136.36%、203.03%、69.70%。
由表5可知,处理A的平均根系直径、总根体积与对照相比差异显著,总根长和总根表面积均显著高于对照,与无菌清水对照相比,分别提高了41.75%和38.95%。经0.5% YC2006处理过的烟苗根长和根系表面积均高于对照,根系更为发达。
3 结论与讨论
16S rDNA基因序列因其高度的保守性而被广泛用于细菌分子鉴定,但对近缘种常常难以区分鉴别。gyrB基因存在于所有细菌中,其分子进化速率大于16S rDNA基因,且不同种细菌的gyrB基因存在较大差异,常作为用芽孢杆菌种水平鉴定的靶标基因[17],本研究同时根据16S rDNA和gyrB序列和系统发育分析结果,将菌株YC2006和YC2008初步鉴定为枯草芽孢杆菌(B. subtilis)和解淀粉芽孢杆菌(B. amyloliquefaciens)。烟草立枯病、黑胫病和赤星病是当前烟草育苗和大田生长期的主要真菌性病害,本研究对菌株抑菌活性测试发现,菌株YC2006和YC2008对供试的3种病原菌均有不同程度的抑制活性,抑制活性强度以立枯病病原最为明显,烟草大田期靶斑病病原与立枯病病原属同种不同融合群,推测本试验菌株也可抑制烟草靶斑病病原,菌株抑菌谱等相关试验有待进一步开展,以明确其抗病应用范围。室内种子萌发试验和温室幼苗盆栽试验结果显示,高浓度的菌株对烟草种子萌发和幼苗生长有抑制现象,与杨晓云等发现高浓度解淀粉芽孢杆菌B1619发酵液对番茄种子萌发和幼苗植株生长有抑制作用结果相似,表明在实际应用中明确生防菌株浓度施用范围十分重要,同时还需对加工工艺、剂型等下游技术开展研究,以便更好地发挥出生防菌的生防作用[18]。
微生物促进植物生长一般可归纳为:一是通过其生长繁殖及代谢活动产物,促进土壤养分合成、分解与转化,供植物生长利用,如芽孢杆菌代谢产生生长激素等促进植物吸收水分和养分物质,直接促进植物生长[19];二是通过营养竞争、产生抑菌物质抑制有害微生物的生长,维持根系微生态平衡,减少病原菌的侵染而间接促进植物生长。吴亚胜等研究发现,在育苗基质中添加丛枝菌根真菌,菌根侵染率明显提高,对辣椒幼苗的生长表现出显著的促进作用[20];多黏类芽孢杆菌CF05发酵液对番茄幼苗有明显的促生效果,鲜质量增加272.0%,干质量增加266.7%[21]。本研究在育苗基质中添加枯草芽孢杆菌YC2006、解淀粉芽孢杆菌YC2008表现出了显著的烟苗促生活性,添加0.5% YC2006,烟苗株高、最大叶面积、地上/地下部鲜质量、总根长和总根表面积较商品化的枯草芽孢杆菌菌剂分别提高了149.44%、62.1%、60.55%、39.29%、71.60% 和 70.15%,菌株促生机理值得进一步研究。生防菌施用后,稳定的定殖能力是其发挥生防、促生作用的关键因素[22],本试验菌株为烟草根际分离所得,可能更适合在根际定殖并发挥作用,菌株YC2006和YC2008可通过拌种、基质添加等使用方式促进烟草生长,同时,菌株对烟草主要真菌病原具有明显的抑制作用,可作为优良的菌种材料用于烟草专用微生物种衣剂、微生物菌剂和菌肥的开发。
参考文献:
[1]朱贤朝.中国烟草病害[M]. 北京:中国农业出版社,2002.
[2]Tunsagool P,Leelasuphakul W,Jaresitthikunchai J,et al. Targeted transcriptional and proteomic studies explicate specific roles of Bacillus subtilis iturin A,fengycin,and surfactin on elicitation of defensive systems in mandarin fruit during stress[J]. PLoS One,2019,14(5):e0217202.
[3]千慧敏,趙 辉,刘新涛,等. 生防细菌PA2101和PG3402抑菌和促生特性的研究[J]. 中国生物防治学报,2020,36(1):135-144.
[4]Wagi S,Ahmed A. Bacillus spp.:potent microfactories of bacterial IAA[J]. PeerJ,2019,7:e7258.
[5]荆卓琼,郭致杰,徐生军,等. 解淀粉芽孢杆菌HZ-6-3的筛选鉴定及其防治番茄灰霉病效果的评价[J]. 草业学报,2020,29(2):31-41.
[6]Pandey C,Bajpai V K,Negi Y K,et al. Effect of plant growth promoting Bacillus spp. on nutritional properties of Amaranthus hypochondriacus grains[J]. Saudi Journal of Biological Sciences,2018,25(6):1066-1071.
[7]Aydinogˇlu B,Shabani A,Safavi S M. Impact of priming on seed germination,seedling growth and gene expression in common vetch under salinity stress[J]. Cellular and Molecular Biology,2019,65(3):18-24.
[8]侯乐梅,孟瑞青,乜兰春,等. 不同微生物菌剂对基质酶活性和番茄产量及品质的影响[J]. 应用生态学报,2016,27(8):2520-2526.
[9]吕伟生,黄国强,邵正英,等. 接种菌剂腐熟稻草育秧基质提高机插稻秧苗素质及产量[J]. 农业工程学报,2017,33(11):195-202.
[10]张明宇,刘高峰,李小龙,等. 施用生物有机肥对烟草根际土壤微生物区系的影响[J]. 河南农业大学学报,2020,54(2):317-325.
[11]Asari S,Tarkowská D,Rolcˇík J,et al. Analysis of plant growth-promoting properties of Bacillus amyloliquefaciens UCMB5113 using Arabidopsis thaliana as host plant[J]. Planta,2017,245(1):15-30.
[12]Asari S,Matzén S,Petersen M,et al. Multiple effects of Bacillus amyloliquefaciens volatile compounds:plant growth promotion and growth inhibition of phytopathogens[J]. FEMS Microbiology Ecology,2016,92(6):fiw070.
[13]Yamamoto S,Harayama S. PCR amplification and direct sequencing of gyrB genes with universal primers and their application to the detection and taxonomic analysis of Pseudomonas putida strains[J]. Applied and Environmental Microbiology,1995,61(3):1104-1109.
[14]豆雅楠,牛世全,豆建濤,等. 芽孢杆菌拮抗苹果树腐烂病菌的筛选、鉴定及抑菌活性初探[J]. 微生物学通报,2018,45(12):2684-2694.
[15]国家烟草专卖局.烟草农艺性状调查测量方法:YC/T 142—2010[S]. 北京:中国标准出版社,2010.
[16]王亚男,程立娟,周启星.鸢尾对石油烃污染土壤的修复以及根
系代谢分析[J]. 环境科学,2016,37(4):1531-1538.
[17]贾慧慧,谢心悦,潘园园,等. 芽胞杆菌BJ-6的鉴定及对甜瓜细菌性果斑病的防治[J]. 微生物学报,2020,60(5):982-991.
[18]杨晓云,陈志谊,蒋盼盼,等. 解淀粉芽孢杆菌B1619对番茄的促生作用[J]. 中国生物防治学报,2016,32(3):349-356.
[19]张荣胜,戴秀华,刘永锋,等. 解淀粉芽孢杆菌Lx-11的促水稻生长作用及促生长物质分析[J]. 核农学报,2018,32(6):1230-1238.
[20]吴亚胜,王其传,祁红英,等. 育苗基质中添加丛枝菌根真菌菌剂对辣椒幼苗生长和光合参数的影响[J]. 蔬菜,2018(7):12-16.
[21]郭芳芳,谢 镇,卢 鹏,等. 一株多粘类芽孢杆菌的鉴定及其生防促生效果初步测定[J]. 中国生物防治学报,2014,30(4):489-496.
[22]Martins S J,Medeiros F,Lakshmanan V,et al. Impact of seed exudates on growth and biofilm formation of bacillus amyloliquefaciens ALB629 in common bean[J]. Frontiers in Microbiology,2017,8:2631.

