Z-型Cd ZnS/Ag/NCN异质结光催化剂的制备及可见光析氢性能研究
韦秋钰,李雅欣,李春凤,陶春兰,秦冬冬
广州大学,分析科学与技术研究中心,化学化工学院,广东广州510006
光催化析氢反应是以半导体为催化剂,水为反应物,太阳光作为驱动力的一类廉价高效的界面反应,催化性能由半导体材料的特性决定[1].该类反应在太阳能转化、清洁能源开发、环境污染物清除领域有着广泛应用和巨大的潜力,是目前研究的热点和前沿方向[2-3].经过近40年的发展,天然或人工合成的半导体材料以无机晶体材料为主[4].无机晶体一旦形成,其半导体特性基本固定,很难通过后续手段从原子水平上实现对半导体特性从表面到体相或从结构到组成的均匀改性.无机晶体的这一特点导致其结构与性能无法通过人为调控达到与实际应用要求完全匹配的水平[5],这一事实造成众多的无机光催化剂在催化效率提升和实际应用方面遭遇到了发展瓶颈.
由于类石墨相氮化碳为非金属元素组合(只有碳和氮元素),具有合适的禁带宽度、稳定的物化性质、易于改性及修饰等优点,自2009年发现氮化碳[6]这一纯有机材料具有显著光催化性能以来,氮化碳从制备方法、结构及性能改性和应用扩展等方面得到了迅猛发展,是目前光催化领域的明星材料.但是,由于高的光生电子与空穴对复合速率这一有机半导体的固有缺陷,限制了效率的进一步提升和实际应用.针对这一问题,研发出元素掺杂[6]、贵金属沉积[7]、表面敏化[8]、异质结构建[9]等对类石墨相氮化碳功能化改性方法.其中,构建Z型异质结可以在两种材料界面形成内建电场,并且能改变单一材料的能带位置,所以被认为是促进电荷分离和提高水分解反应驱动力的有效手段.另外,若用窄带隙材料与氮化碳复合,则可以拓展光谱响应范围,协同提高光催化效率.
基于Z型异质结的优势和结构特点,选用强配位能力的氮掺杂氮化碳和对可见光响应强烈的硫锌镉为半导体材料,旨在构建以单质银为界面的电荷传递媒介的Z型异质结结构,改善由于氮化碳高电荷复合率所造成的光催化析氢效率不高的缺点.采用SEM及TEM、氮气吸附法观察复合材料形貌和微结构,通过光谱法和电化学测试法对材料结构、电荷分离效率及光催化析氢性能做了细致表征和深入分析.以三乙醇胺作为牺牲剂,在可见光(λ>420 nm)照射下,复合材料表现出了优于单一材料的性能,说明合理构建Z型异质结结构是提高氮化碳光催化性能的有效有段.
1 实验部分
1.1 原料及制备方法
1.1.1 实验试剂
双氰胺(C2H4N4),购自上海麦克林生化科技有限公司;硝酸银(AgNO3),购自广州化学试剂厂;硼氢化钠(NaBH4),购自天津市大茂化学试剂厂;硫代乙酰胺(CH3CSNH2),购自上海麦克林生化科技有限公司;(CH3COO)2Cd·3H2O,购自国药集团化学试剂有限公司;(CH3COO)2Zn·2H2O,购自上海麦克林生化科技有限公司.以上试剂均为分析纯,使用前未经任何纯化.
1.1.2 光催化剂的制备
块状氮化碳合成:采用高温热聚合法合成块状氮化碳.首先将10 g的双氰胺放入加盖氧化铝坩埚并置于马弗炉中,然后以2.3℃/min的升温速率升温至550℃,在此温度下保温4 h.自然冷却后得到黄色块状氮化碳,记为CN.
氮掺杂氮化碳的合成:称取制备好的2 g块状氮化碳于瓷舟中,置于管式炉的中央加热区.重复抽真空充氮气三次后,在真空状态下通入氨气(NH3),使管式炉内的压强约为−0.09 k Pa.将管式炉密封,以2℃/min的升温速率升温至500℃,保温3 h.自然冷却后得到微白的氮化碳,记为NCN.
单质银的原位沉积:将0.5 g的NCN加入到100 mL超纯水中,超声分散0.5 h再搅拌0.5 h.然后,在NCN分散溶液中加入0.01 g的硝酸银,搅拌0.5 h后加入40 mL(0.2 mol/L)的硼氢化钠(NaBH4)水溶液,再继续搅拌3 h后沉淀离心,洗涤.最后在80℃下干燥10 h,研磨得到Ag/NCN.
不同摩尔比的Cd ZnS合成:r(Cd)∶r(Zn)∶r(S)=1∶9∶10,r(Cd)∶r(Zn)∶r(S)=2∶8∶10,r(Cd)∶r(Zn)∶r(S)=3∶7∶10,r(Cd)∶r(Zn)∶r(S)=4∶6∶10,r(Cd)∶r(Zn)∶r(S)=5∶5∶10,分别记为CdZnS-1,CdZnS-2,CdZnS-3,Cd ZnS-4和Cd ZnS-5.将(CH3COO)2Zn·2H2O溶解于25 mL去离子水中,然后加入(CH3COO)2Cd·3H2O,待溶解完全后再加入硫代乙酰胺,持续搅拌10 min.用滴加的方式将2 mol/L的NaOH溶液边搅拌边加入上述溶液中,直至溶液呈现黄绿色,pH值约为8.继续搅拌10 min后将溶液转移至25 mL的反应釜中,在160℃下反应8 h.取出反应釜使其自然冷却,将所得固体离心,洗涤,70℃干燥,即得不同摩尔比的CdZnS.
Z型复合材料的制备方法:分别称取Ag/NCN与CdZnS-1,CdZnS-2,CdZnS-3,CdZnS-4及CdZnS-5,使Ag/NCN与CdZnS的质量比为2∶1.将材料分别加入40 mL的超纯水中,超声分散30 min,然后分别将5份的Ag/NCN与5种CdZnS溶液混合,超声搅拌30 min,然后室温搅拌3 h,离心,洗涤,70℃烘干即得目标产品Z型CdZnS/Ag/NCN.
1.2 光催化剂的表征
实验利用X粉末射线衍射(PW3040/60)分析材料的晶体结构,扫描电子显微镜(JSM-7001F)观察物质表面的微观形貌.通过透射电子显微镜(JEOL JEM-2100F)分析材料的超微结构,并与X射线能谱仪(PW3040/60)结合,对元素分布进行表征.用紫外可见漫反射(U-3900)光谱仪观察固体光催化剂的光吸收性能,采用比表面积测试法(ASAP2460)获得样品的比表面积和孔径的分布情况,利用光电流响应测试(CHI660)来表征电子‒空穴分离效率.运用电化学阻抗图谱来分析电极/电解液界面转移电阻层,表征光生电荷转移速率.
1.3 产氢性能测试
采用300 W氙灯作为模拟太阳能光源(λ>420 nm,可见光范围),称取20 mg催化剂固体粉末分散于25 mL装有20%的三乙醇胺溶液中,超声30 min均匀分散,再用氮气鼓泡15 min以排掉溶液中的氧气.将光催化反应器转移至光催化产氢装置,使用GC-7920气相色谱在线检测产氢量.反应前将反应池抽真空,反应温度恒定6℃,每隔1 h自动进样,采集数据进行分析.
2 结果与讨论
图1为Z型Cd ZnS-2/Ag/NCN的扫描电子显微镜(SEM)照片.从图1可见:负载银后,氮化碳的分散性较NCN有了进一步提高;硫锌镉为大小均一,粒径小于20 nm的球状颗粒;CdZnS-2/Ag/NCN中硫锌镉的形貌不明显,这是由于层状NCN的覆盖包裹作用所导致[10].

图1 Z型CdZnS-2/Ag/NCN的SEM图(a)NCN;(b)Ag/NCN;(c)CdZnS-2;(d)CdZnS-2/Ag/NCNFig.1 SEM images of Z-type CdZnS-2/Ag/NCN
为了进一步研究复合材料的形貌和组成,对Cd ZnS-2/Ag/NCN做了透射电子显微镜(TEM)表征,如图2所示.从图2(a)可以明显观察到,NCN的片状结构和颗粒状的Cd ZnS-2.从高分辨TEM图2(b)~图2(d)可见,晶面间距d=0.22 nm和d=0.32 nm的晶格条纹分别对应Cd ZnS-2的(110)和(002)晶面,NCN呈显无定形状态.从图2(e)可见,EDS元素分析中可以检测到Cd,Zn,S和Ag等元素,面式扫描显示这些元素具有相似的分布状态,其中Ag均匀分布于材料表面.

图2 CdZnS-2/Ag/NCN复合材料(a)和(b)TEM图;(c)和(d)为晶体条纹放大图;(e)EDS元素分布图及光谱图Fig.2 Cd ZnS-2/Ag/NCN composite(a)and(b)TEM images;(c)and(d)HRTEM images;(e)EDS elemental mapping
为了确定样品的晶体结构和组成,利用X-射线粉末衍射(XRD)对样品进行了表征.图3为NCN,Ag/NCN,Cd ZnS-2和CdZnS-2/Ag/NCN的XRD图谱.从图3可以看到:NCN的两个本征衍射峰出现在12.7°和27.6°处,分别表示芳香体系的层状结构振动和芳香环振动,但是12.7°处的信号较文献中报道的纯氮化碳的要弱[11],这说明氨气参与的气相反应虽然可以在氮化碳末端引入胺基而实现氮掺杂并减弱层与层之间的弱作用力,但是氮化碳的基本结构得到了保持;Ag/NCN中没有明显的Ag衍射峰出现,可能由于银含量较少;CdZnS-2出现了(111),(110)和(112)三个衍射峰,其中27.6°的(111)面衍射峰与NCN的(002)面衍射峰重合(PDF#35-1469);在 复 合 材 料Cd ZnS-2/Ag/NCN中,NCN与CdZnS-2的衍射峰均可观察到,说明两种材料成功复合为异质结结构.
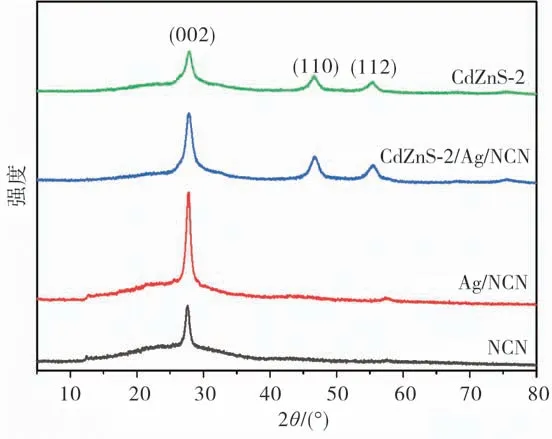
图3 NCN,Ag/NCN,CdZnS-2和CdZnS-2/Ag/NCN的XRD图谱Fig.3 XRD diffraction patterns of the NCN,Ag/NCN,CdZnS-2,and CdZnS-2/Ag/NCN
图4 为CN,NCN,Ag/NCN,CdZnS-2,CdZnS-2/Ag/NCN的FT-IR图谱.从图4(a)的红外光谱可见,NCN保留有原始氮化碳所有的红外特征峰,其中812 cm-1处为三嗪环状化合物的弯曲振动模式,1200~1700 cm-1宽大范围吸收带属于芳香型碳氮杂环的氮碳单键和氮碳双键的伸缩振动带,3000~3500 cm-1处的宽峰归因于样品表面所吸附的水分子的O—H键或N—H键的伸缩震动.从图4(b)3000~3300 cm-1处的N—H伸缩震动放大图可见,与CN相比,NCN信号强度增强,说明氨气退火在CN中引入了NH3[12].对于复合材料Cd ZnS-2/Ag/NCN,观察到的基本是NCN的特征红外信号.由于金属硫化物CdZnS-2的红外活性较弱,且Cd ZnS-2出锋位置包含在NCN的典型特征区范围,因此在复合材料中未观察到明显的CdZnS-2信号.依据红外光谱结果,结合SEM,TEM和XRD的表征可以确定,氨气退火对氮化碳的结构造成了一定改变,主要是在末端引入胺基,也就是氮掺杂.但是在人为的控制下,这种有限的改变并没有破坏氮化碳的基本骨架结构,有利于保持其半导体特征.另外,结构改变造成分散性和配位能力的提升,有助于Ag的原位还原和Z型异质结的生成.
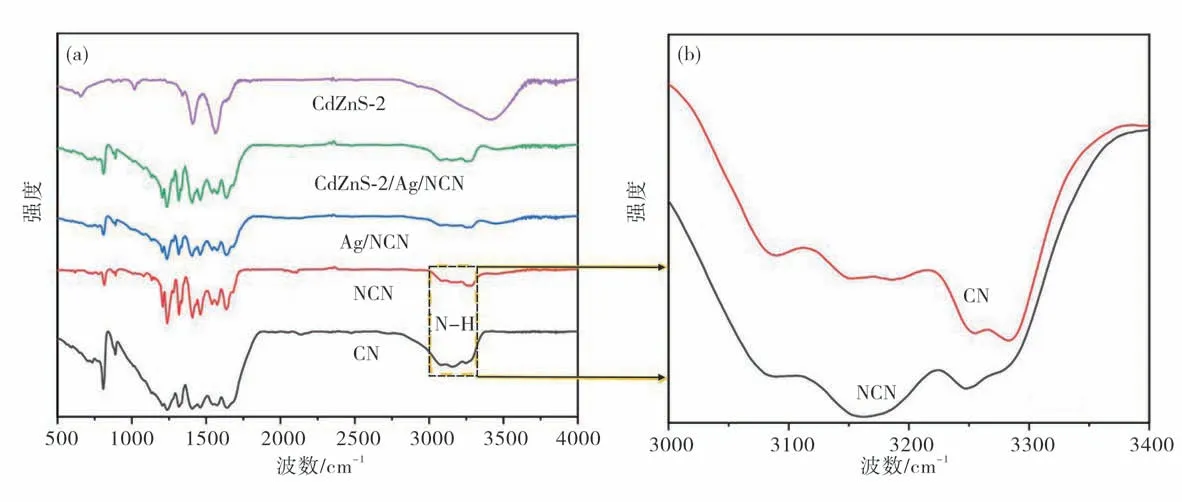
图4 CN,NCN,Ag/NCN,Cd ZnS-2,Cd ZnS-2/Ag/NCN的FT-IR图谱(a)FT-IR图谱;(b)CN和NCN在3000~3400 cm-1处的放大图Fig.4 FT-IR spectra of the CN,NCN,Ag/NCN,CdZnS-2,CdZnS-2/Ag/NCN(a)FT-IR spectra;(b)enlarged spectra of CN and NCN in the range of 3000~3400 cm-1
光催化反应过程中光生电子和空穴的迁移及复合过程,是决定材料性能的关键.为获取相关信息,对样品NCN,Ag/NCN和复合材料CdZnS-2/Ag/NCN进行了稳态荧光光谱和荧光寿命测试(图5(a)).从图5(a)可以看出,三种样品发射峰的位置和峰形相似,NCN比Ag/NCN和CdZnS-2/Ag/NCN具有更高的发光强度.一般情况下,半导体的荧光光谱主要来自于电子和空穴的复合所产生的能量辐射.荧光越强,说明光生载流子复合率越高,反之荧光越弱,说明载流子分离效率越高[13].相比较而言,CdZnS-2/Ag/NCN具有最低的荧光强度,说明异质结的形成可以有效阻碍光激发载流子在单一材料中的复合.
为了进一步验证这一结论,收集了样品的时间分辨荧光衰减曲线(图5(b)).从图5(b)可见,CdZnS-2/Ag/NCN(3.26 ns)的 辐 射 寿 命 比NCN(3.37 ns)的更短,说明Cd ZnS-2/Ag/NCN复合材料有助于提高电子和空穴的转移效率[14-16].
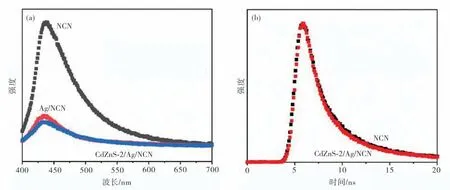
图5 光致发光光谱(a)及时间分辨荧光光谱(b)Fig.5 Photoluminescence spectra(a)and time-resolved photoluminescence spectra(b)
图6 为试样的紫外‒可见漫反射光谱图及带隙计算.从图6(a)可见:纯CdZnS-2大约在460 nm处出现吸收边缘,而NCN的吸收边缘大约在430 nm左右处;CdZnS-2/Ag/NCN复合材料在可见光区域的吸收强度,高于NCN和CdZnS-2单一材料.

图6 紫外‒可见漫反射光谱图(a)及带隙计算图(b)Fig.6 UV-visible diffuse reflection spectra(a)and band gap calculation(b)
材 料 带 隙 值 可 由 公 式αhv=A(hv-Eg)n/2获得[17],公式中的n表示半导体材料的不同跃迁特性.由于CdZnS-2和NCN为直接跃迁,取n=1,计算结果如图6所示.从图6可见,CdZnS-2和NCN的带隙值分别为2.52和2.86 eV.结果表明,把能级位置合适的窄带隙半导体与氮化碳复合,可以有效延伸氮化碳的光谱响应范围.
固‒液接触面的大小对界面催化反应有着举足轻重的影响,因此采用氮气吸附法研究了CdZnS-2/Ag/NCN,NCN及Ag/NCN的比表面积和多孔结构(图7).从图7(a)可见,三种样品的氮气吸附解吸等温线为IV型.从图7(b)可以看出,三种样品的孔径分布于2~30 nm之间,CdZnS-2/Ag/NCN的比表面积为69.633 m2/g,Ag/NCN的比表面积为64.865 m2/g,NCN的比表面积为39.647 m2/g,发现随着样品异质结的形成,材料的比表面积也随之增加.一般而言,比表面积的增加可以提供更多的活性位点,与水分子的接触面积更大,有利于提高光催化析氢性能.

图7 比表面积(a)及孔径分布图(b)Fig.7 specific surface area(a)and pore size distribution(b)
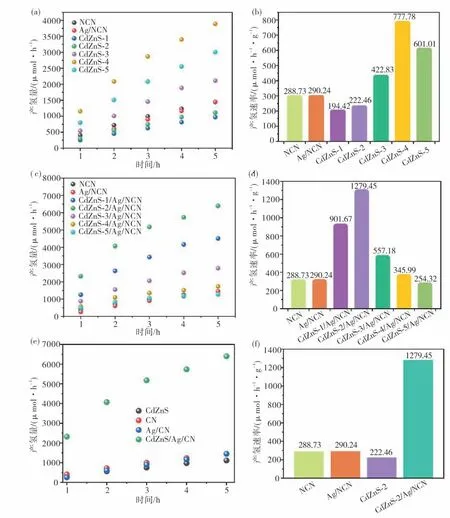
为了验证材料的光电性能,分别以CdZnS-2,NCN,Ag/NCN及Cd ZnS-2/Ag/NCN为光阳极,测试了光电流响应(图8).从图8(a)可见,四个样品在100 s五个on-off周期内,可以产生明显的阳极光电流响应.这是由于光催化剂在可见光的驱动下,价带电子吸收光能而被激发跳跃到导带,再从导带收集到背电极,通过外电路循环到对电极,发生水还原反应.相应地,价带中的空穴注入电解液发生水氧化反应.阳极光电流没有出现瞬态尖峰响应,说明光生电子与空穴能较好实现分离,表面空穴累积所造成的电子回流不明显.从测试结果来看,复合材料Cd ZnS-2/Ag/NCN的光电流效应都强于单一样品,这说明所构建的异质结可以增强氮化碳体相电荷分离,这与稳态荧光和荧光寿命的测试结构一致.除了体相电荷分离,界面电荷转移过程对半导体光电性能也起着重要作用.因此,在光照下对样品进行了电化学阻抗表征.由于高频处的半径对应电荷转移电阻的大小,阻抗半径越小,表明电极界面上的电荷转移速率越快,对于研究的n型半导体来说,就是空穴注入速率越快.从图8(b)电化学交流阻抗谱图可见,四种样品的阻抗图半径大小为Cd ZnS-2/Ag/NCN 图8 可见光照射条件下瞬态光电流响应图及电化学交流阻抗谱图(a)光电流响应;(b)交流阻抗Fig.8 Visible light photocurrent response and electrochemical impedance spectra(a)photocurrent response;(b)electrochemical impedance spectra 图9 为各样品在可见光照射下的光催化析氢活性.从图9(a)和图9(d)可见:单一组分不同Cd/Zn摩尔比的硫锌镉,其平均析氢速率在194.72~777.78μmol/(h·g)之间;当Cd/Zn摩尔比为4∶6时析氢效率达到最大值(777.78μmol/(h·g)),继续增加Cd含量至Cd/Zn摩尔比为5∶5时的析氢效率稍有下降(601.01μmol/(h·g)).表明,硫锌镉的光催化性能受Cd/Zn摩尔比的影响较为显著,随着Cd含量的增加析氢活性增强.当把不同Cd/Zn摩尔比的硫锌镉和NCN复合构成异质结后(图9(b)和图9(e)),复合材料Cd ZnS-X/Ag/NCN的析氢活性最高的不是Cd ZnS-4/Ag/NCN,而是Cd ZnS-2/Ag/NCN,效率可达1279.45μmol/(h·g).这一数值比Cd ZnS-2高5.8倍,比NCN和Ag/NCN高4.4倍(图9(c)和图9(f)).这一结果证实,电荷分离与光吸收性能的改善是提高光催化析氢效率的重要手段. 图9 样品在可见光照射下的析氢速率(5 h)及平均析氢速率(a)~(c)析氢速率;(d)~(f)平均析氢速率Fig.9 Visible-light-driven hydrogen evolution(5 h)and average hydrogen evolution rate(a)-(c)hydrogen evolution(5 h);(d)-(f)average hydrogen evolution rate 氨气参与的气相反应可以在氮化碳中引入胺基,形成氮掺杂氮化碳.相较于纯氮化碳,氮掺杂氮化碳具有更好的水相分散性和更高的配位能力,有利于原位沉积Ag单质和形成高质量异质结.Z型Cd ZnS-2/Ag/NCN比单一材料具有更高的阳极光电流和可见光析氢性能.研究发现,复合材料性能优于单一材料的原因主要是由于体相电荷分离与界面空穴转移速率得到了明显的加快.相对于纯氮化碳来说,复合材料光催化性能的提高也有比表面积增加和光谱响应范围拓展的协同影响.该研究表明,构建Z型异质结是克服电荷分离/转移困难这一氮化碳作为光催化剂固有缺陷的有效手段.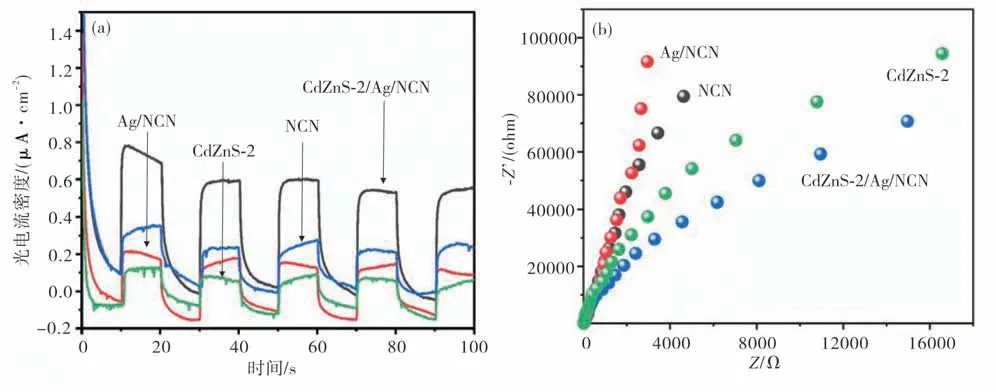
3 结论

