河南商丘月季炭疽病的病原菌鉴定及生物学特性
娄喜艳 王欣阳 裴冬丽

摘要:为鉴定河南省商丘市月季炭疽病病原菌种类及其生物学特性,对月季炭疽病的防治提供理论指导,2019年10月在商丘市长征路采摘患炭疽病的月季病株,对患病叶片采用单孢分离方法,经过纯化得到1株病原菌。通过室内人工接种的方法对该病原菌进行致病性测定,发现该菌株能使健康月季叶片出现病斑,对此病斑进行病原菌再分离可得到原接种病原菌。对菌株显微形态学分析表明,该菌株分生孢子呈长圆形、无色、单孢;分生孢子大小为(15.6~21.5)μm×(3.5~5.2)μm;菌丝有明显的隔膜;气生菌丝发达。通过测序、比对和利用ITS、ACT、GAPDH、CHS基因进行多基因系统进化树分析,发现该菌株与胶孢炭疽菌(Colletotrichum gloeosporioides)聚在一起。结合形态学特征及分子生物学鉴定分析,确定河南商丘市月季炭疽病是由胶孢炭疽菌(C. gloeosporioides)侵染所致。通过对不同处理的培养基影响菌丝生长状况的分析可得,该菌株生长的最适温度为28 ℃;pH值为5时最有利于菌丝的生长;在24 h暗处理条件下菌丝生长速度最快;在以蛋白胨和硝酸钾为氮源的培养基中菌丝生长较快;淀粉是该菌丝的最适碳源。
关键词:月季;炭疽病;形态学鉴定;分子生物学鉴定;生物学特性;多基因系统发育
中图分类号:S436.8+1 文献标志码: A
文章编号:1002-1302(2021)22-0116-05
收稿日期:2021-08-27
基金项目:河南省高等学校青年骨干教师培养资助项目(编号:2018GGJS191)。
作者简介:娄喜艳(1984—),女,河南商丘人,硕士,副教授,主要从事植物生理学教学与研究。E-mail:lounan2005@163.com。
通信作者:裴冬丽,博士,教授,主要从事植物分子遗传学研究。E-mail:peidongli@126.com。
月季(Rosa chinenisis Jacq.)被称为花中皇后,属于蔷薇科蔷薇属植物,月季四季都能开花,并且花色艳丽,既可作为城市中的观赏植物,也可作为药用植物。中国是月季原产地之一,月季在我国的大多城市中都被作为绿化植物,特別是近几年来,月季的种植面积不断增加[1]。但由于培养条件和管理方法不合理导致病原菌侵入,影响月季花和果实的生长,甚至最终导致植株死亡。目前,月季病害文献报道的常见月季病害种类有10种,其中真菌性病害有7种,分别为白粉病、黑斑病、霜霉病、灰霉病、叶霉病、锈病、月季枝枯病;细菌性病害1种,为根癌病;病毒病害1种;及生理性疾病因所致的月季缺素症[2]。
炭疽病是一种常见的植物病害,可使多种经济作物受害,包括果树、绿化植物等。炭疽病主要危害果实和叶片,产生棕褐色或黑褐色病斑,严重时引起植株落叶、落果。炭疽病在夏季高温,湿度大的地区容易发生。引起炭疽病的病原菌是炭疽菌属(Colletotrichum),它的种类很多,其中胶孢炭疽菌(C. gloeosporioides)是炭疽菌属种类最多的一个种,分布广泛,能引起苹果、梨、棉花、葡萄、冬瓜、黄瓜、辣椒等多种植物的炭疽病[3]。目前,月季炭疽病在国外报道中,Rivera等于2000年在阿根廷从患有枯萎病和炭疽病的月季植株中分离出病原菌胶孢炭疽菌(C. gloeosporioides)[4],在国内Feng等发现引起湖南省长沙市月季炭疽病的病原菌是暹罗炭疽菌(Colletotrichum siamense)[5]。
由于炭疽菌属(Colletotrichum)形态学特征相似,因此分子生物学鉴定技术在近年来迅速发展。开始时通常采用ITS序列进行分子生物学鉴定,通过ITS引物扩增目的基因,然后构建系统进化树,但是ITS 序列不能区分炭疽菌属的近缘种,因此多基因进化树分析更为可靠,常用的扩增引物序列包括ITS、ACT、CAL、GAPDH、CHS、TUB等。
河南省商丘市的市花是月季,2019年10月在市区内的长征路、南京路、文化路的道路两旁发现了严重感染炭疽病的月季。为探究商丘市月季炭疽病病原菌种类和生物学特征,采摘了商丘市长征路月季患病叶片,对炭疽病病原菌进行了形态学、致病性、分子生物学鉴定,并研究其生物学特征,以期为月季炭疽病的防治和抗病育种提供科学依据。
1 材料与方法
1.1 材料
1.1.1 供试植株 2019年10月于河南省商丘市长征路采集月季患炭疽病病株用于病原菌的分离与鉴定。
1.1.2 试剂和培养基 TAE溶液、琼脂糖、DNA Marker (DL2000)、TaqMixture、10×Loading buffer 引物 (ITS1和 ITS4)合成、ddH2O、核酸染料GoldView等。
马铃薯葡萄糖琼脂(potato dextrose agar,简称PDA)培养基:马铃薯先洗净去皮,然后称取200 g切成小块,加水小火煮烂(煮到玻璃棒能戳破即可),用6層纱布过滤到烧杯中,称取20 g葡萄糖倒入,搅拌混匀,待葡萄糖溶解完后加入20 g的琼脂,稍冷却后用蒸馏水定容至1 L,分装至250 mL的锥形瓶,加塞、包扎,120 ℃灭菌20 min左右后取出,放入超净工作台中,接着倒入灭过菌的培养皿中备用。
1.2 方法
1.2.1 病原菌分离 采用单孢分离法。选取有典型病斑的叶片,在病健交界处切取5 mm×5 mm的组织块,在75%乙醇中浸泡消毒30 s,然后用无菌水连续漂洗3次,再用2%次氯酸钠浸泡1 min后用无菌水浸洗3次,放在灭菌滤纸上晾干后转至PDA 培养基上,用最后1遍的清洗液涂布平板做阴性对照,然后将培养基放入真菌培养箱中28 ℃下恒温培养,3 d后观察菌丝生长状况。再重新取菌丝尖端接种于 PDA 培养基中央,重复操作至分离菌株纯化。
1.2.2 病原菌形态学鉴定 拍照记录培养皿上的病原菌菌落生长形态及菌落正反面颜色、菌丝疏密程度等菌落特征,从培养基上挑取少许菌丝,放在含有1滴无菌水的载玻片上,然后在光学显微镜下观察菌丝及孢子特征,如分生孢子的大小、形状、分生孢子梗及有無隔膜等。
1.2.3 病原菌分子生物学鉴定 提取DNA采用改良的CTAB法,具体操作步骤为试验前先把异丙醇放于-20 ℃冰箱中预冷,70%乙醇4 ℃预冷,打开水浴锅加热到58 ℃。用灭菌枪头刮取 0.1 mL 菌丝置于1.5 mL离心管中,向离心管中加入少量石英砂(约20 μL),然后加300 μL的2% CTAB提取缓冲液,用研磨棒研磨充分(5 min左右)。再加入 200 μL 2% CTAB提取缓冲液,取出研磨棒,于 58 ℃ 水浴1 h后冷却至室温(水浴时每 10 min 颠倒混匀1次)。然后加入相同体积的氯仿/异戊醇(24 ∶1),来回颠倒混匀,10 000 r/min离心10 min,离心时将10% CTAB提取缓冲液65 ℃水浴加热。离心后用移液器取上清液于另一个无菌离心管中(约300 μL),加1/10体积的(约 30 μL)10% CTAB缓冲液(65 ℃浴热),来回颠倒摇匀,加等体积 330 μL 的氯仿/异戊醇(24 ∶1),来回颠倒混匀,10 000 r/min 离心10 min。离心后取上清液于新离心管中(约250 μL),加等体积预冷的异丙醇,轻轻混匀,-20 ℃放置30 min,然后再次离心,参数设置为12 000 r/min,4 ℃,离心 10 min。接着倒掉上清液,倒置直至离心管壁无水滴,然后加 1 mL 预冷的70%乙醇进行洗涤,10 000 r/min 离心5 min。上述洗涤步骤重复1次,洗涤完倒掉上清,用枪头吸去剩余的液体(避免吸到沉淀),在超净工作台上打开风机,完全风干(30 min 左右)。最后向试管中加入 30 μL 左右去离子水,-20 ℃保存。
分别利用真菌引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)/ITS4(5′-TCCTCCGCTTATTGATATGC-3′)、Actin-512F(5′-ATGTGCAAGGCCGGTTTCGC-3′)/Actin-783R(5′-TACGAGTCCTTCTGGCCCAT-3′)、GDF(5′-GCCGTCAACGACCCCTTCATTGA-3′)/GDR(5′-GGGTGGAGTCGTACTTGAGCATGT-3′)和CHS-79F(5′-TGGGGCAAGGATGCTTGGAAGAAG-3′)/CHS-345R:(5′-TGGAAGAACCATCTGTGAGAGTTG-3′)分别对分离得到的病原菌进行PCR扩增和琼脂糖电泳检测,PCR反应体系共50 μL,其中模板DNA 3 μL,上游引物1 μL,下游引物1 μL,Taq Mixture 25 μL,去离子水20 μL,混合后轻微离心,设置PCR反应程序为94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸1 min(35个循环);72 ℃10 min,扩增后4 ℃保存。最后将扩增得到的产物做好标记送去公司测序。
1.2.4 系统进化分析 将测序得到的序列在GenBank上用BLAST进行同源性比较,下载具有登录号的相关同源序列,然后用MEGA 7软件比对剪切,最后按照ITS-ACT-GAPDH-CHS的顺序分别首尾相连,以薯毛链孢(Monilochaetes infuscans)为外群,利用MEGA 7软件以邻位法构建系统发育树。
1.2.5 分离菌株致病性测定 采用菌饼接种法测定分离的炭疽菌菌株致病性。将分离纯化后的株菌转至 PDA培养基上,于28 ℃黑暗培养6 d后,用5 mm灭菌打孔器平板边缘打下菌饼,用灭过菌的牙签在生长状况相同的健康月季叶片上扎10个左右伤口,然后将菌饼接种到伤口上,该处理3次重复,以PDA培养基作为对照。
将接种后的叶片置于铺有保湿并无菌脱脂棉的培养皿内,置于室温(25~27 ℃)培养,每天观察并记录发病状况。取病叶进行病原菌再分离,并将分离获得的病原菌与接种病原菌进行比较。
1.2.6 分离菌株生物学特性分析 研究不同光照、温度、pH值下对菌丝生长状况的影响。将直径为 5 mm 的菌饼接种到PDA培养基上,然后分别置于24 h光照、12 h光照12 h黑暗、24 h黑暗条件下培养;设置6个pH值梯度,即pH值为 5、6、7、8、9、10,将灭过菌的PDA培养基用1 mmol/L NaOH和 1 mmol/L 的HCl调节pH值,接着将菌饼接种到不同处理的PDA培养基上,置于培养箱中培养;将直径5 mm的菌饼接种到PDA培养基上,在4~37 ℃条件下设置5个水平进行培养,即4、20、28、30、37 ℃。以上每个处理做3个重复,4 d后测量菌落直径并计算平均值。
不同氮源、碳源下菌丝的生长试验:以Czapek培养基为基础培养基,然后用含碳量相同的乳糖、淀粉、蔗糖、葡萄糖、麦芽糖、果糖替代Czapek培养基的碳源,用含氮量相同的硫酸铵、蛋白胨、硝酸铵、硝酸钾、磷酸氢二铵、硝酸钠替代Czapek培养基的氮源,用不加碳源和氮源的Czapek培养基作为对照,接着将直径为5 mm菌饼接种于培养基中,每个处理3次重复,置于真菌培养箱中培养,4 d后测量菌落直径。
1.3 数据分析
将测量菌落直径大小的数据输入Excel表中,然后将数据导入SPSS软件中进行方差分析,用Duncans法分析不同处理间的显著性差异。
2 结果与分析
2.1 病害的发病症状
月季炭疽病主要危害月季叶片,在嫩叶和老叶中都会发生,多在叶缘和叶尖发病,发病初期绿色叶片先出现不规则褐色病斑,叶片略下陷,然后病斑逐渐扩大,病斑周围出现黄色晕圈(图1)。
2.2 病原菌的形态特征
从月季炭疽病患病叶片中分离出一个菌株命名为SQYJCG-1,而接无菌水的对照组无菌落生长。菌落呈圆形,平坦,边缘整齐,气生菌丝绒毛状。菌落背面初期为白色,4 d 后开始从内往外逐渐变为橙色,7 d 后整个菌落背面为浅橙色,在培养基上留下黑色素(图2-A、2-B)。通过显微镜观察发现菌丝有明显的隔膜,并具有分支,分生孢子梗无色,分生孢子长圆柱形,两端钝圆或一端稍钝一端稍尖,单孢,无色,大小为(15.6~21.5)μm×(3.5~5.2)μm(图2-C、2-D)。根据形态学特征,初步判定菌株SQYJCG-1属于胶孢炭疽菌(C. gloeosporioides)。
2.3 分子生物学鉴定
以月季炭疽病致病菌SQYJCG-1的 DNA 为模板进行 PCR 扩增。PCR 产物测序,所得的测序结果提交到GenBank中,获得的登录号分别为ITS序列:MZ021314;ACT序列:MZ128791;GAPDH序列:MZ128789;CHS序列:MZ128790。然后在NCBI基因数据库中进行 BLAST 對比并与 GenBank 已登录的相似序列进行同源性对比,结合ITS、ACT、GAPDH、CHS基因利用MEGA 7软件的 Neighbor-joining构建多基因系统发育树,以薯毛链孢(Monilochaetes infuscans)为外群,结果显示该致病菌
SQYJCG-1与C. gloeosporioides形成明显的分支(图3),而与薯毛链孢亲缘关系较远。
2.4 病原菌致病性测定
从校园内采摘形状、大小相近的月季健康叶片,用无菌水洗净,然后用乙醇棉球轻轻擦拭表面进行消毒,刺伤后接SQYJCG-1菌饼,4 d后叶片开始发病,发病率达到100%。叶片接种菌丝块的周围变褐,逐渐向外扩散和蔓延,病斑周围失绿并渐渐发黄(图1)。用PDA培养基接种的月季健康叶片未见发病症状。按照科赫氏法则,从接种发病的病组织再次分离出该病原菌,菌落形态、孢子形态与接种菌株一致。因此可得月季炭疽病是病原菌SQYJCG-1侵染所致。
2.5 炭疽病病原菌的生物学特性
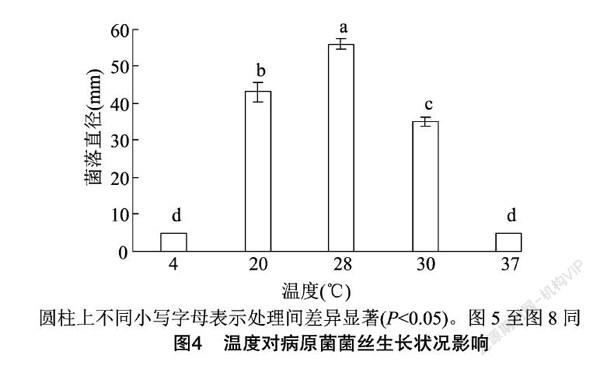
2.5.1 光照、温度、pH值对病原菌菌丝生长的影响 温度对病原菌SQYJCG-1的生长具有一定影响,从图4可以看出,胶孢炭疽菌(C.gloeosporioides)在温度为20~30 ℃均能生长,在温度为28 ℃条件下菌落直径最大,该温度为其最适生长温度,病原菌在4、37 ℃环境条件下几乎不能生长。分析结果表明,不同温度之间对菌丝生长影响具有显著差异。
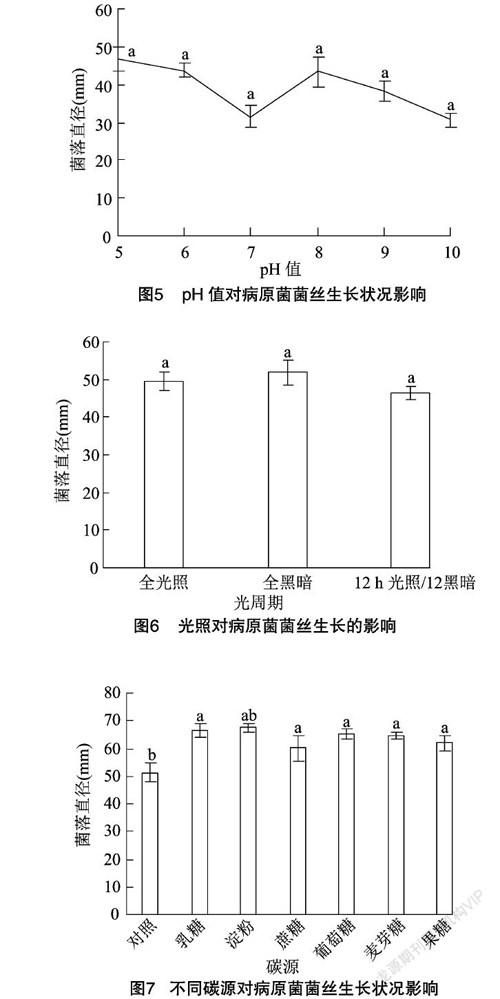
由图5可见,供试菌株SQYJCG-1在pH值 5~10都能生长,最适生长pH值是5,在此条件下,菌丝生长速度最快,菌落直径达到46.67 mm。分析表明, 不同pH值对供试菌株的生长影响不显著。
光照对病原菌SQYJCG-1生长影响的测定结果见图6,每天24 h黑暗条件下菌丝生长最快,菌落直径最大,长度为51.83 mm,12 h光照与12 h黑暗交替处理时, 菌丝直径最小。不同光处理之间菌丝生长状况的差异不显著。
2.5.2 不同碳源、氮源对病原菌菌丝生长的影响 从图7可以看出,菌株SQYJCG-1在提供的7种不同碳源培养基中都能生长,在不加碳源的培养基中菌丝生长最慢。以淀粉为碳源最适合菌丝生长,此条件下菌丝生长最快,其次是以乳糖为碳源培养基,二者之间没有显著差异。通过方差分析,不同碳源之间差异不显著,与对照组的差异显著。
从图8可以看出,以蛋白胨为氮源的培养基最适合菌丝生长,其次是硝酸钾,在对照组和以硫酸铵为氮源的培养基条件下,菌丝生长比较缓慢。分析结果表明,不同氮源之间的差异显著。
3 讨论
炭疽病菌是多种植物的致病菌,胶孢炭疽菌作为植物炭疽病的病原菌在国内外有许多研究报道,是蓝莓[6]、葡萄[7]、梨[8];卫矛[9]等植物的炭疽病致病病原菌。植物炭疽病存在一病多菌的现象, 患病
植株生长的环境不同,其优势种群不同[10]。将该试验与国内首次报道引起月季炭疽病病原菌的是暹罗炭疽菌(C. siamense)相结合可得,胶孢炭疽菌和暹罗炭疽菌都可以引起月季炭疽病,这与王杰等鉴定红叶石楠炭疽病病原菌是胶孢炭疽菌和暹罗炭疽菌的结果[11]类似。
ITS序列分析是炭疽病分子分类鉴定中最早、最多的方法[12]。由于胶孢炭疽是一个复合种群,目前认为,胶孢炭疽菌复合种群包括 23 个种和 1 个亚种[13],所以以形态学鉴定为基础,结合分子系统学研究,如rDNA-ITS、ACT、CHS等多个基因进行系统发育分析,可提高病原菌鉴定工作的可靠性[14]。
本试验采用单孢分离法、形态学鉴定和分子生物学方法对月季炭疽病病原菌进行了初步研究,最终鉴定商丘市月季炭疽病病原菌是胶孢炭疽菌SQYJCG-1,并且通过对该菌株的生物学特性分析,发现该病原菌的生长的最佳培养温度为28 ℃,最适pH值为5,最适碳源、氮源分别为淀粉、蛋白胨,菌丝在24 h暗处理条件下菌丝生长速度最快。本试验为月季抗病品种的筛选提供了理论基础,并为月季疾病管理策略提供了病原菌鉴定信息。
参考文献:
[1]中国花卉协会月季分会.中国月季发展报告(第2版)[J]. 农业科技与信息(现代园林),2014,11(5):44-47.
[2]谭 鹏,夏兴雷,王彦庆.月季主要病害的发生与防治[J]. 西北林学院学报,2006,21(1):114-117.
[3]江 晶,江 彤,李 瑞,等. 苹果炭疽菌的分子鉴定与检测[J]. 激光生物学报,2010,19(5):695-699.
[4]Rivera M C,Wright E R,Carballo S.First report of Colletotrichum gloeosporioides on Chinese rose in Argentina[J]. Plant Disease,2000,84(12):1345.
[5]Feng F S,Zhou G Y,Li H.First report of Colletotrichum siamense causing anthracnose on Rosa chinensis in China[J]. Plant Disease,2019,103(6):1422.
[6]徐成楠,王亚南,胡同乐,等. 蓝莓炭疽病病原菌鉴定及致病性测定[J]. 中国农业科学,2014,47(20):3992-3998.
[7]邓维萍,杜 飞,杨 敏,等. 云南葡萄炭疽病菌遗传多样性分析[J]. 云南农业大学学报(自然科学),2015,30(2):173-184.
[8]刘邮洲,陈志谊,钱国良,等. 梨胶胞炭疽病菌的分离、鉴定及其生物学特性[J]. 江苏农业学报,2013,29(1):60-64.
[9]Huang L,Li Q C,Zhang Y,et al. Colletotrichum gloeosporioides sensu stricto is a pathogen of leaf anthracnose on evergreen spindle tree (Euonymus japonicus)[J]. Plant Disease,2016,100(4):672-678.
[10]李沛利,李 娟,龔国淑,等. 四川省鹅掌柴炭疽病病原菌的初步鉴定[J]. 植物病理学报,2017,47(3):296-304.
[11]王 杰,沈雪梅,刘 丹,等. 四川省红叶石楠炭疽病病原菌鉴定及其潜在侵染源测定[J]. 植物保护学报,2020,47(3):637-646.
[12]向梅梅,张云霞,刘 霄. 炭疽菌属真菌分类的研究进展[J]. 仲恺农业工程学院学报,2017,30(1):59-66.
[13]Weir B S,Johnston P R,Damm U. The Colletotrichum gloeosporioides species complex[J]. Studies in Mycology,2012,73:115-180.
[14]李戌清,严建立,阮松林.三叶青炭疽病病原菌的鉴定与生物学特性[J]. 浙江农业学报,2020,32(11):2009-2019.

