青蒿素对奶牛乳腺上皮细胞乳脂合成相关基因表达的影响
侯 昆 李 欣* 沈义媛 詹经纬 牛 慧 熊本海 童津津** 蒋林树**
(1.北京农学院动物科学技术学院,奶牛营养学北京市重点实验室,北京 102206;2.中国农业科学院北京畜牧兽医研究所,北京 100193)
乳汁分泌是乳腺组织的分泌细胞以血液中的各种营养物质为原料,在细胞中生成乳汁后分泌到腺泡腔中的过程[1]。奶牛乳腺上皮细胞(BMECs)执行泌乳功能,其分泌活性对牛乳生产至关重要[2]。牛乳中基本营养物质的含量受多种因素的影响而发生变化,其中变化最大的成分就是乳脂[3]。据报道,乳脂主要由甘油三酯(TG)、甘油二酯、游离氨基酸、酸磷脂和胆固醇等组成,其含量是鉴定乳品质的重要指标之一[4]。乳脂在牛乳中的含量为3%~5%,但我国的乳脂率水平一直不高,缺乏市场竞争力,乳品质低下已成为制约我国奶业持续健康发展的关键问题,故探索提高乳品质的手段和方法迫在眉睫。饲料的有效利用可以提高奶牛的泌乳性能,其中植物提取物饲粮添加剂因其具有较强的抗菌、抗氧化等特性,在动物无抗饲料中替代抗生素和改善动物产品品质等方面具有广阔的应用前景。青蒿是一年生草本植物,其提取物内含有倍半萜内酯化合物且具有抗氧化、抗炎和提高免疫力等多种生物学功能[5]。本团队前期研究结果发现,对患有隐性乳房炎的奶牛饲喂青蒿提取物(60 g/d)后,血清中的白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、丙二醛(MDA)含量显著降低,而超氧化物歧化酶(SOD)活性具有上升的趋势,证明青蒿素可改善奶牛的产奶性能,增强机体抗氧化能力与免疫功能,同时显著降低乳汁中体细胞数(SCC)[6-7]。Hunt等[8]研究发现,嗜中性粒细胞在被细菌脂多糖(LPS)激活的情况下,添加青蒿提取物(100~200 μg/mL)可显著抑制活化的嗜中性粒细胞产生TNF-α,改善机体炎症反应。此外,青蒿提取物可通过阻断核转录因子-κB(NF-κB)信号转导途径,减少炎症介质的合成和释放,从而降低体液和细胞免疫反应[9]。由于青蒿提取物中含有的大量酚类和黄酮类化合物,可以诱导γ-谷氨酰半胱氨酸合成酶的转录来增加细胞内谷胱甘肽含量,使得细胞抗氧化防御系统更加稳定,进而预防或中和自由基的破坏作用[10-11]。因此,青蒿素作为一种绿色安全抗生素替代物,在提高奶牛生产性能和免疫功能方面,具有重要的意义。
腺苷酸活化蛋白激酶(AMPK)为一种调节机体能量代谢的重要分子,也是调控脂类代谢的核心物质。据报道,机体中AMPK作为一种糖脂代谢的关键酶参与多种信号通路的调节,AMPK激活抑制机体内脂肪酸及胆固醇的合成及代谢,调控脂肪组织的生成[12-13]。固醇调节元件结合蛋白(SREBP)作为核转录家族的一员,其中固醇调节元件结合蛋白1-c(SREBP1-c)主要参与机体脂类合成相关酶的激活,可通过靶向基因乙酰辅酶A羧化酶(ACC)、硬脂酰辅酶A去饱和酶1(SCD1)和脂肪酸合成酶(FASN)等脂肪酸催化酶的表达,调节乳脂的合成[14];目前已证明,SREBP1-c为调节BMECs乳脂合成的关键调节分子,促进葡萄糖的转运来提高脂肪酸的合成[15]。然而,青蒿提取物对BMECs乳脂的合成是否有影响,尚未见报道。因此,本试验基于磷脂酰肌醇3-激酶-丝氨酸/苏氨酸蛋白激酶-哺乳动物雷帕霉素靶蛋白(PI3K-AKT-mTOR)和AMPK-mTOR乳脂合成关键信号通路,研究青蒿素对奶牛乳脂合成影响,为青蒿素作为奶牛功能性添加剂提供一定的理论依据。
1 材料与方法
1.1 主要试剂与仪器
试验主要试剂:青蒿素(CAS:63968-64-9,货号:361593,纯度99%)购于Sigma公司;DMEM/F12培养基、胎牛血清(FBS)、0.25%胰蛋白酶-乙二胺四乙酸(EDTA)购自Gibco公司;OMEGA Total RNA Kit Ⅰ试剂盒、cDNA合成试剂盒、BCA蛋白浓度测定试剂盒、细胞裂解液(P0013)、蛋白酶磷酸酶抑制剂混合物(P1046)、蛋白上样缓冲液(P0015)、电泳液(P0014B)、Western转膜液(P0021B)、凝胶配制试剂盒(P0012A)、洗涤液(P0023C6)、QuickBlockTMWestern封闭液(P0252-500 mL)、考马斯亮蓝快速染液(P0017)、丽春红染色液(P0022)、转印滤纸(FFP51)、聚偏二氟乙烯(PVDF)膜(FFP32)、荧光检测试剂(P0018S)、彩色预染蛋白质分子质量标准10~180 ku(P0069)均购于碧云天生物技术有限公司;AMPK(一抗)、磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR)(一抗)、丝氨酸/苏氨酸蛋白激酶1(AKT1)(一抗)、磷酸化丝氨酸/苏氨酸蛋白激酶(p-AKT)(一抗)、过氧化物酶体增殖物激活受体γ(PPARγ)(一抗)、β-肌动蛋白(β-actin)(一抗)均购于CST公司;mTOR(一抗)购于Proteintech公司;SREBP1-c(一抗)、山羊抗兔免疫球蛋白G(IgG)与山羊抗鼠IgG均购于Santa公司;PI3K(一抗)、磷酸化磷脂酰肌醇3-激酶(p-PI3K)(一抗)均购于北京博奥森公司;细胞周期蛋白D1(Cyclin D1)(一抗)购于Abcam公司。
试验主要仪器:实时荧光定量PCR仪(lightcycler 96,瑞士),DeNovix核酸蛋白定量仪(DS-11,美国),电泳仪(BIO-RAD,美国),Mini Trans-Blot Cell(BIO-RAD,美国),Mini PROTEAN Tetra Cell电泳槽(BIO-RAD,美国),水平脱色摇床(CX-S800,上海舍岩),全自动化学发光图像分析系统(Tanon-4600,北京原平皓)。
1.2 细胞培养与试剂配制
BMECs来自于东北农业大学动物生物化学与分子生物学实验室的惠赠。在37 ℃水浴锅内将冻存的细胞解冻,完全融化后用酒精擦拭冻存管转移到超净台中,使用1 mL移液器将细胞取出放入预热的培养液中并混匀细胞,离心除去上清液。加入12 mL培养液后转移到培养皿中,于37 ℃、5% CO2条件下培养。当细胞贴壁率达到90%用0.25%胰酶(含0.02% EDTA)对细胞进行纯化和传代,本次试验采用3~5代细胞。
青蒿素依据试剂说明书进行配制,经二甲基亚砜(DMSO)将其浓度分别配制为10、20、40、60、80、100 μmol/L,用于后续试验分析。
1.3 测定指标与方法
1.3.1 BMECs增殖测定
将细胞接种到96孔板中,待细胞贴壁后弃去原培养液,分别加入150 μL含有10、20、40、60、80、100 μmol/L的青蒿素培养基,与细胞共培养1、3、6、9、12、24 h,每孔及每个时间点设立6个重复和6个空白对照。共培养结束后每孔加入噻唑蓝(MTT)溶液10 μL,培养箱孵育4 h后每孔加入100 μL Formazan溶解液,混匀,在培养箱中继续孵育3~4 h后,用全自动酶标仪检测570 nm波长下每个培养孔的吸光度(OD)值。
1.3.2 BMECs内乳脂合成产物的检测
细胞内脂滴含量利用油红O脂肪染色法进行检测。将BMECs接种于6孔板中培养12 h细胞贴壁后洗涤细胞,每孔加入150 μL含有10、20、40、60、80、100 μmol/L的青蒿素培养基,继续培养12 h,每孔及时间点设立6个重复和6个空白对照。细胞培养结束后弃去培养液,D’Hanks缓冲液洗涤细胞,使用2 mL 4%多聚甲醛固定30~40 min后弃溶液,用D’Hanks缓冲液洗涤2次,加油红O工作液1 mL,1 h后舍弃油红O染液进行细胞洗涤,在显微镜下观察染色情况。
细胞内TG含量检测依照试剂盒(北京普利莱基因技术有限公司)说明书要求进行检测。细胞培养结束后弃上清,用磷酸盐缓冲液(PBS)洗涤后加入TG试剂盒中的裂解液0.1 mL处理10 min,收集细胞用于蛋白含量测定。将样品水浴加热70 ℃ 10 min,室温下离心获取上清液;配制TG的工作液(24 h内有效);将标准品倍比稀释为500.0~62.2 μmol/L;将10 μL样品加入96孔板中,用工作液补足至200 μL,用10 μL蒸馏水调零,在37 ℃ 反应15 min测定各孔OD值,依据标准曲线计算样品TG含量。
1.3.3 青蒿素对BMECs内乳脂合成相关基因相对表达量的影响
试验分为对照组(不加青蒿素)和试验组(加入20、40、60 μmol/L的青蒿素培养),加药后每组细胞于6孔板中培养12 h,每组3个重复。BMECs内总RNA按照Trizol法提取,用Nanodrop分光光度计检测RNA的纯度与浓度,OD260/OD280的值在1.8~2.0可用于后续试验分析。以β-actin作为内参基因,采用实时荧光定量PCR仪,检测乳脂合成相关基因的相对表达量。测定基因主要包括AMPK、mTOR、PPARγ、SREBP1-c、ACC、SCD1、FASN、PI3K、AKT1和CyclinD1,其引物序列见表1。试验重复3次,各基因相对表达量用2-△△Ct法计算得出。

表1 基因的引物序列Table 1 Primer sequences of genes
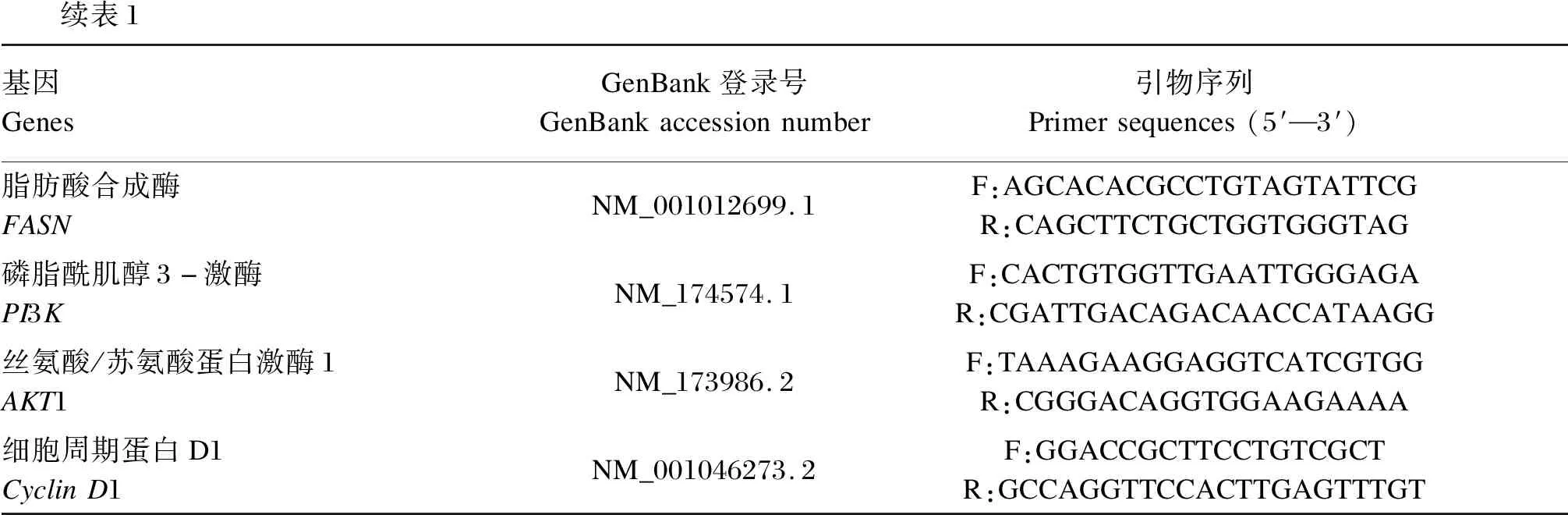
续表1基因GenesGenBank登录号GenBankaccessionnumber引物序列Primersequences(5′—3′)脂肪酸合成酶FASNNM_001012699.1F:AGCACACGCCTGTAGTATTCGR:CAGCTTCTGCTGGTGGGTAG磷脂酰肌醇3-激酶PI3KNM_174574.1F:CACTGTGGTTGAATTGGGAGAR:CGATTGACAGACAACCATAAGG丝氨酸/苏氨酸蛋白激酶1AKT1NM_173986.2F:TAAAGAAGGAGGTCATCGTGGR:CGGGACAGGTGGAAGAAAA细胞周期蛋白D1CyclinD1NM_001046273.2F:GGACCGCTTCCTGTCGCTR:GCCAGGTTCCACTTGAGTTTGT
1.3.4 青蒿素对BMECs内乳脂合成相关蛋白表达的影响
采用Western-blot检测乳脂合成相关蛋白的表达量变化。使用PBS清洗细胞样本,在细胞培养皿中添加细胞裂解液,用细胞刮刀刮取细胞后,将悬液移至新的做好标记的1.5 mL离心管中放在冰上进行充分裂解。4 ℃、12 000 r/min离心10 min后,将样品的上清液移入离心管中。使用BCA试剂盒测定蛋白含量,并调整蛋白含量一致。制备十二烷基硫酸钠-聚丙烯酰胺凝胶电泳凝胶,样品在浓缩胶中为恒压40 V通过浓缩胶后,改为恒压100 V,80 min;采用湿转法进行转膜,并用丽春红染色剂染色,观察转膜情况,同时用考马斯亮蓝染含有目的蛋白的分离胶,观察蛋白残留情况;随后,对膜进行封闭、一抗孵育和二抗孵育,使用BeyoECL Plus荧光检测工作液显色,随后利用Tanon-4600图像分析系统的软件读取条带的净光密度值。所有的目的蛋白的表达量均与β-actin的表达量进行对比。
1.4 数据统计与分析
试验结果用平均值±标准误表示。采用SPSS 21.0统计软件中的one-way ANOVA程序进行单因素方差分析,P<0.05代表差异显著,P<0.01代表差异极显著。
2 结 果
2.1 添加不同浓度青蒿素作用不同时间对BMECs活性的影响
利用MTT法检测不同浓度的青蒿素作用不同时间对BMECs活性的影响,结果如图1所示。不同浓度的青蒿素作用BMECs 1~6 h后,相对细胞活性与对照组相比差异不显著(P>0.05);然而处理9 h后,添加10~80 μmol/L的青蒿素显著提高了相对细胞活性(P<0.05);处理12 h后,添加20、40、60 μmol/L的青蒿素极显著提高了相对细胞活性(P<0.01),80 μmol/L显著提高了相对细胞活性(P<0.05);处理24 h后,20~60 μmol/L极显著提高了相对细胞活性(P<0.01),80 μmol/L显著提高了相对细胞活性(P<0.05)。综上所述,青蒿素对BMECs作用的适宜浓度为0~80 μmol/L,青蒿素作用12 h发生显著变化,且与24 h对细胞相对活性作用效果相同;故选择0~80 μmol/L青蒿素处理细胞12 h进行后续试验。
2.2 添加不同浓度青蒿素对BMECs乳脂合成的影响
采用油红O染色法,观察用不同浓度青蒿素处理BMECs 12 h后细胞内脂滴的含量。结果如图2-A所示,与对照组相比,在添加20、40、60 μmol/L浓度的青蒿素处理12 h后,细胞内脂滴含量增加,而添加80 μmol/L青蒿素后细胞内脂滴的含量明显减少。
如图2-D所示,依据每mg蛋白含量校正TG含量,进一步验证了油红O染色的结果;与对照组相比,添加不同浓度青蒿素处理BMECs 12 h后,40 μmol/L的青蒿素极显著提高了细胞内TG的含量(P<0.01),20、60 μmol/L的青蒿素显著提高了细胞中TG的含量(P<0.05),而80 μmol/L的青蒿素显著降低了细胞内TG的含量(P<0.05)。因此,选择青蒿素浓度为20、40和60 μmol/L进行进一步的分析。
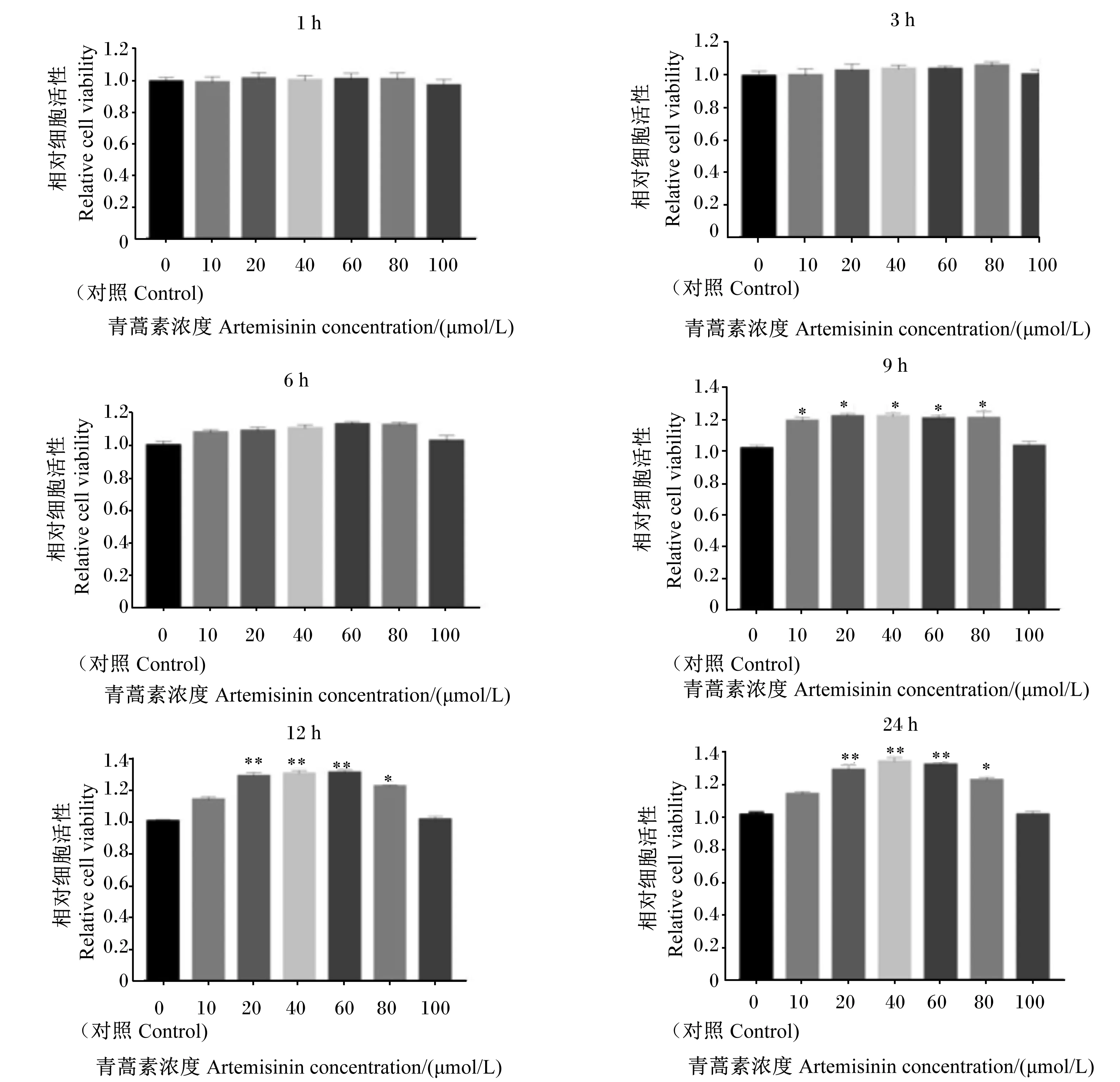
与对照组比较,“*”为差异显著(P<0.05 );“**”为差异极显著(P<0.01)。下图同。Compared with the CON group,“*”mean significant difference (P<0.05);and “**”mean significant difference (P<0.01).The same as below.图1 不同浓度的青蒿素作用不同时间对BMECs细胞活性的影响Fig.1 Effects of different concentrations of artemisinin at different time on cell viability of BMECs
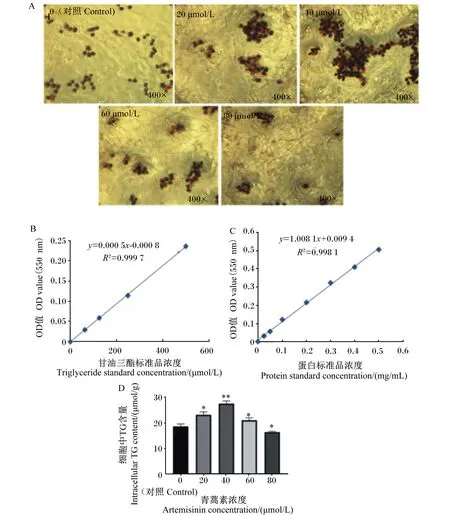
A:油红O染色图,检测细胞内脂滴含量(400×);B:甘油三酯含量标准曲线测定;C:细胞内蛋白含量标准曲线测定;D:细胞中甘油三酯含量测定。A:oil red O staining image to detect the content of lipid droplets in cells (400×);B:standard curve determination of triglyceride content;C:standard curve for determination of protein content in cells;D:determination of triglyceride content in cells.图2 青蒿素对BMECs合成TG的影响Fig.2 Effects of artemisinin on TG synthesis in BMECs
2.3 青蒿素对BMECs内乳脂合成相关基因表达量的影响
如图3所示,不同浓度青蒿素处理BMECs 12 h后,与对照组相比,添加40 μmol/L的青蒿素显著提高PI3K基因相对表达量(P<0.05),而20与60 μmol/L青蒿素的PI3K基因相对表达量无显著性差异(P>0.05)(图3-A);青蒿素添加组AKT1的基因相对表达量显著高于对照组(P<0.05)(图3-B);40 μmol/L的青蒿素组中CyclinD1的基因相对表达量显著高于对照组(P<0.05)(图3-C)。

PI3K:磷脂酰肌醇3-激酶 phosphatidylinositol 3-kinase;AKT1:丝氨酸/苏氨酸蛋白激酶 serine/threonine protein kinase 1;Cyclin D1:细胞周期蛋白D1。图3 青蒿素对BMECs中PI3K、AKT1和Cyclin D1基因相对表达量的影响Fig.3 Effects of artemisinin on relative expression levels of PI3K,AKT1 and Cyclin D1 genes in BMECs
由图4可知,40和60 μmol/L的青蒿素组能量代谢调控因子AMPK的基因相对表达量显著高于对照组(P<0.05);与对照组相比,添加青蒿素可极显著提高mTOR基因相对表达量(P<0.01)。
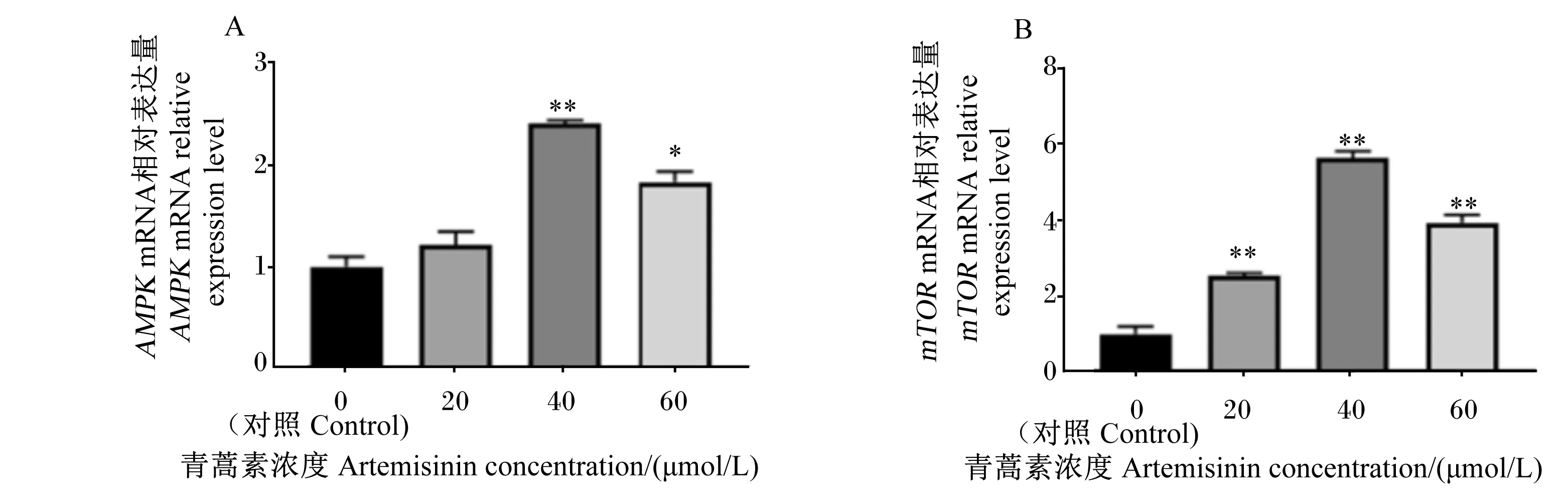
AMPK:磷酸腺苷活化蛋白激酶 AMP-activated protein kinase;mTOR:哺乳动物雷帕霉素靶蛋白 mammalian target of rapamycin。图4 青蒿素对奶牛乳腺上皮细胞AMPK和mTOR基因相对表达量的影响Fig.4 Effects of artemisinin on relative expression levels of AMPK and mTOR genes in BMECs
由图5可知,添加不同浓度的青蒿素组PPARγ基因相对表达量显著高于对照组(P<0.05);添加青蒿素可显著提高SREBP1-c基因相对表达量(P<0.05),40 μmol/L的青蒿素极显著提高SREBP1-c基因相对表达量(P<0.01);此外,与对照组相比,添加青蒿素后,FASN、ACC和SCD1基因相对表达量均显著高于对照组(P<0.05)。
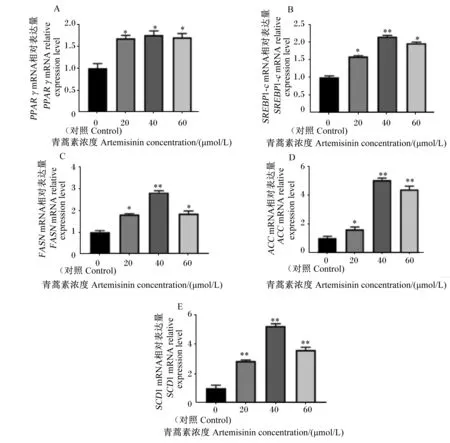
PPAR γ:过氧化物酶体增殖物激活受体γ peroxisome proliferators-activated receptors γ;SREBP1-c:胆固醇调节元件结合蛋白1-c sterol regulatory element-binding proteins 1-c;FASN:脂肪酸合成酶 fatty acid synthase;ACC:乙酰辅酶A羧化酶 acetyl-CoA carboxylase;SCD1:硬脂酰辅酶A去饱和酶1 stearoyl-CoA desaturase 1。图5 青蒿素对BMECs中PPAR γ,SREBP1-c,FASN,ACC和SCD1基因相对表达量的影响Fig.5 Effects of artemisinin on relative expression levels of PPAR γ,SREBP1-c,FASN,ACC and SCD1 genes in BMECs
2.4 青蒿素对BMECs内乳脂合成相关蛋白表达的影响
如图6-A所示,与对照组相比,20与40 μmol/L青蒿素极显著提高PI3K蛋白的表达(P<0.01),而不同浓度的青蒿素均可显著提高p-PI3K的蛋白表达(P<0.05),青蒿素可能激活磷酸化的PI3K从而发挥作用。然而,青蒿素对AKT1与p-AKT1蛋白的表达没有显著影响(P>0.05)(图6-B),青蒿素可能没有激活PI3K-AKT这条信号通路调控乳脂的合成。
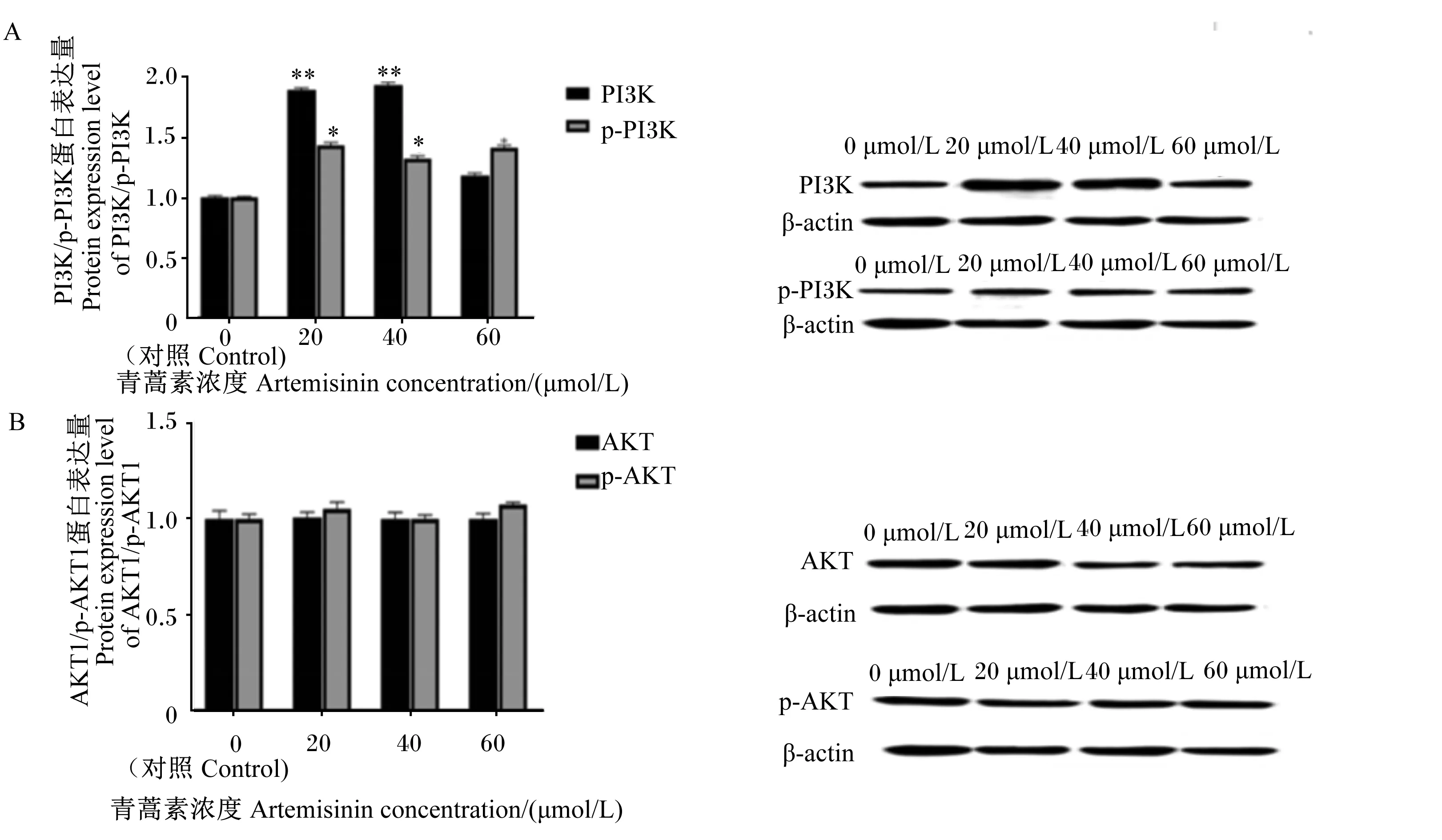
PI3K/p-PI3K:磷脂酰肌醇3-激酶/磷酸化磷脂酰肌醇3-激酶 phosphatidylinositol 3-kinase/p-phosphatidylinositol 3-kinase;AKT1/p-AKT1:丝氨酸/苏氨酸蛋白激酶1/磷酸化丝氨酸/苏氨酸蛋白激酶1 serine/threonine protein kinase 1/p-serine/threonine protein kinase 1;β-actin:β-肌动蛋白。图6 青蒿素对BMECs中PI3K/p-PI3K and AKT1/p-AKT1蛋白表达量的影响Fig.6 Effects of artemisinin on expression levels of PI3K/p-PI3K and AKT1/p-AKT1 proteins in BMECs
如图7所示,与对照组相比,添加20和40 μmol/L青蒿素均可显著提高AMPK蛋白的表达量(P<0.05),而60 μmol/L青蒿素对AMPK蛋白的表达量没有显著影响(P>0.05)。如图8所示,40 μmol/L青蒿素组中mTOR蛋白的表达量极显著高于对照组(P<0.01),20 μmol/L青蒿素显著提高了mTOR蛋白的表达量(P<0.05),然而60 μmol/L青蒿素对其蛋白的表达量没有显著影响(P>0.05);但是添加青蒿素极显著提高了p-mTOR蛋白的表达量(P<0.01)。如图9所示,与对照组相比,添加20、40 μmol/L青蒿素显著提高了乳脂合成关键蛋白PPARγ与SREBP1-c的表达量(P<0.05),其中60 μmol/L青蒿素只显著提高了PPARγ蛋白的表达量(P<0.05);然而,添加青蒿素后,Cyclin D1蛋白表达量并没有显著变化(P>0.05)。
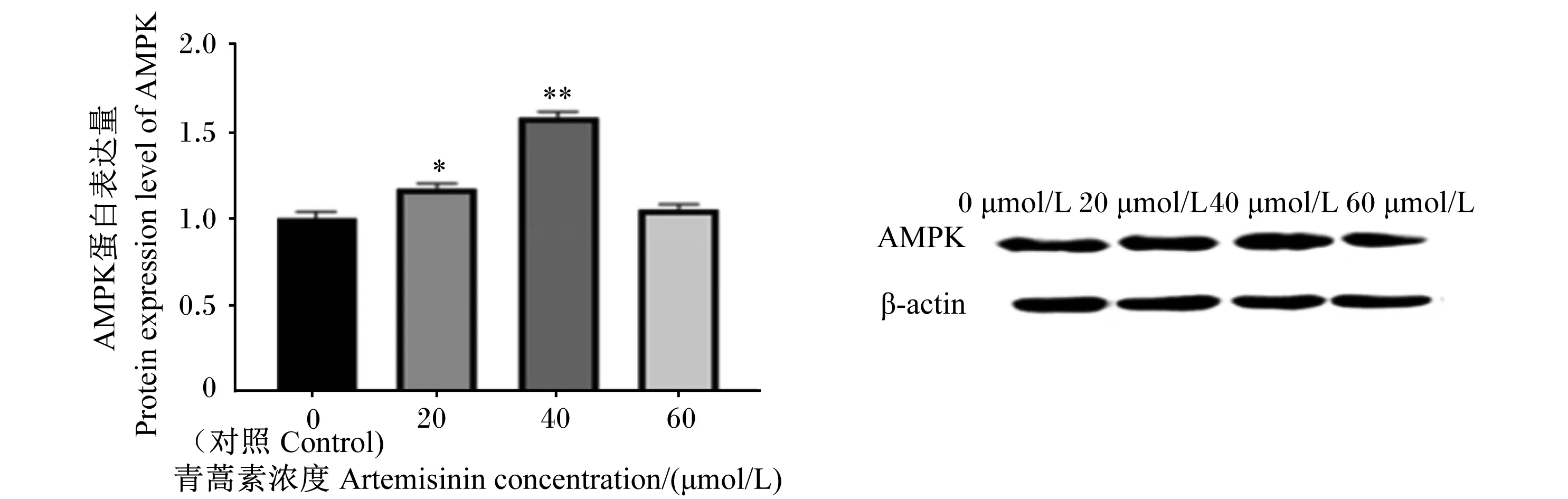
AMPK:磷酸腺苷活化蛋白激酶 AMP-activated protein kinase;β-actin:β-肌动蛋白。图7 青蒿素对BMECs中AMPK蛋白表达量的影响Fig.7 Effects of artemisinin on expression levels of AMPK proteins in BMECs
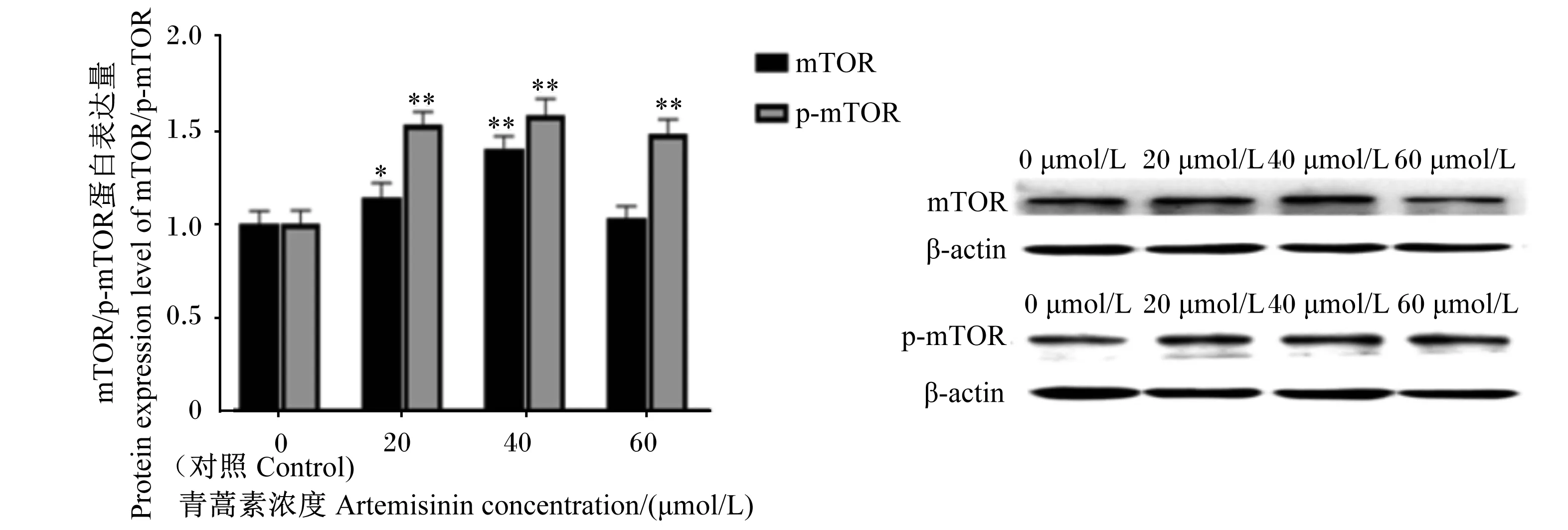
mTOR:哺乳动物雷帕霉素靶蛋白 mammalian target of rapamycin;p-mTOR:磷酸化哺乳动物雷帕霉素靶蛋白 phosphorylated mammalian target of rapamycin;β-actin:β-肌动蛋白。图8 青蒿素对BMECs中mTOR/p-mTOR蛋白表达量的影响Fig.8 Effects of artemisinin on expression levels of mTOR/p-mTOR proteins in BMECs
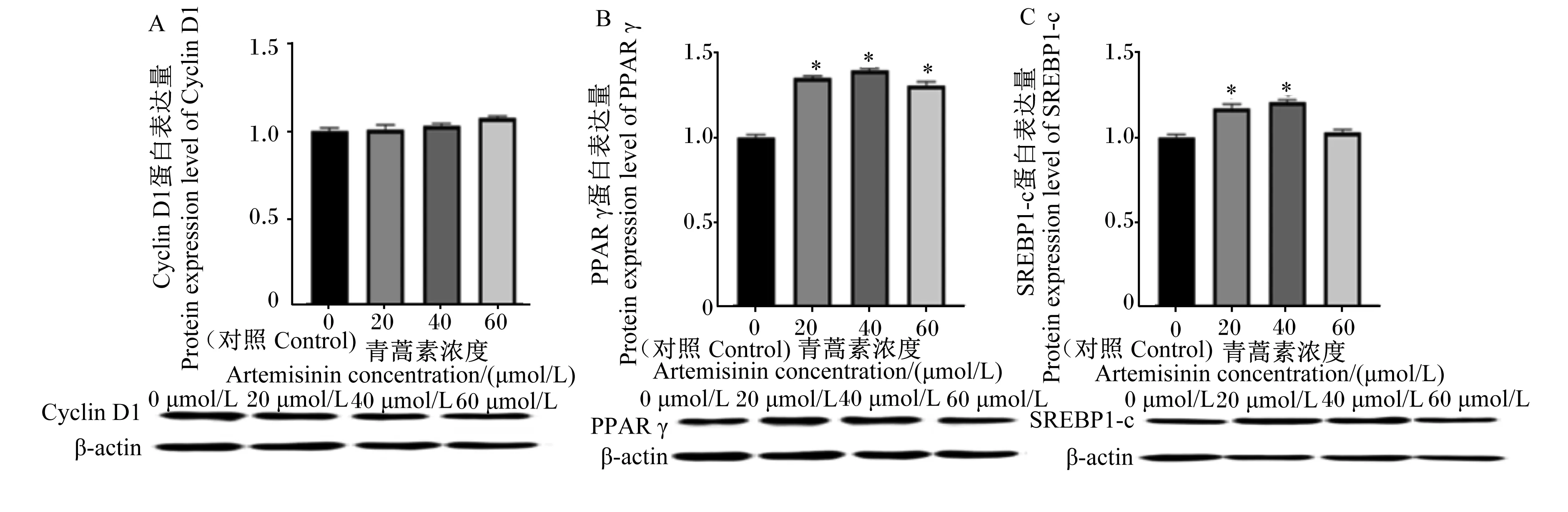
PPAR γ:过氧化物酶体增殖物激活受体γ peroxisome proliferators-activated receptors γ;SREBP1-c:胆固醇调节元件结合蛋白1-c sterol regulatory element-binding proteins 1-c;Cyclin D1:细胞周期蛋白D1;β-actin:β-肌动蛋白。图9 青蒿素对BMECs中Cyclin D1,PPARγ和SREBP1-c蛋白表达量的影响Fig.9 Effects of artemisinin on expression levels of Cyclin D1,PPARγ and SREBP1-c proteins in BMECs
3 讨 论
3.1 添加青蒿素对BMECs增殖与乳脂合成的影响
奶牛的泌乳功能与乳腺上皮细胞的数目以及每个细胞分泌与合成乳汁的能力密切相关[16]。Yang等[17]研究发现,青蒿素及其衍生物可以作用于小鼠T淋巴细胞丝裂原ConA,使其脾脏淋巴细胞增殖,增加机体的免疫能力。与本研究结果一致,不同浓度的青蒿素对BMECs的增殖及活性均具有显著的影响,由此证明青蒿素促进乳腺的泌乳功能。乳汁中TG的含量在一定程度上决定了奶牛的乳脂率[18-19]。据报道,细胞利用3-磷酸甘油氧化产生的过氧化氢,在相应酶的作用下氧化为有色的产物,进而通过颜色吸光度反映出的TG含量,更直观地表达了细胞内TG含量的变化情况。本研究中油红O染色结果,从形态学上解释了20~60 μmol/L青蒿素对BMECs中脂滴的合成具有显著的促进作用。因此,青蒿素对BMECs具有促增殖、提高乳脂合成的影响,但其具体的调控乳脂合成的机理有待进一步的研究。
3.2 青蒿素对BMECs内乳脂合成相关基因表达量的影响
PI3K-AKT-mTOR-Cyclin D1信号通路主要调节BMECs增殖与生长[20-21],此外不仅调控乳蛋白合成相关基因的表达,同时促进SREBP1-c等关键信号传感器的活化,从而促进脂肪合成转录因子的表达,提高乳脂合成信号通路的转导[22]。据报道,PPARγ和SREBP1-c是mTOR信号通路中调节脂肪合成的主要调节剂[23]。当mTOR的激活被抑制时,其下游SREBP1-c表达被抑制,显著影响脂肪酸合成酶的活性并降低脂肪酸的从头合成[24]。而且,研究证实SREBP1-c是控制牛乳脂合成转录网络的中心枢纽,乳脂抑制的部分原因是反式-10,顺式-12共轭亚油酸可通过抑制SREBP1-c的活性和表达来减少乳脂合成相关基因的表达,从而抑制了乳脂合成[25]。此外,PPARγ属于配体激活的转录因子,它能促进前体脂肪细胞的分化,促进脂肪组织中脂蛋白脂肪酶基因的表达并降低脂肪分解速度;在乳成分合成过程中,PPARγ能增加乳腺上皮细胞内TG的含量,在合成乳脂过程中起关键作用[1]。本研究结果发现,添加青蒿素可显著提高BMECs中乳脂转录因子SRBEP1-c和PPARγ的表达,说明青蒿素的添加能增加脂肪酸的从头合成,进而促进乳脂的合成。
PPARγ可作为脂肪细胞成熟标志基因,其含量显著影响脂肪细胞的产生[26];当其表达被抑制时,显著降低ACC与FASN的基因表达水平,并降低脂肪酸与其互作,减少乳脂的生成[4,27]。ACC和FASN是乳脂从头合成中2个重要的基因。据报道,FASN和ACC主要在BMECs内作用于乳脂合成的前体物乙酸和β-羟丁酸,FASN会调控37%的脂肪酸从头合成[28],乳中约1/2的C16∶0和几乎全部的C4∶0~C14∶0依赖于乳腺的从头合成,且FASN会参与其碳链延长的整个过程[29]。在脂肪酸合成过程中,ACC参与脂肪酸从头合成的限速,调控奶牛乳脂的合成速度,其还与合成脂肪酸的转录因子SREBP1-c在PPARγ的作用下,影响长链脂肪酸的代谢,最终影响乳脂的合成[30-31]。Bionaz等[32]研究发现,奶牛泌乳与乳脂合成时,ACC、PPARγ、FAS、SCD和SREBP1-c等基因表达都明显上调。本研究结果表明,添加适宜浓度的青蒿素显著上调了SREBP1-c与PPARγ蛋白的表达,而且PPARγ可能参与调控SREBP1-c基因的表达,通过影响脂肪酸的摄取、转运、从头合成和酯化过程从而调控基因的表达。
AMPK作为细胞内一种重要的能量调节因子,可通过感受细胞能量状态的方式来维持能量平衡,从而为乳蛋白合成提供充足的能量。本研究发现,青蒿素对参与调控机体乳脂代谢的AMPK-mTOR信号通路中关键基因FASN、ACC、PPARγ和SCD等均有显著的促进作用,这可能与青蒿素以调节机体能量代谢的方式上调AMPK,进一步激活mTOR的磷酸化有关。据报道,SCD参与催化不饱和脂肪酸的形成,并在一定程度上参与调控其他脂肪酸代谢基因的表达来调节TG的合成[33]。研究发现,乳脂合成主要以mTOR为主,当其被激活,可以促进脂肪合成,同时抑制脂肪分解及氧化,使得TG含量上升,最终提高乳脂含量[34]。据报道,泌乳小鼠注射mTOR抑制剂3 h后,乳汁中FASN与ACC 2种酶的活性及含量显著降低,当这2种酶活性下降时抑制了细胞中乳脂的合成[35]。由此可见,青蒿素可通过调控AMPK-mTOR信号通路中乳脂肪合成关键基因的转录来提高BMECs中乳脂的合成。
4 结 论
青蒿素可通过AMPK-mTOR信号通路调节乳脂合成关键调控因子FASN、ACC、PPARγ和SREBP1-c基因和蛋白的表达。当青蒿素浓度为20~60 μmol/L时,对BMECs内脂肪酸从头合成及长链脂肪酸摄取的促进效果较好。
——青蒿素

