抗肿瘤靶向药物相关皮肤不良反应临床表现及治疗最新进展
王 晨,张守民
随着癌症检测的进步和抗癌药物的发展,与靶向治疗相关的皮肤不良反应(adverse cutaneous reactions,ACR)发生率不断增加。据报道,可出现ACR的靶向药物种类有表皮生长因子受体抑制剂(epidermal growth factor receptor inhibitor,EGFRI)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抑制剂、血管内皮生长因子(vascular endothelial growth factor,VEGF) 抑 制剂、原癌基因(rat sarcoma,RAS)/丝氨酸/苏氨酸蛋白激酶(v-raf murine sarcoma viral oncogene homolog B,BRAF)/(rapidly accelerated fibrosarcoma, RAF)/有丝分裂原激活蛋白激酶(mitogen-activated protein kinase,MEK)/细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)抑制剂、免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)等,其中以 EGFRI及ICIs应用最为广泛。
1 EGFRI
EGFRI包括小分子酪氨酸激酶抑制剂和大分子单克隆抗体。酪氨酸激酶抑制剂与EGFR的酪氨酸激酶部分结合,导致细胞生长和肿瘤细胞分化减少,如厄洛替尼、吉非替尼、伊马替尼等。大分子单克隆抗体与EGFR配体竞争,导致跨膜EGFR下调,如西妥昔单抗、帕尼单抗等。
有报道62%~91%使用EGFRI的患者存在ACR,而其中60%~80%可表现为皮脂溢出部位的丘疹脓疱样疹,常出现在治疗后1~2周,呈剂量依赖性,但不同于寻常痤疮,无粉刺、结节或囊肿,且常伴有瘙痒,下肢亦可受累[1]。10%~20%的患者在治疗后数周至数月会持续出现甲沟炎,拇指(趾)最常受累,表现为甲皱襞与甲小皮肿胀皲裂,甲周化脓性肉芽肿[2]。30%的患者在开始治疗后1~3个月出现皮肤干燥、瘙痒,引起四肢末端皮肤裂隙和疼痛[3]。轻中度口唇炎、口腔溃疡等黏膜病变发生于2%~36%的患者[4]。毛发改变常在治疗后数月出现,停药1个月内可缓解,表现为头发卷曲、脱色、冗细、易断、生长缓慢甚至脱发,睫毛弯曲生长,出现倒睫和角膜溃疡[5]。其他还可出现毛细血管扩张、手足皮肤反应、色素沉着等[6]。另一项回顾性研究对99例使用EGFRI的亚洲患者进行评估,发现ACR最常见为干燥(52.5%),其次为痤疮样疹(27.3%)、斑丘疹(11.1%)、黏膜炎(6.7%)、甲沟炎(5.1%)[7]。一项针对6 798例患者预后的Meta分析发现,ACR与较长的无进展生存期和总生存期相关,且皮损严重程度与治疗反应呈正相关[8]。这一结论被众多学者认可。Hichert等[9]研究发现肝细胞生长因子(hepatocyte growth factor,HGF)的血浆浓度与EGFRI诱导的ACR严重程度和患者总生存期呈显著的负相关,有助于将HGF作为预测预后的一种生物标志物。
2 mTOR抑制剂
磷脂酰肌醇-3-激酶(phosphatidylin ositol 3-kinase,PI3K)/蛋 白 激 酶 B(protein kinase B,PKB,又称AKT)/mTOR信号转导通路(简称PAM通路)[10]的某些成分突变可导致肿瘤细胞的增殖和存活[11]。mTOR抑制剂通过抑制EGFR下游的PI3K/Akt/mTOR通路,抑制蛋白质合成、血管新生及细胞周期进程而起到抗肿瘤作用。
mTOR抑制剂包括雷帕霉素及其衍生物,如西罗莫司、依维莫司、坦西罗莫司等。其相关ACR通常表现为斑疹/丘疹/丘疹脓疱样疹、水肿、甲病变(甲剥离、远端甲裂)[12]等,脱发、面部多毛、伤口愈合不良、瘙痒、血管炎等亦有报道[13]。黏膜炎在接受mTOR抑制剂治疗患者中发病率最高,被称为mTOR抑制剂相关性口炎,且为剂量依赖性。这些单个或多个边界清楚、圆形、浅表、疼痛的溃疡仅局限于未角化的黏膜,偶有红晕围绕,考虑可能与中性粒细胞减少、免疫抑制、mTOR抑制剂诱导的血管生成受损及其代谢作用导致的伤口愈合损伤有关[14]。
3 VEGF抑制剂
VEGF抑制剂以抑制肿瘤血管内皮再生而达到阻止肿瘤生长和转移的目的,可分为3类:VEGF配体抑制剂(贝伐珠单抗)、VEGF受体抑制剂(雷莫芦单抗)、小分子酪氨酸激酶抑制剂(索拉非尼、舒尼替尼)。
其引起的ACR包括毛发改变、皲裂、干燥、鱼鳞病、斑丘疹、口腔炎、生殖器糜烂、出血、伤口延迟愈合以及皮肤血栓形成性血管病和溃疡性萎缩纹等[5],而最常见表现是手足皮肤反应(hand foot skin reaction,HFSR)[15],是一种剂量依赖性反应,常在治疗后2~4周出现手足掌跖疼痛性红斑,在受压部位出现压痛性角化性斑块,可有大疱伴剧烈疼痛,严重导致跛行,尤其在使用索拉非尼的患者中较多。其原因可能是压力/摩擦部位的血管内皮细胞和成纤维细胞的修复机制受到干扰[14],血管损伤损害了皮肤恢复能力。脱发发生于治疗后2~28周,索拉非尼所致的脱发区新长出的毛发变脆、卷曲而色素加深。而舒尼替尼可致10%的患者出现毛发色素脱失,停药2~3周可恢复[16]。28%应用舒尼替尼治疗1~4周的患者出现皮肤变黄,通常发生于颜面,但不累及巩膜和口腔黏膜,停药后可自行消退[17]。
4 RAS/RAF/MEK/ERK激酶抑制剂
RAS/RAF/MEK/ERK通路也称为丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)通路,位于EGFR信号通路的下游,可调节细胞的生长、增殖和分化。丝裂原活化蛋白激酶抑制剂(mitogenactivated protein kinase inhibitors,MEKI)已被用于治疗该类突变患者,ACR表现与EGFRI相同,为痤疮样疹、干燥、甲沟炎及毛发营养不良等[2]。
维莫非尼、达拉非尼为针对BRAFV600E(BRAF基因第600个密码子突变,导致谷氨酸取代缬氨酸)突变的靶向药物[18],其最常见的ACR为表皮增殖性肿瘤,通常在治疗6~12周出现。其发生率分别为疣状角化(72.2%,66.4%)、足跖角化过度(38.9%,39.5%)、日光性角化(30.6%,26.9%)、皮肤鳞状细胞癌(36.1%,26.1%)[19]。同时一项对134例BRAF突变转移性黑素瘤患者进行研究也发现,在开始治疗后约1/4(32/134,24%)的患者出现皮肤鳞状细胞癌[20]。发疹性皮损亦常出现,呈剂量依赖性,发生于治疗后数个月,停药或减量后可消退。表现为颜面、躯干和手臂的丘疹、脓疱,也可融合成麻疹样或中毒性红斑样皮损[5]。其他包括脱发、掌跖角化过度、结节性红斑[2]、瘙痒、裂隙、毛细血管扩张、色素沉着、斑秃、口角炎和甲沟炎,也有继发金黄色葡萄球菌感染的报道[15]。
5 ICIs
ICIs通过阻断细胞毒性T淋巴细胞相关抗原 -4(cytotoxic T lymphocyte-associated antigen -4,CTLA-4)/程序性死亡-1受体(programmed death-1 receptor,PD-1)或程序性死亡-配体1(programmed death - ligand 1,PD-L1)导致CD4+/CD8+T淋巴细胞活化,起到抗肿瘤的作用。被用于治疗进展期、有转移或无法手术切除的肿瘤[21]。目前临床应用的PD-1单抗包括卡瑞利珠单抗、纳武利尤单抗和派姆单抗,PD-L1单抗包括阿特珠单抗、阿维鲁单抗等。
约40%的患者在最初用药的4~8周出现ACR,并可持续较长时间,且ACR的风险与剂量直接相关[22]。可表现为斑丘疹、干燥、瘙痒、湿疹样、银屑病样、苔藓样皮炎、脱发、Sweet综合征以及中毒性表皮坏死松解症等。但斑丘疹是PD-1治疗最常见的皮损,患者通常在第1次治疗时出现,病变主要位于躯干和四肢,不累及面部[23],主要由红斑或丘疹组成,伴有瘙痒或灼痛感。<1%的患者存在大疱性类天疱疮(bullous pemphigoid,BP)180/230抗体阳性以及银屑病等自身免疫性皮肤病。不同于其他ACR,PD-1抑制剂诱发的BP潜伏期更长,通常在开始治疗5~8个月后出现,部分可>20个月[24],且在停用PD-1抑制剂后,皮损不会自行消退,甚至在停药数月后也可发生[25],但很少有危及生命的情况[26]。目前,有报道使用纳武利尤单抗[27]和派姆单抗[28]发生严重银屑病的散发报道,表现为新发斑块状银屑病或原银屑病加重,可同时出现点滴型银屑病、掌跖脓疱性银屑病等。白癜风多数发生在使用ICIs治疗数月的黑素瘤患者中,总发生率为8%~25%[28],似乎与剂量无关,且治疗停止后皮损仍会持续。有学者提出,白癜风可能是黑素瘤患者治疗疗效较好的预测因子,且有个案报道,白癜风的再色素化与黑素瘤复发相关[29]。有研究报道[30],反应性毛细血管增生是卡瑞利珠单抗较特异的ACR,其他PD-1抑制剂未见报道,且其出现时间呈剂量依赖性,剂量越大,出现时间越短[31]。但该ACR具有自限性,在治疗期间和治疗后可自发消退,仅在停药后才能完全消退[32]。
抗肿瘤靶向药物引起的ACR多数较轻,严重不良反应如史蒂文斯-约翰逊综合征(Stevens-Johnson syndrome,SJS)/中毒性表皮坏死松解症(toxic epidermal necrolysis,TEN)较为罕见。目前报道可引起SJS/TEN的药物有EGFRI,如阿法替尼、吉非替尼、西妥昔单抗和帕尼单抗;MEKI,如维莫非尼;小分子酪氨酸激酶抑制剂,如伊马替尼、瑞戈非尼、索拉非尼[21]。
6 皮肤不良反应的预防和治疗
国家癌症研究所根据通用不良事件术语标准(Common Terminology Criteria for Adverse Evevts,CTCAE)对丘疹脓疱样疹的分级和治疗做出指导[2](表1);对干燥的分级和治疗做出指导[2](表2);对免疫检查点抑制剂ACR的分级和治疗做出指导[2](表3)。
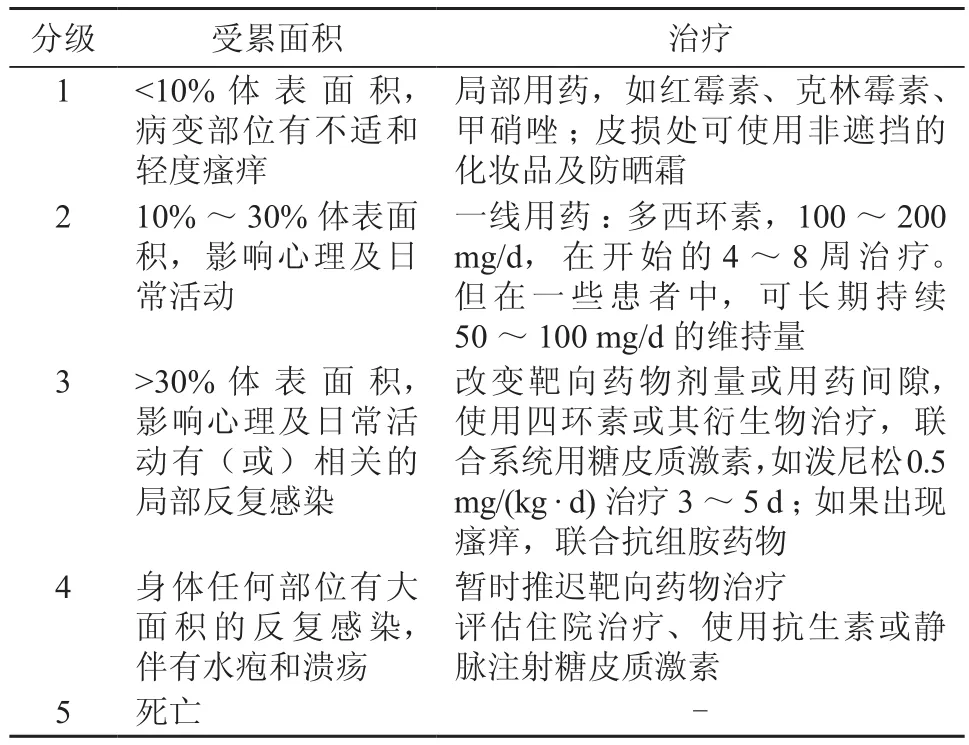
表1 丘疹脓疱样疹分级及治疗

表2 干燥分级及治疗
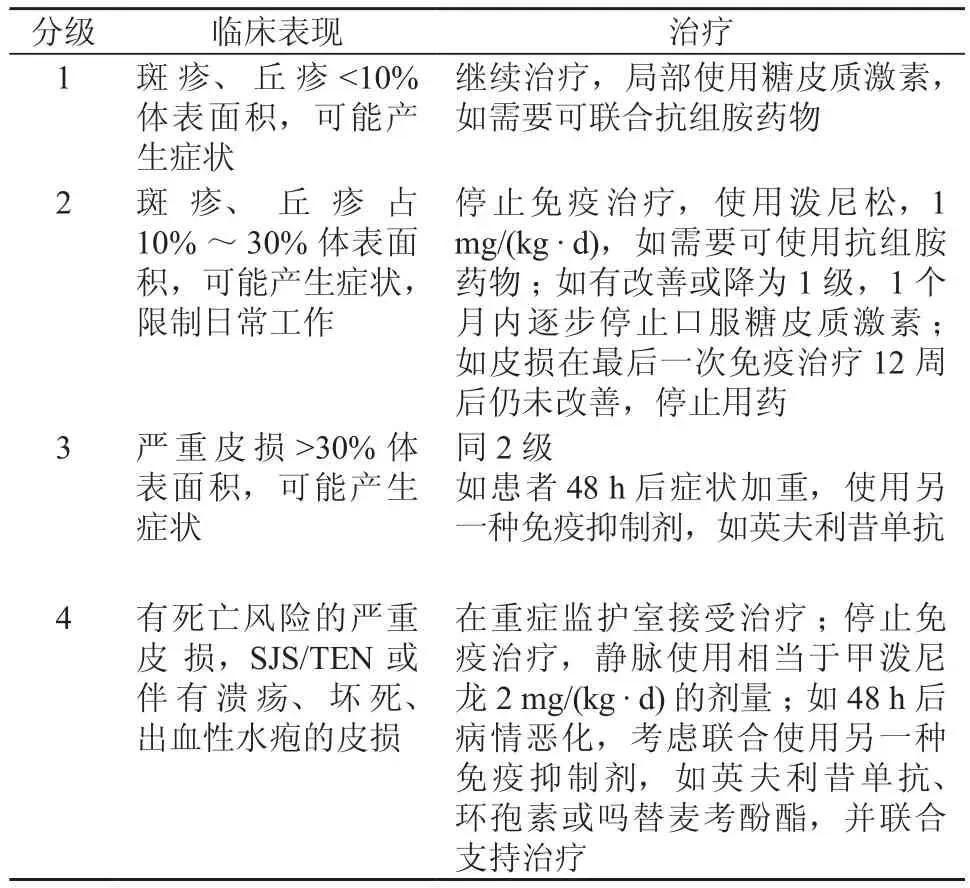
表3 免疫检查点抑制剂皮肤不良反应的分级和治疗
甲沟炎预防和治疗:避免指甲摩擦、压迫和外伤,使用防护手套,避免长时间接触水,勤修剪指甲,局部涂抹润肤剂,穿舒适合脚的棉质鞋袜[26]。可口服克林霉素600 mg/d或头孢呋辛500 mg/d,外用抗生素软膏每日2~3次或高锰酸钾溶液湿敷每日2~3次,治疗2周[33]。
手足综合征预防和治疗:治疗前建议去除鸡眼、胼胝等角化性皮损,穿着宽松鞋子,避免剧烈运动,减少摩擦,大量使用无乙醇润肤霜如尿素乳膏或凡士林,避免热水刺激[34]。根据症状局部外用2%~5%利多卡因乳膏、糖皮质激素软膏,口服非甾体类抗炎药或加巴喷丁及普瑞巴林等。若疼痛无法控制或干扰日常生活,需调整药物剂量或暂停使用[35]。
表皮增殖性肿瘤:患者治疗前及治疗后每4周进行1次全身皮肤检查。较小的增殖性病变可使用液氮冷冻、电干燥法、刮除术及激光烧灼来治疗;病变较多的患者可采用局部疗法,如外用水杨酸、维A酸、氟尿嘧啶、咪喹莫特及光动力治疗。如有症状可对较大的病灶进行组织病理检查[35]。
靶向药物所致1~3级ACR与轻中度药疹治疗方案基本相同,不同点在于前者皮损控制好转后,可通过减少靶向药物剂量或延长治疗间歇再次用药,而后者则避免再度使用。4级ACR与重症药疹在治疗上均需永久停药,并给予相当于甲泼尼龙1~4 mg/(kg·d)的治疗量[36]。不同之处在于,前者潜伏期更长,需询问2~3个月内的用药史[37]。治疗中若48 h病情恶化,可联合使用另一种免疫抑制剂,如英夫利昔单抗、环孢素或吗替麦考酚酯[2]。但目前无足够证据表明生物制剂或免疫抑制剂可改善重症药疹的预后,提高治愈率[38]。
认识靶向药物相关ACR的临床表现,预防不良反应的发生,同时根据临床分级选择恰当的药物及时治疗,对提高肿瘤患者生活质量至关重要。

