白细胞介素6体外对SZ95人皮脂腺细胞脂质合成的影响
胡婷婷,侯品品,魏子妤,叶 枫,莫小辉,Christos C. Zouboulis,鞠 强
寻常痤疮是常见的毛囊皮脂腺单位慢性炎症性疾病,炎症贯穿其发生始终,是寻常痤疮发病的启动环节[1]。皮脂腺脂质分泌增多是寻常痤疮发生的前提条件[2]。近来发现,皮脂腺细胞能够分泌白细胞介素(IL)-6等脂肪因子(adipokine),成为脂质代谢和炎症反应研究有趣的细胞模型[3]。IL-6是寻常痤疮病程中重要的炎性因子,但在皮脂腺细胞中的作用不明。IL-6通过与其特异性受体结合,实现其生物学功能[4];其受体存在IL-6膜受体(IL-6R)及可溶性受体(sIL-6R)两种模式。IL-6R介导的信号通路是经典信号通路,而sIL-6R介导的为反式信号通路(trans-signaling);在表达IL-6R的靶细胞上,IL-6首先与IL-6R结合[5]。笔者以体外培养的永生化SZ95人皮脂腺细胞作为细胞模型,检测IL-6R的表达及IL-6对皮脂腺细胞脂质合成的影响,力图阐明IL-6在寻常痤疮发生发展中的作用,为疾病的诊疗提供理论依据。
1 材料与方法
1.1 试剂及仪器
永生化SZ95人皮脂腺细胞由德国Zouboulis CC教授馈赠,Sebomed培养基(Biochrom公司),CCK8试剂盒(武汉博士德公司),酶联免疫吸附试验(ELISA)试剂盒(R&D公司),重组人IL-6(Pepro Tech公司;PBS 溶解至 100 μg/ml),兔抗人IL-6R一抗(Abcam公司)、鼠抗人SREBP1一抗(Santa Cruz公司)、余一抗均购于Cell Signaling Technology公司。引物序列由上海生工生物技术有限公司代合成。
1.2 方法
1.2.1 细胞培养 SZ95人皮脂腺细胞培养于Sebomed培养基,添加10%胎牛血清、5 μg/L表皮生长因子、100 U/ml青霉素、100 μg/ml链霉素和 1 mmol/L CaCl2。37℃含5% CO2的孵箱孵育,隔日换液。工作时新鲜配制含或不含各种浓度的IL-6的工作培养基。
1.2.2 ELISA法 24孔板接种细胞(每孔1×105个、6.5×104个、3×104个),复3孔,次日换液,分别继续培养24 h、48 h及96 h后收集上清。于收集上清前24 h更换培养基,上清液4℃ 3 000 r/min离心5 min,-20℃存放待检测;Trizol和RIPA提取试剂提取相应细胞总RNA及蛋白,-80℃冻存待检测。按照IL-6 ELISA试剂盒说明书步骤进行检测,设定空白对照孔,450 nm酶标仪检测吸光度(A),根据标准曲线计算样本浓度进行比较。
1.2.3 CCK8细胞毒性及增殖实验 96孔板接种细胞(每孔8 000个),24 h和48 h后添加不同浓度的IL-6,对照组设PBS对照及调零组,继续孵育24 h后,弃上清后PBS清洗2遍,根据CCK8试剂盒操作说明进行染色,酶标仪在450 nm检测A值,观察细胞毒性及增殖效应。
1.2.4 尼罗河红脂质染色法 黑色底透96孔板接种细胞(每孔104个),次日换液,80%~90%密度时添加不同浓度的IL-6及抑制剂,48 h后弃上清,PBS清洗2遍后进行尼罗河红染色,多功能酶标仪定量检测[6]。
1.2.5 实时荧光PCR(RT-PCR)法检测 24孔板接种细胞(每孔105个),80%~90%密度时刺激,24 hTrizol提取试剂提取总RNA,M-MLV逆转录酶获得cDNA,检测基因及引物序列见表1,设置GAPDH为对照。上机检测后目的基因mRNA相对表达量采用ΔΔCT进行计算[6]。

表1 RT-PCR检测基因及引物序列
1.2.6 蛋白印迹法 6孔板接种细胞(每孔106个),80%~90%密度时刺激48 h,RIPA裂解液提取总蛋白,BCA试剂盒测定蛋白浓度,调整蛋白浓度,聚丙烯酰胺凝胶电泳分离蛋白质,将分离后的蛋白质转至 PVDF 膜上,4℃封闭过夜,加入一抗,4℃过夜,二抗室温孵育1 h,化学发光系统 ECL试剂盒显影定影。
1.3 统计学方法
2 结果
2.1 IL-6及IL-6R在SZ95细胞中的表达
SZ95细胞表达IL-6及IL-6R,在细胞分裂进程中逐渐上调。皮脂腺细胞体外以细胞分裂的方式增殖,根据培养时间长短来初步判定细胞分裂进程,培养时间越长细胞分裂次数越多。IL-6R在蛋白及mRNA水平表达,4 d的mRNA水平是1 d的1.362倍,差异有统计学意义(t=-5.381,P<0.05),蛋白水平变化不明显(P>0.05);IL-6蛋白及mRNA水平随细胞分裂进程逐渐增多,4 d的表达量分别是1 d的2.122倍和3.013倍,差异均有统计学意义(t=-11.149、-7.996,均P<0.05)(图1)。
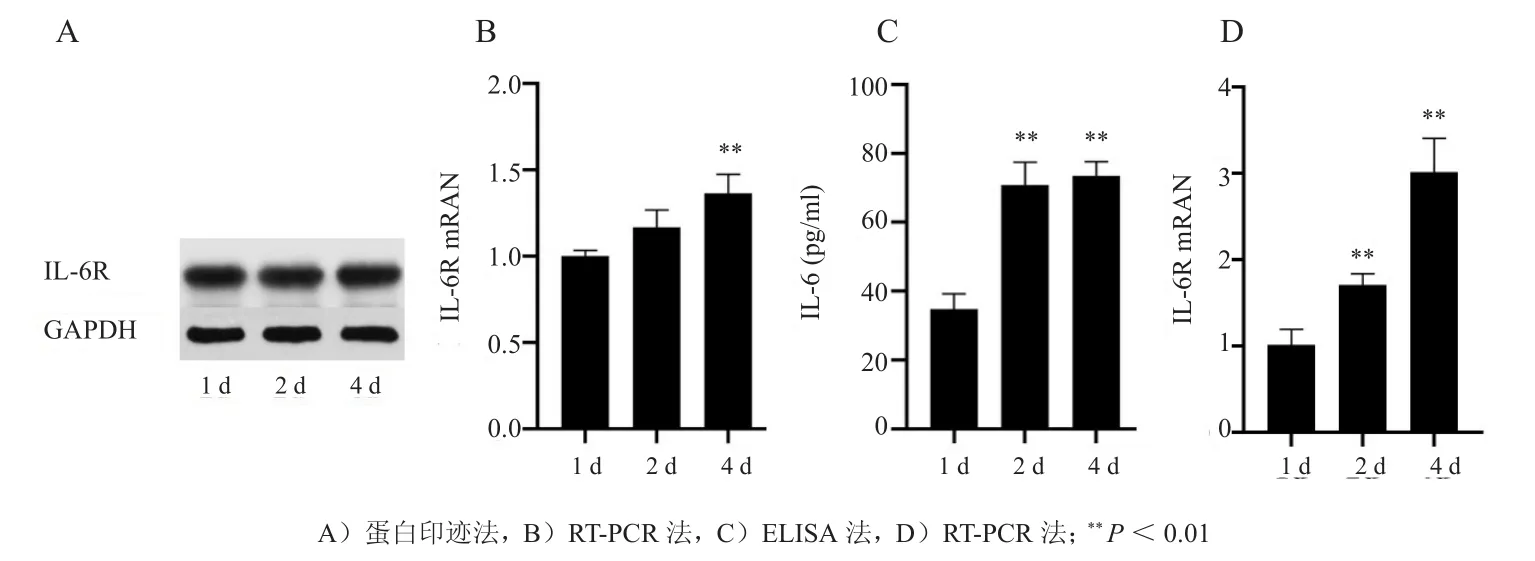
图1 IL-6及IL-6R在SZ95细胞中的表达
2.2 IL-6对SZ95细胞增殖的影响
IL-6促进SZ95细胞增殖。100 ng/ml IL-6培养后有晶体析出,选取较低浓度进行统计分析。CCK8法示10 ng/ml IL-6作用24 h和48 h后,细胞活力百分率分别为120%和126%,与对照组相比差异均有统计学意义(t=-8.402、-6.245,均P<0.05)(图 2)。

图2 IL-6对SZ95细胞增殖的影响
2.3 IL-6对SZ95细胞中性脂质合成的影响
IL-6刺激SZ95细胞中性脂质合成。尼罗河红染色法示10 ng/ml和1 ng/ml IL-6作用48 h后中性脂质百分率分别为125%和116%,与对照组相比差异均有统计学意义(t=-4.014、-2.897,P<0.05)(图3)。
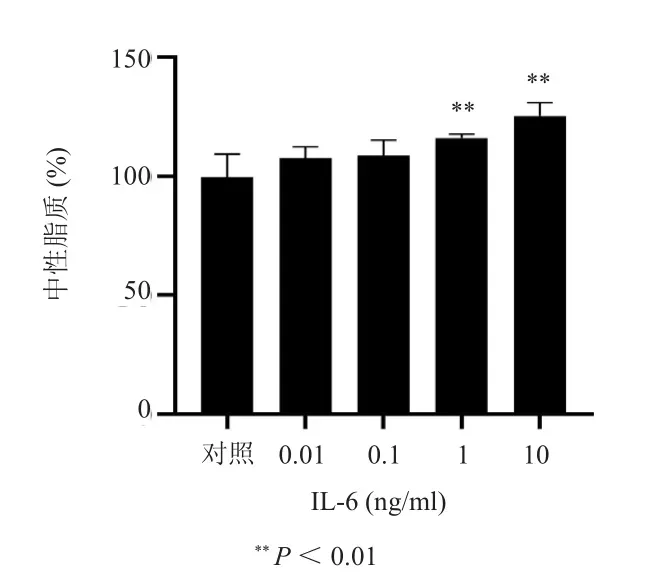
图3 IL-6对SZ95细胞中性脂质合成的影响
2.4 IL-6对SZ95细胞脂质合成相关基因表达的影响
IL-6上调SZ95细胞脂质合成相关基因表达。RT-PCR法示脂质相关基因PPARG、SREBP1、FASmRNA水平随IL-6浓度依赖性上调(F=26.475、139.560、26.206,P<0.05),均显著高于对照组(t=-6.790、-22.012、-9.629,P<0.05)。蛋白印迹法示10 ng/ml IL-6作用48 h后上调PPARG、FAS及SREBP1蛋白水平,灰度值结果与对照组比较,差异均有统计学意义(t=-14.147、-7.962、-4.605,P< 0.05)(图4,表2)。
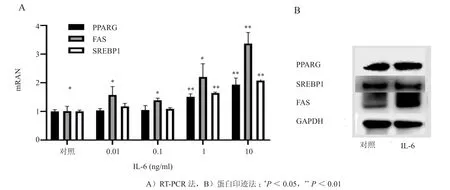
图4 IL-6对SZ95细胞脂质合成相关基因表达的影响

表2 IL-6对SZ95细胞脂质合成相关基因蛋白表达的影响
3 讨论
IL-6作为最易诱导的细胞因子之一,可由多种细胞分泌;生理状态下呈低表达,在受到细菌、病毒、IL-1α及肿瘤坏死因子(TNF)-α等因子刺激后显著分泌[7]。本研究发现,体外培养的SZ95细胞表达IL-6及IL-6R,在细胞分裂进程中逐渐上调,符合IL-6的表达及分泌特性,提示IL-6能够直接作用于SZ95细胞。近来发现,IL-6参与调节角质形成细胞、成纤维细胞增殖与分化,介导皮肤免疫防御、肿瘤形成、炎症反应及自身免疫性疾病的发生[8,9]。本研究发现,体外IL-6能够刺激SZ95细胞脂质合成,提示IL-6还可能通过调节皮脂腺细胞的生物学功能参与寻常痤疮等相关疾病的发生。
脂质合成是皮脂腺细胞分化的终末指标,瘦素、胰岛素样生长因子-1(IGF-1)、胰岛素和TNF-α等细胞因子参与调节其脂质合成,成为寻常痤疮发生的重要致病因子[10-12]。本研究发现,IL-6促进SZ95细胞中性脂质合成,上调脂质合成相关基因PPARG、FAS及SREBP1的表达,提示IL-6能够促进皮脂腺细胞的脂质合成;与胰岛素、IGF-1及TNF-α促皮脂腺细胞脂质合成效应一致[10,12]。然而,目前肝脏及脂肪细胞中,IL-6与脂质代谢的关系存在争议,IL-6通过不同受体发挥的促炎及抗炎效应,通过下丘脑等中枢神经系统参与调控瘦素、胰岛素抵抗效应被认为是可能机制[13,14]。鉴于脂质代谢包含合成及分解进程,而本文仅检测中性脂质合成总量及合成代谢的部分关键基因,无法完整阐述皮脂腺细胞中脂质代谢的方式。后续将针对脂质成分及脂质分解代谢相关基因检测,结合IL-6敲除的皮脂腺细胞或动物模型进一步明确IL-6在皮脂腺细胞脂质代谢中的作用。
炎症贯穿寻常痤疮发生的始终,痤疮丙酸杆菌(P.acnes)激活Toll样受体2(TLR2)分泌IL-1α介导毛囊皮脂腺导管角化是寻常痤疮发生的启动因素[1,16]。寻常痤疮患者血清及皮损中IL-6表达增加[15];IL-6基因启动子多态性与寻常痤疮发病相关[17];皮脂腺细胞分泌的IL-6能通过诱导Th17细胞分化,参与寻常痤疮早期发生[18]。离体组织模型中,IL-6作用3 d上调皮脂腺漏斗部角质形成细胞中细胞间黏附分子-1表达,IL-1α则无此效应,提示尽管IL-1α作用7 d能介导漏斗部角质形成细胞过度角化而诱导粉刺形成,IL-6似乎发挥了更早的促炎效应而参与寻常痤疮的发生[1]。在人角质形成细胞中IL-6是IL-1α的下游靶因子,研究皮脂腺细胞中IL-6与IL-1α的关系更有利于进一步揭示寻常痤疮早期发病机制,其相关实验正在进行中。
综上所述,本研究明确了SZ95人皮脂腺细胞中IL-6R的表达,体外证实了IL-6促进细胞脂质合成,从基础层面解释了皮脂腺细胞中炎性效应与脂质合成的密切关系,进一步明确了炎症效应及脂质分泌在诱导寻常痤疮发生中的作用机制。考虑到炎性因子众多,研究相关炎性因子的相互作用以及对皮脂腺细胞生物学功能的影响,对进一步揭示寻常痤疮早期发病机制意义重大。

