火龙果茎多糖提取方法比较
李国胜 白新鹏
(海南大学食品科学与工程学院/热带多糖资源利用教育部工程研究中心 海南海口 570228)
火龙果属仙人掌科(Cactaceae)多年生攀缘植物,又名红龙果、青龙果、仙蜜果等[1]。火龙果茎富含多种矿物质、植物甾醇、植物多糖、维生素E 以及黄酮类化合物等[2],果茎中膳食纤维、黄酮类化合物含量丰富,是保健食品的重要加工原料。在多种化学成分中植物多糖的含量较高,达到7%左右[3]。火龙果茎具有生长迅速、分枝能力较强等特点,在火龙果种植过程中,为加快其生长并保持果实品质,一般仅保留一条主茎,需要不断修剪分枝,产生了大量废茎,可以作为火龙果茎多糖提取资源,变废为宝[4]。
多糖的提取方法主要有内部沸腾法、酶提法、微波辅助法、超声波辅助法、热水浸提法及超高压提取法等[5-8]。热水提取法相比其它方法更简便快捷、提取率高,为工业化提取火龙果茎多糖提供了新途径[9]。马若影等[10]研究表明,利用亚临界水提取法来进行实验,最佳提取条件为提取温度140℃,提取时间25 min,料液比1∶50(g/mL)。超声波辅助法的原理是对植物细胞壁造成破坏,主要是采用机械效应以及超声波的空化对植物的细胞壁造成影响,这样可以使细胞内活性物质的溶出效率大大提升,进而可以加快提取的速度[11]。目前我国对火龙果茎的研究报道比较少,火龙果茎加工产业几乎还处于空白阶段,因此火龙果茎的开发前景非常广阔。该研究以火龙果茎为原材料,分别使用热水提取法、亚临界水提取法及超声波辅助法来提取火龙果茎多糖,并对影响多糖提取率的各种因素进行相关分析;同时对不同方法制得的多糖样品进行色泽、中性糖含量、红外光谱等理化指标对比,综合比较3种方法制取多糖的优劣,为火龙果茎的综合开发利用奠定基础。
1 材料与方法
1.1 材料
1.1.1 试材
红心火龙果茎由海南省东方市北纬十八度果业有限公司于2019年6月提供。
1.1.2 试剂
葡萄糖(A.R.)、浓硫酸(A.R.)、苯酚(A.R.)、盐酸(A.R.)、广州化学试剂厂,无水乙醇(A.R.)西陇科学股份有限公司。
1.1.3 仪器
FDU-2100 型冷冻干燥机(上海爱朗仪器有限公司),FW-177 型中草药粉碎机(天津市泰斯特仪器有限公司),GL-20G-Ⅱ型离心机(上海安亭科学仪器厂),HT-250FC型亚临界水提取装置(上海霍桐实验仪器有限公司),752-N 型可见紫外分光光度计(上海精密仪器科学有限公司),EV-321 旋转蒸发仪(北京莱伯泰科仪器股份有限公司),KQ-800KDE 超声波清洗器(昆山市超声仪器有限公司)。
1.2 方法
1.2.1 提取方法
1.2.1.1 热水提取法
将火龙果茎粉碎,过40目筛,得到固体粉末,称量2 g 加入提取瓶,混合一定比例蒸馏水并搅拌,热水提取一定时间,离心取上清液浓缩,醇沉,离心分离,冷冻干燥得多糖粗品。
1.2.1.2 亚临界水提取法
火龙果茎干燥后粉碎,湿润吸水,加适量水并调节pH,在一定温度和时间下进行提取,提取液离心分离,取上清液浓缩,醇沉静置24 h,离心分离,冷冻干燥得粗多糖。
1.2.1.3 超声辅助提取法
将红心火龙果茎粉碎、过40目筛、得到粉末,称量2 g,加入蒸馏水,均匀搅拌,进行超声辅助提取,超声处理考虑条件为:超声时间、处理功率、提取温度、料液比。离心,浓缩,混合乙醇(95%),低温240 min 进行醇沉。离心分离,洗涤,冷冻干燥,得多糖粗品。
1.2.2 火龙果茎多糖的测定
准备火龙果茎多糖5 mg,加水定容到50 mL,该溶液的浓度为0.1 mg/mL,然后对其进行吸光度的测定,利用葡萄糖溶液获得标准曲线,再代入吸光度计算得到火龙果茎多糖的含量。
火龙果茎多糖提取率=[(C×V)/W]×100%
式中,C为样品溶液中多糖浓度(mg/mL),V为样品溶液体积(mL),W为火龙果茎粉质量(mg)。
1.2.3 色泽判定
肉眼观察,对色泽进行描述并记录。
1.2.4 中性糖含量测定
用硫酸-苯酚法[11]得到多糖的标准曲线为Y=48.557 1X+0.006 1,R2=0.993 7。移取 2 mg/mL多糖供试液10 mL,加入5 mL 5%十六烷基三甲基溴化铵溶液,搅拌均匀后,40℃静置5 h,离心,取上清液定容到50 mL,得到中性多糖供试液。准确量取0.1 mL 中性多糖供试液,混合1.0 mL 5.0%苯酚溶液,缓慢加入5.0 mL 浓硫酸,混匀,沸水浴15 min左右,静置至室温,在490 nm最大吸收峰处测定其吸光度,得出含量。
1.2.5 红外光谱分析
取用不同方法制得的干燥火龙果茎多糖样品约2 mg与溴化钾粉末约200 mg,于玛瑙研钵中,在干燥的情况下混匀,研磨均匀后置于压片机内压制成片,采用傅里叶光谱仪TENSOR27 对多糖组分进行分析。使样品在4 000~400 cm-1波长内进行扫描,得到红外光谱图。
1.2.6 数据分析
采用Excel 2010 软件进行数据整理和作图,所有试验重复3 次,取平均值。并使用Omnic 8.2软件进行数据分析与整理。
2 结果与分析
2.1 热水提取法
2.1.1 提取温度
将液料比设置为25∶1(mL/g),加热的时间为3 h,分别放置于75、80、85、90℃下进行提取。提取率如图1 所示。由图1 可知,随着温度的提高,多糖提取率先大幅增加,而后缓慢下降。由此可知,当提取温度80℃时,多糖的提取率达到最大值2.78%。
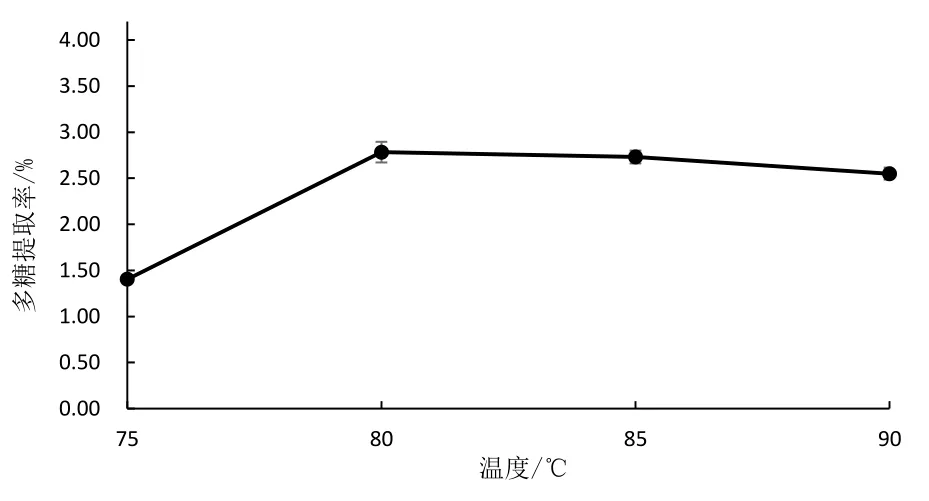
图1 提取温度与提取率的关系
2.1.2 提取时间
液料比设定为 25∶1 (mL/g),提取温度为80℃,然后设定提取时间分别为0.5、1、2 和3 h,由此观察提取时间对提取率的影响,从而确定最佳的提取时间,结果详见图2。由图2 可知,当温度不变时,随着提取时间的延长,提取率逐渐提高,1~2 h 提取率增加的速度最快,由1.4%提高到2.99%,而2~3 h 提取率缓慢上升,在3 h 时达到最大值3.11%,综合考虑时间成本,选择最佳提取时间为3 h。

图2 提取时间与提取率的关系
2.1.3 液料比
提取时间3 h,温度80℃的条件下,分别以15∶1、20∶1、25∶1 及30∶1(mL/g)进行液料的比例设置。从图3可以看出,随着液料比的增加,在15∶1~25∶1(mL/g),曲线呈现上升趋势,说明火龙果茎多糖的提取率在此范围内逐渐增加,而后提取率下降。因此最佳液料比例为25∶1(mL/g),此时提取率最高,达4.12%。

图3 液料比与提取率的关系
根据上述单因素试验,使用热水提取法时,提取最佳条件为3 h、80℃、液料比例25∶1(mL/g),提取率达到最高为4.12%。
2.2 亚临界水提取法
2.2.1 提取时间
固定料液比为1∶40(g/mL)、140℃、pH 5,分析不同提取时间对提取率的影响,得到最优提取时间,结果如图4。由图4 可看出,最适的提取时间是25 min,此时提取率达到20.53%。而提取时间更久反而得率下降,原因可能是随着提取时间的增加,导致细胞破碎度逐渐增大,过多碎片阻碍多糖溶出,导致提取率下降[12]。
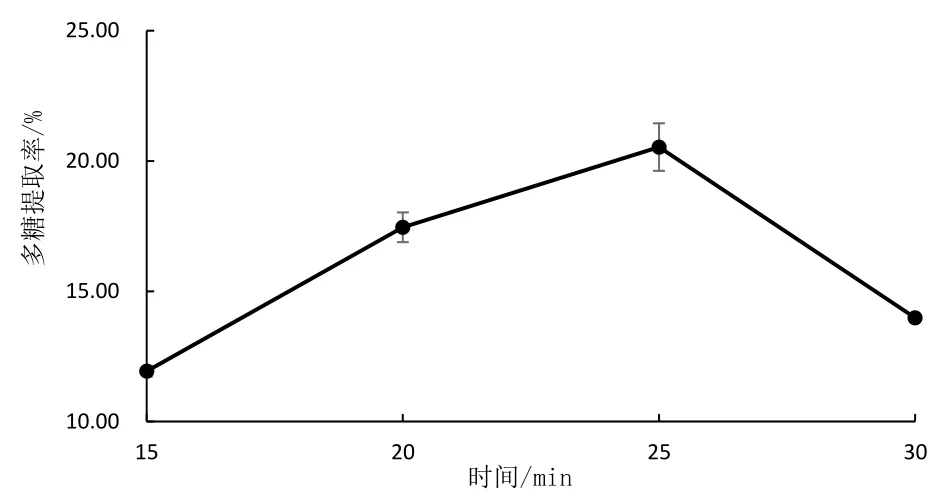
图4 提取时间与提取率的关系
2.2.2 提取温度
当条件为1∶40(g/mL)、pH 5、25 min,提取温度分别160、140、120、110℃,分析在不同温度对提取率的影响,结果如图5。由图5 可知,在110~140℃,多糖提取率随提取温度升高而明显增加,当温度为140℃时,多糖提取率达到最大20.53%。但当温度达到160℃时,多糖提取率下降,这说明适当的升高温度可提高多糖提取率,但是过高的温度可通过褐变反应致使多糖降解[13]。所以,最佳提取温度为140℃。

图5 提取温度与提取率的关系
2.2.3 液料比
固定条件为140℃、pH 5、25 min,液料比例为50∶1、40∶1、30∶1、20∶1(mL/g) 时,对多糖提取率的影响,结果如图6 所示。从图6 可知,多糖提取率随着液料比的增加先提高后降低,在液料比为40∶1(mL/g)时,提取率达到了20.53%的峰值,这可能是因为液料比的增加可以加速去离子水向细胞中扩散并增强其对多糖的吸附性[14]。随着液料比的继续增加,多糖提取率下降,过量的去离子水会使多糖溶解达到饱和状态,导致提取率降低[15]。所以,选择液料比40∶1(mL/g) 为最佳条件。

图6 液料比与提取率的关系
2.2.4 pH
当液料比为1∶40(g/mL),提取温度140℃,提取时间25 min,探究不同pH 对提取率的影响,结果见图7。从图7 可以看出,pH 5 时,提取率达到最大值。当pH 持续增加时,提取率有所下降。因此选择pH 5为最适条件。

图7 pH值与提取率的关系
采用亚临界水提取法,以提取时间、提取温度、液料比以及pH 值作为影响因素,最优工艺为提取时间25 min、提取温度140℃、液料比例40∶1(mL/g)、pH 5时,提取率达到最佳20.53%。
2.3 超声辅助提取法
2.3.1 超声时间
将条件固定为60℃、1∶20(g/mL)、240 W,超声时间分别为4、9、14、19 min,分析不同超声时间对提取率的影响,结果见图8。从图8 可知,当提取时间为9 min时,提取率最高为2.18%。

图8 提取时间与提取率的关系
2.3.2 液料比
将条件固定为60℃,240 W、9 min,探究不同液料比对提取率造成的影响,结果见图9。从图9可以看出,多糖提取率随着液料比的增加呈先升后降的趋势,液料比为20∶1(mL/g)时,提取率达到最大值。因此,选用的液料比为20∶1(mL/g)。

图9 液料比与提取率的关系
2.3.3 提取功率
将超声温度固定在60℃,料液比1∶20(g/mL),超声时间9 min,分析不同超声功率下,提取率的变化,结果见图10。由图10 可知,当超声功率为240 W时,火龙果茎多糖的提取率达最高为2.18%。当超声时间一定时,超声功率越大,机械剪切和空化作用越强,多糖提取量逐渐增加,但当功率过大易导致糖苷键的断裂,从而使多糖提取率降低[16]。因此,选用最佳超声功率为240 W。
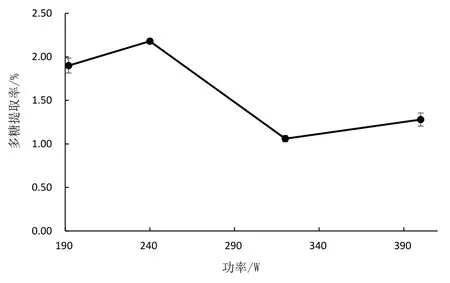
图10 超声功率与提取率的关系
2.3.4 提取温度
将液料比固定为20∶1(mL/g),超声功率240 W,超声时间9 min,对不同超声温度下的提取率进行比较分析,结果见图11。由图11 可知,当提取温度为60℃,提取率最高为2.18%。

图11 提取温度与提取率的关系
采用超声辅助提取法,分析了4个影响因素对提取率的影响,最佳工艺为提取温度60℃、超声功率为240 W、液料比20∶1(mL/g)、超声时间9 min时,提取率为2.18%。
2.4 综合比较
在用不同提取方法所得多糖粗品后,对这些多糖粗品进行初步的基础性质评定,包括颜色是否洁净,形态是否稳定,探究采用不同的提取方法对提取物造成的影响,结果详见表1。根据表1可知,3 种方法获得的提取物颜色相差不大;亚临界水提取法的提取率最高为20.53%,中性糖的含量最高达到89.45%,超声辅助提取法的提取率及中性糖含量最低,仅有38.50%;热水提取法的提取率及中性糖含量介于二者中间。推测原因为热水提取时间过长,导致多糖部分溶于水中,效果较差;而超声辅助提取受超声波影响,部分多糖组分溶出未能被提取,且时间较短导致提取率较低。但亚临界提取法存在设备要求高,耗能高等不足,难以实现规模化提取。
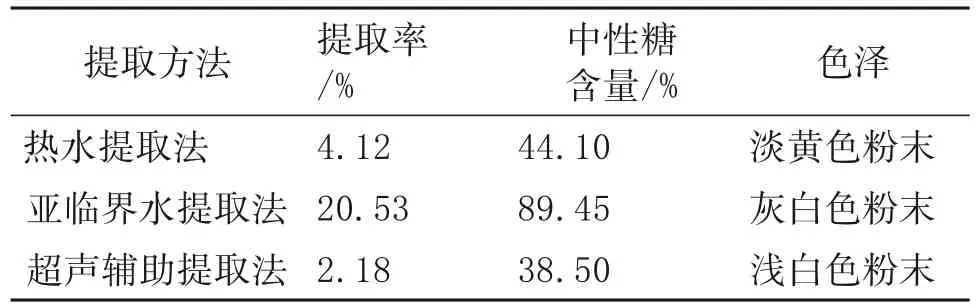
表1 不同提取方法所得多糖样品的综合比较
2.5 红外图谱分析
不同提取方法所得的多糖红外光谱如图12 所示。在3 412 cm-1处的强吸收峰是由-OH官能团的伸缩振动引起,峰形较宽,表明多糖存在分子内或分子间有氢键;烷基C-H在2 930 cm-1附近产生的伸缩振动吸收峰是糖类物质的典型特征吸收峰;在1 610 cm-1附近的强吸收峰是由C=O 的不对称伸缩振动引起的;在1 419~1 200 cm-1是C-H 的变形振动引起的吸收峰。1 078 cm-1处的一组强吸收峰是由糖环上C-O-C 的伸缩振动引起的,且该峰为吡喃环的特征吸收峰[17],说明火龙果茎多糖具有吡喃环结构;891 cm-1处的吸收峰表明火龙果茎多糖具有β-型糖苷键。3种粗多糖红外光谱图均含有典型的多糖特征吸收峰,且具有相似的红外光谱,由此可以认定,3种粗多糖在化学结构上基本一致。
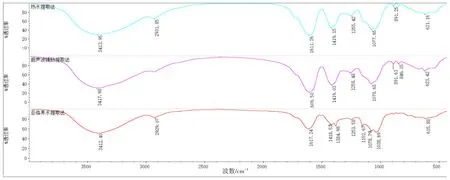
图12 火龙果茎多糖红外光谱图
3 讨论与结论
火龙果茎的开发利用前景十分广阔,除刺后,可切成片鲜食,用果汁机打碎可作冷饮或调制冰淇淋[1]。植物多糖具有多方面的生物活性,常作为保健食品的营养成分,火龙果茎含有丰富的营养成分,具有特殊的生理功能,尤其是植物性多糖的含量较高。因此,火龙果茎多糖开发利用前景广阔[2]。热水提取、亚临界水提取及超声辅助提取3种方法所得火龙果茎粗多糖的提取率分别为4.12%、20.53%和2.18%,使用亚临界水提取法的提取率最高。但亚临界水提取法对设备的要求较高,难以实现大规模提取;使用热水提取法的提取率虽较低,但本方法对设备的要求不高,易于实现,只是存在提取时间较长,消耗能源较大等缺点;超声辅助提取法的提取率相对较低,但这种方法耗时较短。所以,多糖的提取分离应根据不同种类多糖的性质选择合适的方法,尽量避免单一方法,同时联合应用两种或多种提取分离方法。3 种方法得到的粗多糖颜色相近;且经红外光谱分析3 种粗多糖具有相似的红外光谱,均含有典型的多糖特征吸收峰,火龙果茎多糖具有吡喃环结构并呈现β-型糖苷键吸收峰;不同方法提取的粗多糖样品结构无明显差异。该研究为有效利用火龙果茎提供了理论依据。

