长链非编码RNA GAS5 在肿瘤相关巨噬细胞中的调控机制
李琳 李建东 高志康 徐浩 崔艳峰
HCC 是人类最具侵袭性的恶性肿瘤,因为其转移和复发,被列为癌症相关死亡的最常见原因之一[1,2]。HCC 是一种与慢性炎症相关的肿瘤。在HCC 的炎症微环境中,入侵的炎症细胞主要是肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)[3]。研究表明,巨噬细胞的去除可以抑制肿瘤的进展和转移[4-6]。在肿瘤微环境下,研究巨噬细胞在HCC 发生发展中的分子机制[7],将为靶向治疗HCC 提供新的策略。长链非编码RNA(LncRNAs)在癌细胞增殖、凋亡、侵袭、迁移和转移等多种生物学过程中扮演着重要角色[8],在HCC 的发生发展中起重要作用。GAS5(LncRNA growth arrest-special transcript 5)是GAS 家族的一员。以往的研究表明GAS5 对肿瘤的发生具有抑制作用[9]。但是GAS5 在巨噬细胞中的作用仍未可知。10 号染色体上缺失的PTEN是一种重要的肿瘤抑制因子。有研究表明,GAS5 通过与miR-32-5p、miR-103 或miR-222-3p 的靶结合,促进PTEN 的表达[10-13]。GAS5 通过直接抑制miR-21 的表达,进而下调与肿瘤细胞迁移和侵袭密切相关的基因[14],即人程序性细胞死亡因子和PTEN的表达下调,最终抑制肿瘤细胞的迁移与侵袭。因此,本研究通过ELISA 和qRT-PCR 技术,分析GAS5 和PTEN 在TAMs 中的调控机制,探讨其在HCC 发生发展中的变化,为揭示HCC 的发病机制提供实验依据。
1 材料与方法
1.1 实验材料 单核巨噬细胞(THP-1)获自中国科学院细胞库。所有引物均购自Takara 公司。用于检测的人肝癌组织及相应癌旁肝组织取自徐州医科大学附属医院肝胆外科手术切除标本。所有患者术前未接受过放疗或生物治疗等干预措施。取材后放入-80℃冰箱低温保存。
1.2 培养单核巨噬细胞 THP-1 在RPMI-1640 培养基(Sangon Biotech)中培养,该培养基含10%胎牛血清(FBS,Sangon Biotech)和1%青霉素/链霉素。细胞在37℃和5% CO2环境中培养。
1.3 巨噬细胞的极化 取1.2 分离培养处于对数生长期、生长状态良好的THP-1,按2×104/孔接种于24 孔板共培小室上室中,用不同的处理方法诱导分化成不同类型的巨噬细胞。50 mg/ml 的巨噬细胞集落刺激因子(MCSF)作用24 h后诱导THP-1分化为M0巨噬细胞;100 ng/ml 脂多糖(LPS)和γ-干扰素(IFN-γ)处理24 h,诱导THP-1 向M1 型巨噬细胞分化。对于M2 型巨噬细胞,THP-1 与白细胞介素-4(IL-4)(20 mg/ml)共孵育24 h。THP-1 在含50% HepG2 细胞上清液和10%胎牛血清的RPMI-1640 培养基中培养7 d,诱导分化为TAMs。
1.4 ELISA 吸取不同类型的巨噬细胞上清液,3000 r/min 离 心10 min,采 用ELISA 检 测IL-1β、TNF-α、IL-10、IL-12 表达。操作步骤按ELISA 试剂盒说明书进行。
1.5 qRT-PCR 采用qRT-PCR 检测GAS5 和PTEN的表达。使用RNA simple 总RNA 试剂盒(Tiangen)提取培养细胞中总RNA。RNA 的纯度使用Nano Drop 2000 分光光度计(Thermo Fisher Scientific)进行检测。用琼脂糖凝胶电泳法测定RNA 的含量。利用Prime Script TM RT Reagent Kit(Takara) 将RNA转化为互补DNA。采用SYBR Green PCR Mix 试剂盒(Takara),在ABI7300 序列检测系统(应用生物系统)上按说明书进行qRT-PCR。
1.6 统计学方法 采用SPSS22.0 统计学软件进行统计分析。计量资料以均数±标准差()表示,采用t检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 四种巨噬细胞上清液中IL-1β、TNF-α、IL-12、IL-10 的表达变化 检测四种巨噬细胞上清液,结果显示,相较于M0,M1 中IL-1β、TNF-α、IL-12表达上调,IL-10 表达下降;M2 和TAMs 中IL-10 表达上调,IL-1β、TNF-α、IL-12 表达下降,差异具有统计学意义(P<0.05)。见图1。
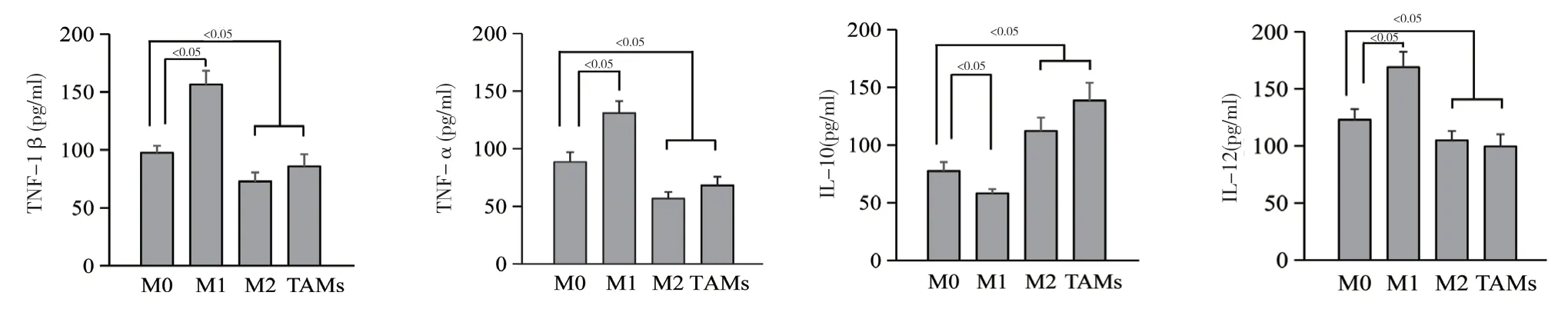
图1 四种巨噬细胞上清液中IL-1β、TNF-α、IL-10、IL-12 的表达变化
2.2 GAS5 和PTEN mRNA 在四种巨噬细胞中的表达变化 qRT-PCR 检测四种巨噬细胞中GAS5 和PTEN mRNA 的表达。结果显示,相较于M0,GAS5 和PTEN mRNA 在M1 中表达均有不同程度的上调,GAS5 和PTEN mRNA 在M2、TAMs 中表达下降,差异具有统计学意义(P<0.05)。见图2。

图2 GAS5 和PTEN mRNA 在巨噬细胞中的表达变化
2.3 GAS5 和PTEN mRNA 在肝癌组织与正常癌旁组织中表达的变化 收集HCC 患者肿瘤组织和正常癌旁组织,qRT-PCR 检测GAS5 和PTEN mRNA 的表达。结果显示,与正常癌旁组织相比,肝癌组织的GAS5 和PTEN 表达明显上调,差异具有统计学意义(P<0.05)。见图3。

图3 GAS5 和PTEN mRNA 在肝癌组织与正常癌旁组织中表达的变化
3 讨论
HCC 在我国发病率呈逐年上升趋势,虽然肝癌的基础和临床研究不断取得进展,但大多数患者就诊时已是肿瘤晚期,无法获得较好的治疗效果。因此,寻找诊断和判断预后的肿瘤标志物已经成为提高HCC 诊疗水平和降低患者复发率的重要方法。
研究发现,肿瘤的诱发常以慢性炎症为背景,并伴随免疫细胞(如巨噬细胞、T 淋巴细胞等)通过释放各种细胞因子直接或间接杀伤靶细胞来发挥促肿瘤或抗肿瘤作用[15,16]。巨噬细胞是高度可塑的细胞,可以在表型上极化为两个主要细胞群:M1 型巨噬细胞主要表现为杀伤肿瘤,促进炎性反应的活性;而M2 型巨噬细胞主要表现为抗炎症,促进肿瘤的生长侵袭活性[17,18]。肿瘤周围的TAMs 往往表现为M2 型,TAMs 通过表达细胞因子和趋化因子抑制肿瘤免疫,从而促进肿瘤的进展[19,20]。本研究发现,TNF-α 和IL-12 在M1 型中高度表达,IL-10 在M2 和TAMs 明显上调。M0 型为非极化巨噬细胞,各种细胞因子的表达不会像极化巨噬细胞有明显的偏置。M1 型高表达IL-1β、TNF-α、IL-12,低表达IL-10,表现出明显的促炎活性;M2 型高表达IL-10,低表达IL-12 和TNF-α,赋予了强大的抗炎特性。TAMs 表现出M2 样表型。
近年来,众多研究表明长链非编码RNA GAS5 在HCC 中起到重要的调控作用。有研究发现,GAS5 通过miR-182/ANGPTL1 轴抑制肝癌细胞的转移[21]。GAS5通过海绵细胞miR-135b 促进RECK 的表达,从而抑制肝癌细胞的侵袭[22]。Corylin 通过抑制GAS5 介导的上皮-间充质转化来抑制HCC 的进展。通过在Starbase等生物信息学网站的检索表明,miR-21 是lncRNA GAS5 的结合分子之一,而PTEN 基因是miR-21 的下游抑制靶点之一。Khalid 等[23]的研究证实了PTEN 与肝癌相关,PTEN 可作为病毒诱导肝癌的潜在预后标志物,HRD1 通过抑制PTEN 的表达促进肝癌细胞的增殖。因此,推测lncRNA-GAS5 的抗肝癌细胞侵袭作用可能是通过抑制miR-21/PTEN 轴而实现的。
本研究发现GAS5 在M1 型巨噬细胞中表达上调,在M2 巨噬细胞和TAMs 中表达下调,提示GAS5 在TAMs 中被抑制。癌组织中GAS5 和PTEN 较癌旁组织表达明显增高,说明GAS5 和PTEN 参与HCC 的发生。由此推测:肝脏发生癌变过程中肝癌细胞与肝癌浸润的单核/巨噬细胞相互作用,巨噬细胞由肿瘤初期的M1 型进展为后期的M2 型和TAMs,TAMs 募集通过分泌细胞因子促进有丝分裂及血管生成的表达增多,加速肝癌的进程。TAMs 的密度与肝癌患者的生存时间呈负相关,本研究发现肝癌组织的GAS5 和PTEN 表达增加,说明GAS5 可能参与PTEN 在肝癌细胞的过表达,PTEN 作为具有蛋白磷酸酶和脂质磷脂酶活性的抑癌基因,其表达增加用于抵御肝癌细胞的恶性增长,稳定和增强肝癌细胞间粘附,抑制肝癌细胞浸润和转移。因此,推测GAS5 在HCC 进展过程中与TAMs 的极化和PTEN 有关,GAS5 可能是肝癌治疗的一个新的治疗靶点。
有研究发现,PTEN 可通过诱导细胞周期素依赖性激酶抑制剂p21 等的表达,在抑制细胞的迁移、铺展和局部粘附及抑制肿瘤新生血管形成等诸多机制发挥抑瘤作用[24]。PTEN 多途径抑制肿瘤的浸润和转移,影响患者的预后。那么,GAS5 和PTEN 在不同极化巨噬细胞中对肝癌细胞增殖、迁移、侵袭有怎样的调控作用,仍需进一步探讨。

