“清橐1号”复配除草剂防除黄帚橐吾生理特性研究
王玉琴,宋梅玲*,王宏生
(1.青海省青藏高原优良牧草种质资源利用重点实验室,青海大学畜牧兽医科学院,青海 西宁 810016;2.省部共建三江源生态与高原农牧业国家重点实验室,青海大学,青海 西宁 810016)
黄帚橐吾(Ligulariavirgaurea)系菊科橐吾属多年生草本植物,为高寒草甸最常见的一种毒害草,主要分布于我国西藏东北部、云南西北部、四川、青海、甘肃等地[1]。近年来,高寒草场不断退化,群落结构发生改变,毒害草滋生蔓延,经调查,青海省橐吾属植物危害面积为19.4×104hm2,黄帚橐吾的发生面积占总毒草面积的24%,严重危害区密度高达60株/m2,被认为是高寒草甸退化的指示物种[2-4],如不对其加以防控,将严重影响草地生态平衡和载畜功能。
毒杂草的蔓延一方面会对家畜造成严重的危害(引起家畜中毒,甚至死亡),另一方面也降低了草地的产量和质量[5]。为了控制黄帚橐吾大面积滋生,人们做了大量的研究工作,积极寻找防除黄帚橐吾的有效途径,虽然有研究利用植物之间的化感作用进行黄帚橐吾植物源除草剂的开发[6],但对于黄帚橐吾的防控仍主要以化学除草剂防治为主[7]。目前用于防除黄帚橐吾的除草剂主要有迈士通、龙拳和“清橐1号”,其中“清橐1号”的防效以及对优良牧草的安全性均最佳[7-8]。复配除草剂“清橐1号”为青海大学畜牧兽医科学院草原研究所研制的防除黄帚橐吾高效专用除草剂,对黄帚橐吾的防效达95%以上[3],研究者已对该药剂的配方优化、防治效果等方面进行了研究,但由于除草剂和植物之间相互作用的复杂性,有关“清橐1号”防除黄帚橐吾的作用机理以及黄帚橐吾的生理机制还缺乏相关研究。因此,本研究采用喷雾法对盆栽黄帚橐吾进行防除,通过对黄帚橐吾根系活力、叶绿素含量、游离脯氨酸、丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、可溶性糖以及可溶性蛋白等生理指标相对变化的测定,初步探讨黄帚橐吾植株对化学药剂的生理响应以及明确除草剂的作用机理,以期为高寒草地毒害草黄帚橐吾的防除工作提供理论依据和技术指导。
1 材料与方法
1.1供试植株及试验设计2020年6月,在青海省海北藏族自治州海晏县青海湖乡达玉德吉村黄帚橐吾危害较重的天然草地上,挖取正常生长的黄帚橐吾植株移栽至花盆,花盆内装满灭菌的营养土,移栽后定期对植株进行浇水并观察植株的生长情况。7月选取生长良好,长势均匀,且处于相同生长期的植株喷洒“清橐1号”,每平方米用药液量0.2 mL,对照用等量清水喷洒,每个处理重复20次,合计40盆。
1.2黄帚橐吾生理指标测定分别在施药后第1天、第5天、第10天、第15天、第30天随机挑选 5盆,每盆取新鲜茎叶5 g左右,分别测定黄帚橐吾根系活力、叶绿素含量、丙二醛、游离脯氨酸、可溶性糖、可溶性蛋白含量以及体内抗氧化酶(超氧化物歧化酶、过氧化物酶和过氧化氢酶)活性。其中,采用氯化三苯基四氮唑(TTC)法测定根系活力,采用分光光度法测定叶绿素含量,采用硫代巴比妥酸法测定丙二醛含量,采用酸性茚三酮法测定游离脯氨酸含量,采用蒽酮比色法测定可溶性糖含量,采用考马斯亮蓝G-250法测定可溶性蛋白含量,采用氮蓝四唑光化还原法测定超氧化物歧化酶活性,采用愈创木酚法测定过氧化物酶活性,采用高锰酸钾滴定法测定过氧化氢酶活性[9-10]。
1.3数据分析运用SPSS 22.0软件,采用单因素方差分析比较施药和不施药各指标随时间变化的差异显著性(P<0.05);采用独立样本T检验分析施药与不施药同一时间各生理指标间差异显著性(P<0.05)。采用Excel软件对数据进行统计并绘制图表。
2 结果与分析
2.1除草剂对黄帚橐吾根系活力的影响施药后根系活力呈先降低后增加的趋势,而CK呈先降低后增加再降低的趋势(图1)。施药1 d后,黄帚橐吾的根系活力较CK显著增加,随着施药时间的延长,根系活力显著降低(P<0.05),在施药5 d后,根系活力达到最小值,随后根系活力有增加趋势,但总体低于CK,施药30 d后,根系活力又有所增加,且高于CK。
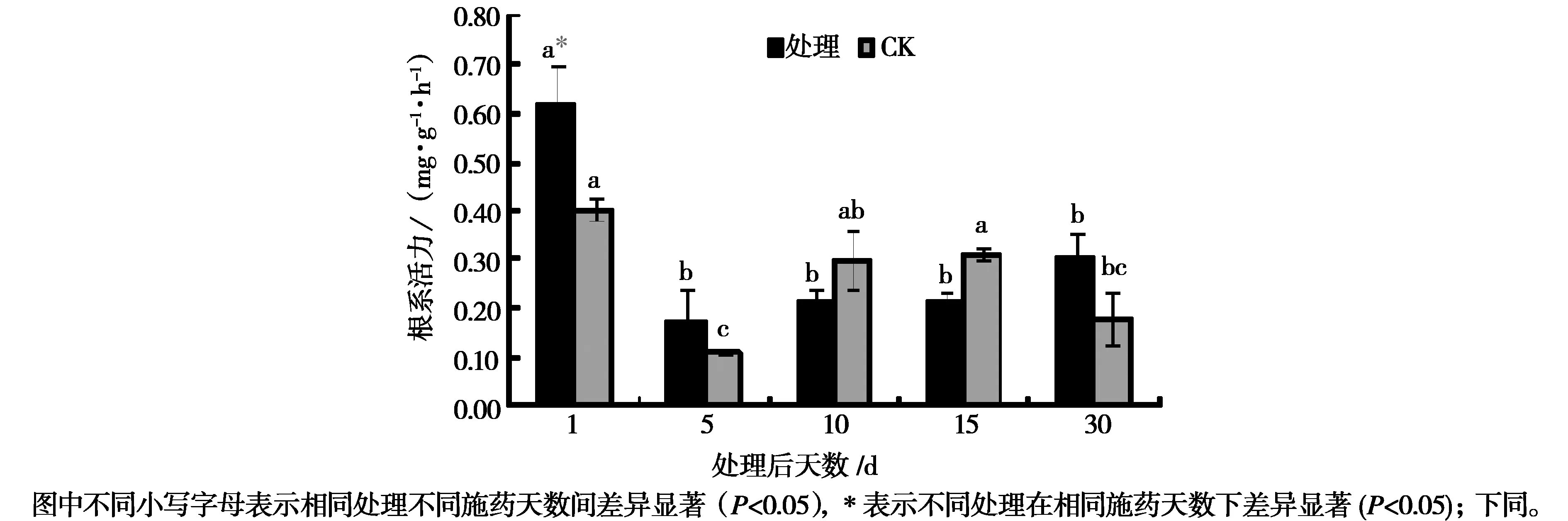
图1 施药对黄帚橐吾根系活力的影响Fig.1 Effects of pesticide application on the root activity of L·virgaurea
2.2除草剂对黄帚橐吾叶绿素含量的影响由图2可知,施药后黄帚橐吾叶片内叶绿素含量有一定程度的变化,其中叶绿素a含量显著下降(P<0.05), 30 d后叶绿素a含量比施药1 d下降74.1%,而CK的叶绿素a含量下降45.2%,且施药 30 d后的黄帚橐吾叶绿素a含量比CK降低了56%;施药后黄帚橐吾叶片内类胡萝卜素含量较CK有所增加,30 d后类胡萝卜素含量比施药1 d增加66.9%,而CK的类胡萝卜素含量增加37.5%,且施药 30 d后的类胡萝卜素含量比CK升高了56.8%;叶绿素b含量在施药前后变化不明显。

图2 施药对黄帚橐吾叶片叶绿素含量的影响Fig.2 Effects of pesticide application on the chlorophyll content in leaves of L·virgaurea
2.3除草剂对黄帚橐吾游离脯氨酸和丙二醛含量的影响游离脯氨酸含量的变化趋势与丙二醛含量的变化趋势一致(图3),在施药后5 d内游离脯氨酸的含量略低于CK,施药10 d后游离脯氨酸含量呈现逐渐增加的趋势,并逐渐高于CK,在15 d后增加显著,施药30 d的游离脯氨酸含量显著高于CK,是CK的10倍左右。黄帚橐吾体内丙二醛含量在施药后5 d内略低于CK,10 d后丙二醛含量逐渐增高,施药30 d后丙二醛含量显著高于CK,且是CK的2.8倍。

图3 施药对黄帚橐吾游离脯氨酸和丙二醛含量的影响Fig.3 Effects of pesticide application on the free proline and MDA content of L·virgaurea
2.4除草剂对黄帚橐吾抗氧化酶活性的影响由图4可知,施药处理和CK的黄帚橐吾体内的SOD活性变化均呈先增加后降低的趋势,均在15 d时达到最大值,施药后SOD活性逐渐高于CK,30 d时SOD活性又低于CK,但施药处理与CK之间差异不显著。施药后黄帚橐吾体内POD活性先增加后降低,在施药10 d后达到最大值,且显著高于CK(P<0.05),而CK在30 d内变化不明显,另外,施药的SOD活性除了施药1 d时低于CK外,其余均高于CK。施药处理和CK的黄帚橐吾体内的CAT活性均在10 d内呈下降趋势,施药处理的CAT活性略高于CK,施药10 d后的CAT活性均呈增高趋势,CK增高较明显,且在30 d时显著高于施药处理(P<0.05),施药后CAT活性与CK相比呈先增加后降低的趋势。

图4 施药对黄帚橐吾抗氧化酶活性的影响Fig.4 Effects of pesticide application on the antioxidant enzyme activity of L·virgaurea
2.5除草剂对黄帚橐吾可溶性糖和可溶性蛋白含量的影响施药5 d后黄帚橐吾的可溶性糖含量显著增加(P<0.05),10 d后比CK显著增加2倍左右,并随施药天数的延长呈增加趋势。施药后黄帚橐吾的可溶性蛋白含量呈现先显著增加后降低的趋势,10 d后含量下降不显著(P>0.05),且在施药15 d内均高于CK,而CK在施药5 d后呈现显著增加(P<0.05),且在30 d时可溶性蛋白含量高于施药处理,高出62.2%(图5)。

图5 施药对黄帚橐吾可溶性糖和可溶性蛋白含量的影响Fig.5 Effects of pesticide application on the soluble sugar and solube protein of L·virgaurea
3 讨论与结论
根系作为植物吸收营养的重要器官,直接影响植物地上部分的生长[11]。本试验通过对黄帚橐吾根系活力的分析可知,施药后根系活力显著降低,说明施药后抑制了植株根系的生长,进而影响植株养分的获取以及植株正常生长。叶绿素是光合作用的基础,而光合作用又是植物正常生长发育的物质和能量来源[12],施药后叶绿素含量与CK相比逐渐降低,且叶绿素a含量降低明显,说明药剂降低了黄帚橐吾的光合作用,叶绿素含量的下降也说明植物叶片出现了一定的损伤,并出现局部叶片的黄化现象,与施药后盆栽植株表现的症状一致,该结果与崔家丽等[13]、刘大丽等[14]以及赵宝平等[15]的研究结果一致,植物分别在虫害、氮以及水分等逆境胁迫下,叶绿素含量下降,叶片逐渐变黄。此外,植株体内类胡萝卜素含量与CK相比呈增加趋势,说明叶片中的类胡萝卜素可能通过帮助维持光合作用来降低农药对植物造成的影响,有研究发现通过添加类胡萝卜素来恢复植物叶片的叶绿素组成以及降低膜氧化程度,说明在逆境胁迫下,类胡萝卜素起到重要作用[16-17]。
逆境胁迫下植物为了保护自身免受损害进化出多种防御机制,首先是植物体内渗透调节物质的增加,而游离脯氨酸是重要的渗透调节物质,可以提高植物在非生物或生物胁迫下的耐受性[18],具有稳定细胞膜[19],维持细胞膨胀和渗透平衡[20]及清除活性氧和抗氧化[21]等功能。在本试验中黄帚橐吾体内游离脯氨酸的含量随着施药时间的增加呈增加趋势,且在30 d时游离脯氨酸含量显著增加,含量为CK的10倍,这说明施药后黄帚橐吾植株为了缓解不良环境对生长造成的影响,通过积累游离脯氨酸含量来维持组织细胞间的水分平衡,从而来适应农药胁迫。另外,有研究表明添加外源脯氨酸能提高植物耐受性,缓解生长抑制[22-23],进一步证实了本文的结果。
植物在遭受逆境胁迫时,首先是植物的细胞膜遭到破坏[22],而植物也会产生丙二醛与活性氧发生过氧化反应来保护细胞膜。在本试验中,黄帚橐吾施药后丙二醛含量逐渐升高,并在30 d时急剧增加,是CK的2.8倍,可能由于药剂破坏了植株的细胞结构,诱导叶片产生大量的丙二醛,使植物代谢失调,降低了膜系统的稳定性,促使黄帚橐吾衰老,进而达到防除的目的,这一结果与张腾国等[24]的结论相似。同时,植物为了能够保持正常的生长代谢活动,体内会产生大量的抗氧化酶(SOD、POD和CAT)来降低体内氧自由基水平,减少对细胞膜的损伤,使体内正常生长代谢得以维持,并提高植物的抗逆性[25-26]。这一点在黄帚橐吾受到农药胁迫后的SOD、POD和CAT活性酶的变化趋势中(先升高后降低)能够得到很好的印证,并且抗氧化酶在施药15 d左右出现降低趋势,有可能是农药胁迫超出了黄帚橐吾的承受范围,破坏了酶的作用中心,抗氧化酶活性降低,细胞膜脂质过氧化程度加剧,进而使植物生长抑制,衰老加快。
可溶性糖和可溶性蛋白在植物抵御逆境胁迫时也起到关键作用,可以使植物细胞内的水分受到一定的束缚[27]。黄帚橐吾施药后,叶片内可溶性糖含量逐渐增加,并显著高于CK,可溶性蛋白含量先增加后减少,这是由于植株通过积累可溶性糖和可溶性蛋白来维持细胞间的水分平衡和渗透势来使植物适应农药胁迫[28],可溶性蛋白的减少可能是由于随着时间的推移,黄帚橐吾本身的耐受力被损害,叶片逐渐衰老,可溶性蛋白的合成受到抑制,使其含量逐渐降低。
综上所述,“清橐1号”防除黄帚橐吾后黄帚橐吾植株的根系生长和光合作用均受到抑制,且复配剂在一定程度上破坏了细胞膜结构、抗氧化系统以及细胞间的水分平衡,丙二醛、游离脯氨酸、可溶性糖含量的增加以及抗氧化酶活性的先增加后减少,进而破坏植物组织,抑制植株生长,导致黄帚橐吾衰老加快并死亡,最后达到防除目的。本试验仅仅分析了“清橐1号”复配除草剂对黄帚橐吾生理生化的影响,对草地其他植物以及环境方面的影响有待进一步研究。同时,应在此基础上加速推广应用,使其在草地生态中发挥应有的作用。

