颅内破裂动脉瘤的血流动力学特征:基于流固耦合技术的计算流体力学模拟分析
邹成功 唐 辉 邵 川 王潇娅 孙 谋 杨 荣 章 涛 何家全
颅内动脉瘤破裂是导致蛛网膜下腔出血的主要原因[1],病死率与致残率极高,约一半以上的存活病人会遗留严重的后遗症[2]。目前,颅内动脉瘤破裂的具体机制虽未完全搞清楚,但是一般认为血流动力学变化是关键因素。目前的研究多涉及对比分析颅内破裂动脉瘤与颅内未破裂动脉瘤之间的血流动力学或形态学的差别,缺少颅内动脉瘤破裂点与瘤囊的血流动力学所致动脉瘤形态变化的对比分析[3],原因主要是CTA、DSA 等血管成像技术只能间接确认颅内动脉瘤破裂点且不准确。目前,最准确的判断颅内动脉瘤破裂点的方法是在开颅夹闭术中充分暴露动脉瘤而直接显露破裂点,但是术中显微镜下观察很难判断破裂点与瘤囊的血流动力学变化。目前,计算机流固耦合技术已广泛应用于模拟分析颅内动脉瘤的血流动力学特征。本文基于术前CTA、DSA 检查对动脉瘤进行三维重建,结合术中显微镜下确定的动脉瘤破裂点确切位置,应用流固耦合技术模拟分析破裂点血流动力学特征及其对应的动脉瘤形态变化。
1 资料与方法
1.1 研究对象 纳入标准:①两名神经外科医生在动脉瘤夹闭术中或手术高清录像视频中能确定破裂点;②术前3D-CTA、DSA 数据能通过软件重建高质量三维模型。排除标准:临床数据不齐全;动脉瘤三维重建困难;破裂点显示不清楚。
2018年1月至2019年6月收治颅内破裂动脉瘤159 例,根据纳入标准最终入选21 例且均为单一动脉瘤,其中男5 例,女16 例;年龄49~75 岁,平均(63.97±9.30)岁;长期吸烟史6 例,长期饮酒史4 例,高血压病史6 例,糖尿病病史2 例;术前Hunt-Hess分级Ⅰ级9例,Ⅱ级8例,Ⅲ级3例,Ⅳ级1例。
1.2 动脉瘤形态学特征21个动脉瘤瘤体宽度3.40~7.80 mm,平均(5.19±1.10)mm;瘤体长度4.10~8.70 mm,平均(6.14±1.02)mm;瘤颈宽度2.40~7.20 mm,平 均(3.99±1.12)mm。AR 比 值0.89~2.25,平 均(1.60±0.28);动脉瘤形态规则9个,不规则12个。
1.3 破裂点和瘤囊的部位定义 破裂点:开颅夹闭术中或录像能观察到明显的破口或不完整的非常薄的动脉瘤壁,与血肿、白色血栓或者周围组织紧密处。瘤囊:动脉瘤壁异常突起的囊性部分,本文取瘤顶与瘤颈连线中轴部位。
1.4 影像数据处理
1.4.1 颅内动脉瘤三维模型的建立 CT 数据导入GIMIAS 1.8 软件,重建模型;DSA 三维数据在SIEMENS Artis Zeego工作站生成高质量的三维模型;二者均以标准模板库STL格式保存。
1.4.2 颅内破裂动脉瘤破裂点标记 根据CTA、DSA数据重建的三维模型,两名神经外科血管组医生根据术中或手术高清录像视频,通过三维旋转功能,在多个投影位置,仔细核对动脉瘤部位、大小、形状、瘤颈宽度、瘤体长度及载瘤动脉直径,确定破裂点的具体部位。
1.4.3 网格划分 将前述颅内动脉瘤模型的STL数据导入ANSYS 19.1 中ICEM 模块,进行动脉瘤壁和载瘤动脉的体网格划分,进行光滑化及非结构三面体网格化分。
1.4.4 边界调节设置 利用ANSYS 分析软件进行血流动力学模拟,设置边界条件,如入口、出口及动脉瘤耦合壁等。在Fluent模块中设置载瘤动脉与动脉瘤壁为线弹性材料,密度为1 150 kg/m3;血管壁的弹性模量采用E=1.4e6pa,泊松比u=0.45[4];设置动脉壁厚度为0.46 mm,动脉瘤壁厚度为0.24 mm[5];设置血液密度为1 055 kg/m3,血液粘滞度为0.0035 kg/ms;血液流动情况采用标准的湍流模型,利用经颅多普勒超声拟合得到的入口处的瞬时速度曲线;根据术中确定的破裂点及瘤囊在模型上的标记,设置Simple 压力-速度耦合方式,二阶精度迎风流场动量与湍动能离散格式,取时间步长为0.01 s。设置好所有参数后通过Workbench 和Fluent 模块进行双向流固耦合计算得出动脉瘤囊及破裂点的壁剪切应力(wall shear stress,WSS)、切应力震荡指数(oscillatory shear index,OSI),并得出动态形变结果。
1.5 统计学分析 采用SPSS 22.0软件分析;计数资料采用χ2检验;计量资料采用±s表示,采用t检验;P<0.05为差异有统计学意义。
2 结果
正常情况下,动脉血管呈白色。术中显微镜下观察动脉瘤载瘤动脉及破裂点位置,可见破裂口菲薄,清晰可见血流(图1A)。血流动力学流线图显示,靠近血管中央的流速最快,靠近血管壁的流速减慢;在动脉瘤囊内形成漩涡模式,破裂点处的血流减少、流速明显减慢(图1B)。动脉瘤破裂点WSS[(0.215±0.047)Pa]明显低于动脉瘤囊的WSS[(0.463±0.148)Pa;P<0.001;图1C],但是动脉瘤破裂点OSI(0.035±0.024)与和动脉瘤囊OSI(0.030±0.016)无统计学差异(P>0.05;图1D)。
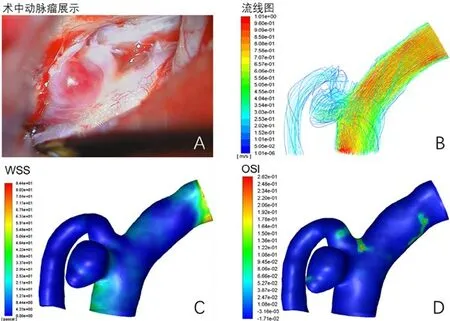
图1 颅内破裂动脉瘤破裂点和瘤囊术中显微镜下观察和血流动力学变化
在一个正常的心动周期当中,随着血流动力学的变化,动脉瘤形态出现规律的变化,载瘤动脉及动脉瘤的形态变化存在明显差异,即动脉瘤两侧壁的形态变化相对较小,动脉瘤破裂点处形态变化明显(图2)。
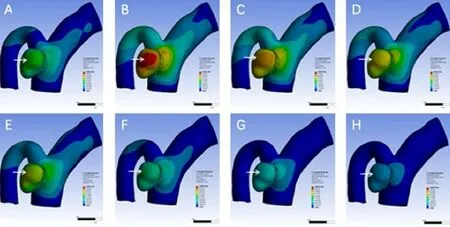
图2 计算流体力学模拟分析一个心动周期的动脉瘤壁的形态变化情况
3 讨论
近年来,动脉瘤血流动力学模拟研究日益成熟,基于病人个体化影像数据建模,进行流固耦合模拟更加接近真实,也已成为颅内动脉瘤血流动力学研究的理想方法,但目前的研究主要集中在破裂动脉瘤与未破裂动脉瘤的区别。本研究考虑到血流、血压等差异,根据病人经颅彩色多普勒超声个体化动态血流动力学特征进行模拟,破裂点的位置是术中确定的,在个体三维重建模型上标记并通过血流动力学模拟分析,结果显示破裂点血流动力学特征与动脉瘤瘤囊不同,破裂点WSS 明显低于动脉瘤囊,提示WSS降低与动脉瘤破裂有关。这与Shojima等[6]研究结果相一致,其研究结果表明大脑中动脉分叉处WSS 较高,破裂动脉瘤顶部WSS 较低,推测WSS降低促进动脉瘤生长和触发动脉瘤破裂,另外破裂点的特点是WSS 低且流速也低。Muthachen 等[7]对颅内动脉瘤壁内膜坏死区域进行显微病理观察,结果表明动脉壁供血不足可引起内膜组织坏死,最终导致动脉瘤破裂。局部较低的血流速度可能导致破裂点WSS 降低,低WSS 可以增加炎性细胞浸润,促进内皮通透性破坏,从而影响血管壁的重塑功能,进而导致动脉瘤破裂[8]。因此,低WSS 在动脉瘤破裂中起着重要作用。
本研究OSI 反应的是血流的震荡水平,即反应血流强度和方向改变,其与WSS 没有确切相关性。有研究结果证实动脉瘤部分区域OSI增高会导致血液流动稳定性下降,导致相应部位血管内皮细胞功能变异,血管完整性破坏导致动脉瘤破裂风险增高[9]。本研究动脉瘤顶端虽然有散在区域呈现高OSI,但未发现其与动脉瘤破裂点存在明确相关性,可能此处的血流动力学存在短暂而轻微的不稳定性,而这种变化未能起到决定性作用。
本研究也存在一定局限性。首先,临床样本量少,结果可能缺乏稳健性。其次,该研究为离体仿真实验,可能因模型的失真或软件本身的计算存在偏差。
总之,颅内动脉瘤破裂点与瘤囊的血流动力学存在差异。相较动脉瘤瘤囊,动脉瘤破裂点的WSS更低,但形变更明显,提示颅内动脉瘤破裂与WSS成负相关,而与形变成正相关,这可为临床预判未破裂动脉瘤破裂风险提供参考。

