基于高通量测序技术分析酵素微生物多样性
曹刚刚,颛孙皖皖,冀利峰,颜萍萍,曾化伟
(1.安徽养生天下生物科技有限公司,安徽 亳州 236831;2.淮北师范大学 生命科学学院,安徽 淮北 235000)
《植物酵素》(Q/BT 5323-2018)中将食用植物酵素定义为:以可用于食品加工的植物为主要原料,添加或不添加辅料,经微生物发酵制得的含有特定生物活性成分可供人类食用的酵素产品.酵素中的活性成分包含多个大类,如酵素中的抗氧化和抗肿瘤成分、维生素和矿物质、氨基酸和肽类、益生菌和益生元等[1].酵素是果蔬植物的发酵制品,中国具有几千年食用发酵食品的传统习惯,比如泡菜、食醋、腐乳等,但“酵素”一词和相关产品主要产生和发展于日本和台湾地区.大陆地区近年来对酵素的研究热度也逐步提高,取得了丰硕的成果.李世燕等[2]研究了不同发酵工艺对毛酸浆酵素抗氧化性的影响,发现同时接种酵母菌和乳酸菌的毛酸浆酵素的DPPH自由基清除能力最高达30.97%,SOD酶活性达到409.52 U/mL.袁周率等[3]以糙米为原材料发酵酵素,研究发现糙米经过发酵后,典型营养成分如维生素B1、B2、γ-氨基丁酸含量增加.王振斌等[4]研究超声波对葛根酵素发酵的影响发现超声辅助发酵有利于酵素中蛋白酶和脂肪酶活性的提高.冯莉等[5]研究了水果酵素对酒精诱导小鼠肝损伤的保护作用及其机制.研究发现水果酵素对酒精诱导的小鼠肝损伤具有保护作用,灌喂水果酵素后的小鼠病理学观察结果显示肝脏脂肪变性得到改善,肝脏细胞排列较为整齐,组织结构趋于正常.众多学者的研究都从不同的角度反映了食用酵素的价值[6].也进一步推进了关于酵素的科学探索,特别是在抗氧化、免疫和抗肿瘤方面.
食用植物酵素的发酵原材多种多样,既包括传统水果、蔬菜,也包含国家卫生健康委员会公布的新食品原料和药食同源的中药植物[7].不同的原料特征差异很大,有的碳水化合物含量高,有的含有比较多的蛋白质,有的富含抗菌物质,还有的原料有机酸含量较高.不同的原料在实际发酵酵素的过程中都会对基质中的微生物进行筛选,不同的酵素在制作过程中实际起发酵作用的微生物可能差别较大,特别是在不外加菌种的自然发酵状态下[8].目前利用高通量测序技术对不同品种食用酵素的微生物群落结构进行系统鉴定并做综合对比分析的研究报道相对较少.
酵素属于发酵食品,酵素产品必须满足食品安全国家标准的相关要求,特别是微生物和致病菌以及污染物限量的要求.不达标的酵素产品可能存在生物和化学性安全风险[9].曹刚刚等[10]通过检测亳菊酵素发酵过程中各种重金属含量,发现酵素溶液中不同重金属的含量变化不同.可惜的是,目前关于酵素的研究多在发酵工艺、酵素成分和保健价值方面,对于生物安全性特别是酵素中微生物群落结构的研究相对匮乏.
为此,本研究选择多种原料,通过测序鉴定不同的酵素微生物的种群情况,分析其微生物指纹图谱.为食用酵素的生物安全性提供可靠依据,同时为不同原料酵素的酿造工艺提供发酵菌种的借鉴.
1 材料与方法
1.1 材料与试剂
1)材料:蛋白酶K(20 mg/mL)、琼脂糖、标准DNA水解液、1.10% SDS、酚/氯仿/异戊醇溶液(1∶1∶1)、异丙醇、70%乙醇均为分析纯,采购于国药集团.酿酒酵母购自安琪公司,巴氏醋酸杆菌G3-2为本实验室自主选育.红砂糖、糙米、青梅采购于超市,虫草、余甘子、乌梅、山楂饮片购于亳州药材大市场.
2)试剂:TE缓冲液(10 mmol/L Tris HCl,0.1 mmol/L EDTA,pH 8.0),CTAB/NaCl溶液(5%,w/v),TAE缓冲液(50×)(pH 8.0),溴酚兰-甘油指示剂,0.5 μg/mL 溴乙啶染液.
3)培养基:酵母菌种子培养基(葡萄糖10 g/L,新鲜马铃薯200 g/L),醋酸菌种子培养基(葡萄糖10 g/L,酵母粉10 g/L,pH 5.5).
1.2 试验方法
1.2.1 酵素样品的发酵制备 取糙米、青梅、虫草、余甘子、乌梅、山楂6种原料,按照以下程序操作:① 预处理:将原料清洗干净后风力吹干.② 厌氧发酵:以质量含量计,将15%的原料、70%的水和10%的红糖置入密闭容器,添加5%酵母菌液(活细胞数≥1×106CFU/mL)后30 ℃密封静置发酵30 d,然后过滤除渣获取发酵液.③ 好氧发酵:向上述发酵液中添加5%醋酸菌液(活细胞数≥1×108CFU/mL),35 ℃摇床培养,隔日取样检测乙醇含量,发酵至乙醇含量低于0.5%,然后过滤得酵素液,密封保存备用.④ 6种不同原料酵素发酵样品进行编号,依次为乌梅(A1)、山楂(A2)、余甘子(A3)、虫草(B4)、糙米(B5)、青梅(B6).
1.2.2 细菌总DNA提取与PCR扩增 参考文献[11]利用碱裂解法提取菌株的总DNA.选择通用引物27F/1492R进行PCR扩增,引物序列为:5’-AGAGTTTGATCCTGGCTCAG-3’(27F);5’-TACCTTGTTACGACTT-3’(1492R).PCR程序采用94 ℃变性1 min,之后61 ℃退火1 min,72 ℃延伸1 min,进行30个循环;循环结束后再72 ℃延伸10 min,保存.
1.2.3 电泳与测序鉴定 采用0.8%的琼脂糖凝胶电泳.电泳结束后,用TaKaRa DNA纯化试剂盒进行PCR扩增产物纯化,将纯化后的目的片段送到华大基因公司测序.
1.2.4 数据分析 测序数据处理及统计分析参照张琪等[12]对沙棘酵素发酵过程中微生物的序列分析试验方法.
2 结果与分析
2.1 样品测序质量分析
6个样品中B6(青梅)样品未能成功提取足量的DNA,推测可能原料酸性过大,随着发酵的进行,由于醋酸菌产酸,样品的pH值会进一步下降,造成发酵后微生物逐渐衰亡.后续不再对B6样品进行分析.
5种样品的Alpha多样性曲线和稀释曲线如图1所示.由图1可见,在此测序深度上,各组样本稀释性曲线趋向于平稳,而等级聚类曲线则逐渐趋于平坦,由此可知,虽然在进一步测序时仍会出现罕见的新型基因型,但大多数物种已经被检测到.因此,本研究的测序深度足以研究绝大多数的微生物,具有很高的可信度.由图1可见B4(虫草)、B5(糙米)样品相对微生物群落结构更为多样,而其他样品微生物多样性较低.为简化分析,后续仅对B4、B5样品的测序鉴定结果进行深入分析.
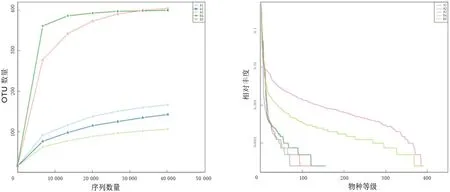
(a) α多样性曲线 (b) 等级丰度曲线
2.2 酵素发酵过程样品中的细菌分布
不同样本微生物在“门”水平上的分布如图2所示.在“门”水平上,厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)是占主要丰度的两个门,其中绝大部分是变形菌门(Proteobacteria).这和汤灿辉等[13]研究沙棘酵素自然发酵过程中的细菌动态变化结果相似,这有可能是因为在无氧的条件下,以乳酸菌(厚壁菌门)为代表的兼性厌氧菌大量繁殖,导致发酵体系酸化并伴随着碳源减少.

图2 不同样本微生物在“门”水平上的分布 图3 不同样本微生物在“属”水平上的分布
在“属”水平的主要微生物群落中(图3)展示相对丰度超过1%的类别,菌群结构较丰富,其中Komagataeibacter(驹形杆菌)是主要的属.对于B4样品,其次是Lactobacillus(乳杆菌)相对丰度较高;而B5样品,其次是Acetobacter(醋杆菌)相对丰度较高.从乳酸菌和醋酸菌的比例来看,乳酸菌较少,代谢活力推测较弱.
B4和B5样品的共有OTU为222个,B5样品特有171个,B4样品166个,如图4所示.继续分别对酵素样品微生物进行种水平的分析.选择丰度前40的OTU进行热图分析,图5显示,B4样品物种更丰富,其中Lactobacillusacetotolerans、Lactococcuslactis、Bradyrhizobiumelkanii、Bacteroidessartorii等物种丰度都比较高;而对于B5样品Acetobactermalorum、Lactobacillusacetotolerans、Lactococcuslactis等物种丰度都比较高.从这几种微生物的发酵性能分析,B5样品中的微生物主体为醋酸菌和乳酸菌,属于醋酸发酵比较典型的发酵类型.而B4样品营养不够全面,含糖较低,优势微生物物种形成的趋势较弱,但总体也呈现醋酸发酵状态.这种现象出现可能是由于在酵素自然发酵的过程中,酵素pH值逐渐下降,醋酸菌和乳酸菌等菌株耐酸性较强,逐渐成为优势菌株.这与高庆超等[14]对黑果枸杞在自然发酵过程中微生物群落动态研究相似.
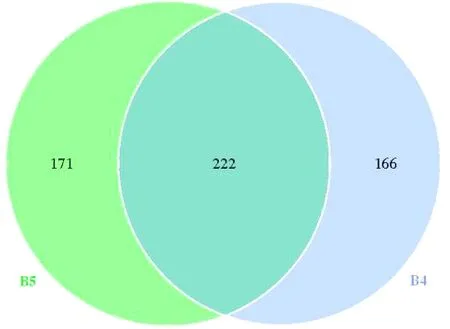
图4 不同样本微生物的共有和特有OTU

B4.虫草酵素;B5.糙米酵素.
2.3 发酵过程样品中真菌分析
先后进行过3次样品DNA提取、富集,并放大了样品规模,但是都没有真菌检出.说明真菌在成品酵素样品中的分布较少或没有分布.发酵初始投入的酵母菌已随着发酵衰亡.
2.4 酵素发酵样品中微生物的分离和鉴定
根据微生物分布信息的结果,采用醋酸菌和乳酸菌筛选培养基,对样品进行了微生物的分离纯化培养,平板涂布分离结果见图6.目前共计获得15株微生物.已进行了菌种鉴定,具体样品及微生物信息见表1.
a.糙米酵素;b.青梅酵素;c.虫草酵素;d.乌梅酵素;e.余甘子酵素;f.山楂酵素.

表1 发酵样品中分离鉴定得到的微生物
3 讨论
本实验发酵制作了6种典型的酵素,在类别上包含了水果、中药和食用真菌.通过提取总DNA并测序鉴定,分析了每种酵素样品的微生物群落结构并分离鉴定了主要菌种.总体而言,酵素中丰度最高的3种细菌为驹形杆菌(Komagataeibacter)、醋杆菌(Acetobactermalorum)和乳杆菌(Lactobacillus).6种酵素采用的是相同的发酵工艺,添加的发酵菌种都是酿酒酵母和巴氏醋酸杆菌.但实际发酵成为酵素后却出现了明显差异.推测原因,一方面原料虽清洗洁净但未经严格杀菌,故原物料会自带部分微生物进入发酵,且不同的原料自带的微生物不同;其次,醋酸发酵阶段是好氧环境,发酵容器未密封,发酵时间又比较长,部分环境微生物在发酵过程中通过空气进入发酵体系;再次,不同的原料性质差异较大,造成不同酵素发酵基质的明显区别.比如青梅的有机酸含量很高,会对部分微生物的生长繁殖产生抑制[15],并在发酵过程中进行筛选;又比如糙米,营养成分更均衡,碳水化合物含量很高[16],发酵时提供了更多的碳源,故糙米酵素中微生物种群密度高且多样.但是不管是哪种酵素,发酵的总体方向都是醋酸发酵,糙米、余甘子和乌梅三种酵素同时伴随有比较强的乳酸发酵.
目前国内酵素行业实际生产的酵素大多产自手工慢发酵.与快速搅拌罐发酵不同,这种传统的发酵受到人为和环境的影响更大,发酵周期更长,产品质量和食品安全也更难把控[17].这也是本实验采用类似模式制作酵素的原因,是为了实际生产制造提供借鉴.通过高通量测序技术对多种酵素的微生物群落结构的分析验证了酵素酿造的微生物多样性.平板培养和鉴定未发现霉菌和常见致病菌如大肠菌群、沙门氏菌、金黄色葡萄球菌等,也在一定程度上说明了规范的传统发酵不会出现常见的微生物安全风险.原因可能源自两方面:一是发酵时添加菌种,数量占优,具有竞争优势;二是发酵产生乙醇和醋酸,发酵基质对多数微生物生长不利.现阶段,多数酵素生产企业多采用工业化菌种或自制菌种,在发酵时添加菌种,并根据产品要求制定发酵工艺规范和标准.部分消费者家庭自制酵素,往往不添加发酵菌种,发酵过程也无法实施监控,无法有效控制产品质量.同时,致病菌、真菌毒素等等也可能产生,从而引发食品安全风险[9].
当下国内酵素行业还处于起步发展阶段,相应的科学研究多针对某些品种酵素的发酵工艺和抗氧化等保健价值[18].本文应用高通量测序技术从微生物群落结构和食品安全的角度,通过对多种原料发酵酵素的微生物种群分析,弥补了现有研究的不足.未来随着酵素产业的发展和酵素产品需求的增加,传统发酵的模式无法满足的情况下,现代快速发酵技术应用势必会越来越多.本文分离鉴定了发酵完成的酵素的主要微生物菌种,也为未来实现纯培养工艺提供菌种方面的参考[19].

