人参皂苷Rb1干预DSS诱导结肠炎模型小鼠转录组高通量测序及分析
董建一 李昶仪 陈大朋 王 亮 王福金 王靖宇 周子娟
(大连医科大学实验动物中心,大连 116044)
Castellano等[1]报道,炎症性肠病(inflammatory bowel disease, IBD)主要包括溃疡性结肠炎(UC)和克罗恩病(DC),不仅影响到胃肠,而且也广泛到影响到其它器官。该病以往多见于西方国家,近年在我国发病率呈显著上升趋势[2]。IBD发病原因尚不明确,可能由宿主遗传、免疫因素、微生物和环境共同引起[3]。因IBD病情具有反复发作、无法根除、治疗费用高等特点,许多病人感觉痛不欲生称其为“绿色癌症”。Fiocchi等[4]和Zhang等[5]研究表明,编码RNA构成了人类转录基因组的大部分,并在疾病状态中发挥着关键作用,被认为是IBD重要治疗靶点。其中,Zheng等[6]报道,极早期炎性肠病(VEO-IBD)应用测序技术揭示可能与潜在原发性免疫缺陷相关。综上所述,结合IBD发病的综合因素,应用高通量测序技术揭示其治疗靶点的解决方案可能为该病的治疗提供新的且有效的机会。
近年来,中草药已被IBD患者广泛作为补充和替代药物使用。其中,人参誉为中国传统药物的“百草之王”被世界广泛应用。作为人参的主要有效成份,目前人参皂苷已分离出40余种,而人参皂苷Rb1(ginsenoside Rb1,Rb1)是其含量最多的一种[7]。人参皂苷Rb1主要来源于人参的茎、根和花芽,因其具有抗炎、抗氧化和神经保护作用而备受关注[8-9],特别是Rb1已被证明在结肠炎中具有抗炎作用[10]。Dong等[11]报道,人参皂苷Rb1通过激活内质网E3泛素连接酶Hrd1信号通路缓解小鼠结肠炎,为Rb1治疗IBD疾病提供了理论支持。
中草药具有多靶点多通路的特点,因此应用高通量转录组测序技术,对人参皂苷Rb1干预的DSS诱导结肠炎模型小鼠的结肠组织通过 RNA样品检测、mRNA富集、双链DNA合成、末端修复和加A接头、片段选择和PCR扩增构建cDNA文库,然后进行Illumina测序,为进一步在分子层面阐述Rb1干预后DSS诱导结肠炎模型小鼠的作用机制,利用生物信息学进行信息对比,分析Rb1干预后差异性基因分析、GO功能富集以及KEGG 通路情况,探究人参皂苷Rb1在IBD中更多的生物学功能,以期为揭示人参皂苷Rb1干预DSS诱导结肠炎模型小鼠机理提供理论基础。
1 材料和方法
1.1 材料
1.1.1实验动物:SPF级雄性C57BL/6小鼠 6~8周龄,15只,体质量18~22 g,购自辽宁长生生物技术股份有限公司,实验动物生产许可证号: SCXK(辽)2015-0001。实验动物饲喂养于大连医科大学实验动物中心,实验单位使用许可证号:SYXK(辽)2018-0007。动物房室内温度:19~23 ℃,相对温度:40%~70%。实验通过大连医科大学伦理委员会审批,审批号:AEE20046。
1.1.2实验动物分组:15只小鼠随机分为正常组(对照组)、模型组(结肠炎模型组)及Rb1组(人参皂苷Rb1干预组),每组5只。正常组,正常饮水;模型组,每天给予含有4%(m/v)DSS饮水,连续饮用7 d,建立结肠炎小鼠动物模型;Rb1组饮用含4%(m/v)DSS水的第2天开始每天采用灌胃方法给予1 mL/只(40 mg/kg)人参皂苷Rb1的水溶液,连续7 d。第9天处死小鼠,取结肠和肠内容物。
1.1.3主要试剂:人参皂苷Rb1(HPLC≥98%)购自成都曼思特生物科技有限公司;硫酸葡聚糖钠(DSS)购自大连美仑生物技术有限公司;粪便DNA提取试剂盒,购自INVIKET;苏木素-伊红(HE染色液)购自上海金穗生物科技有限公司。
1.2 方法
1.2.1DSS诱导结肠炎小鼠模型的指标评估:实验第1天起,每天观察并记录小鼠的体质量、采食量、精神状态、粪便状况等基本信息,并根据表1进行疾病活动指数评分(DAI评分)。第9天小鼠应用安乐术处死小鼠,取小鼠全结肠并拍照,记录结肠长度及肉眼观察结肠炎症损伤状况。
1.2.2DSS诱导结肠炎小鼠模型的病理组织观察:取出结肠段后用PBS清洗肠内容物,取小鼠远端结肠组织(约1 cm)置于4%甲醛溶液中固定,然后进行石蜡包埋及切片,最后进行结肠组织HE染色分析其病理情况。
1.2.3RNA提取及文库建立:采用TRIzol(Ambion)法提取结肠组织总RNA,然后进行质控分析。分别用琼脂糖凝胶电泳检测样本是否存在DNA污染,NanoPhotometer和Agilent 2100进行纯度和完整性分析。通过Oligo(dT)磁珠富集mRNA,然后加入限制性内切酶缓冲液随机打断mRNA,以mRNA为模板通过逆转录合成cDNA第一链,以dNTPs为原料合成第二链。纯化后的双链cDNA经末端修复及加A尾并连接测序接头,筛选200 bp cDNA后,进行PCR扩增和纯化构建测序文库。
1.2.4转录组测序及数据分析:文库构建后,使用Qubit2.0进行初步定量,使用 Agilent 2100对插入片段大小检测,应用qRT-PCR对文库有效浓度准确定量,保证文库质量。将不同文库按照有效浓度及目标数据(正常组、模型组、Rb1组)需要混合后进行Illumina高通量测序。测得图像数据经CASAVA碱基识别化为序列数据(reads)。对原始数据(raw data)进行质控,通经过原始数据过滤去除低质量测序数据、接头序列及rRNA序列获得分析使用的数据(clean reads)。
1.2.5GO功能富集和KEGG通路富集分析:采用clusterProfiler软件对差异基因进行GO功能富集及KEGG通路富集分析。富集分析结果是每个差异比较组合的所有差异基因集;上调差异基因集;下调差异基因集进行富集。GO功能富集,差异表达基因对比Gene Ontology数据库,分别从分子功能、生物过程和细胞组成三部分进行分析,P<0.05为显著富集。KEGG(Kyoto Encyclopedia of Genes and Genomes)通过对KEGG通路编号对应的功能描述预测参与的代谢途径。以P<0.05为显著富集,筛选差异表达基因中显著富集的代谢途径。
1.3 统计方法

2 结果
2.1 DSS诱导结肠炎小鼠模型各项评估指标
三组小鼠状态:正常组小鼠状态良好,体质量无明显变化;模型组小鼠反应不灵活精神状态欠活跃;模型组和Rb1组小鼠在4%(m/v)DSS诱导的第3天出现便血、腹泻等现象,体质量变化如图1 A所示:实验第3天,模型组与正常组小鼠相比,体质量明显减轻(P=0.0006<0.01,t=5.53),第7天体质量下降最为显著(P<0.0001,t=10.68)。Rb1组小鼠的体质量第3天明显低于正常组(P<0.0001,t=7.33),第6天与模型组相比体质量明显回升(P=0.0029<0.01,t=4.22)。DAI评分如图1B所示:实验第3天以正常组为参照,其它两组DAI评分均进行性增高,模型组(P<0.0001,t=16.65),Rb1组(P<0.0001,t=14.14)。实验第6天,Rb1组与模型组相比,DAI评分显著降低(P=0.0035,t=4.08)。结肠外观变化如图1C所示:肉眼观察小鼠结肠组织,正常组小鼠的结肠组织管壁比较光滑具有弹性,而模型组和Rb1组的小鼠结肠组织均有不同呈度的红肿现象,而且模型组小鼠肠黏膜糜烂并且肠腔伴有血便。结肠长度量化指标如图1D所示:与正常组相比,模型组结肠长度显著缩短(P<0.0001,t=7.34),与模型组相比,Rb1组结肠长度缩短程度显著得到了抑制(P=0.008<0.01,t=3.50)。以上结果说明,人参皂苷Rb1能够缓解DSS诱导的结肠炎小鼠模型的症状。

图1 DSS诱导结肠炎小鼠模型各项评估指标
2.2 DSS诱导小鼠结肠炎模型组织病理学检测
为进一步证明Rb1能够缓解DSS诱导小鼠结肠炎模型症状,分别将正常组、模型组和Rb1组小鼠的结肠组织做成切片,用HE染色进行组织病学检测,结果如图2所示:光镜下,正常组未见炎症浸润的细胞,且组织结构完好;模型组肠黏膜层可见大量的以中性粒细胞为主的炎症细胞浸润,且组织结构破坏严重;Rb1组肠黏膜可见点状侵蚀,但黏膜下层炎症细胞浸润较轻。

图2 小鼠结肠组织HE染色
2.3 转录组测序分析
2.3.1测序数据质量分析:通过Illumina高通量测序平台对正常组、模型组及Rb1组小鼠结肠样本进行转录组测序,获得原始数据中(raw reads)和原始数据过滤后的序列数据(clean reads)。数据质量分析如表1所示:各组样本的clean bases均在7 G以上,碱基质量超过Q20(Phred=-10log10(e)数值大于20的碱基占总碱基的百分比)和Q30(Phred=-10log10(e)数值大于30的碱基占总碱基的百分比)的比例均在92%以上,各样本的GC含量(clean reads 中G与C占4种碱基的百分比)均在50%左右。以上数据说明测序组装效果理想,符合后续分析要求。
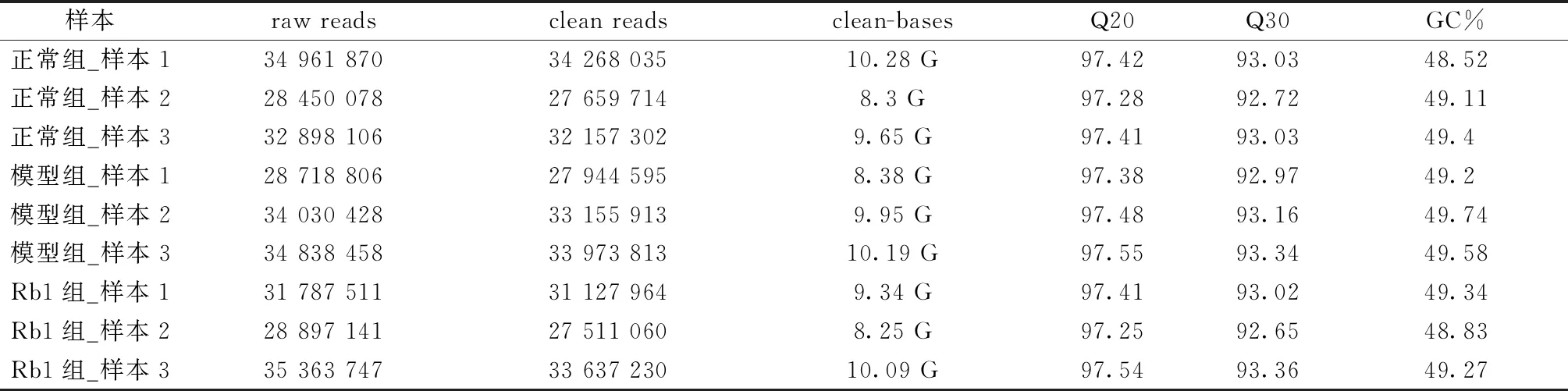
表1 转录组测序数据质量分析
2.3.2基因表达相关性分析:样品间基因表达水平相关性是检验实验可靠性和样本选择是否合理的重要指标。因此,为确保后续差异基因分析得到可靠结果,根据FPKM值,计算组内及组间样本的相关性系数,样相系数越接近于1,表明样品之间表达模式的相似度越高。如图3所示,基因表达相关性分析热图及R语言进行皮尔逊相关系数的计算(R2)得出,正常组、模型组及Rb1组,样品的R2均大于0.90,说明样本间表达模式相似度高,选用的样本合理实验具有可靠性。

图3 基因表达相关性分析
2.3.3差异表达基因分析:正常组、模型组及Rb1组三组之间差异基因的重叠情况如图4A所示,Rb1组和模型组共有差异性基因785个,模型组和正常组差异性基因450个,三组之间重叠差异基因384个。差异显著性基因的整体分布情况,Rb1组和模型组对比,共筛选出差异性基因1 169个,其中基因表达上调为1 008个,表达下调为161个。结果如图4B所示:火山图(Volcano Plot)显示,利用t检验分析出Rb1组和模型组之间显著差异表达的基因后,以log2(Fold Change)为横坐标,表示基因在不同样中的表达倍数变化(log2Fold Change);以t检验显著性检测P值的负对数-log10(padj)为纵坐标,表示表达差异显著性水平。图中每个点代表一个特定基因,其中上调基因用红色点表示,下调基因用绿色点表示,蓝色为表达无变化的基因。
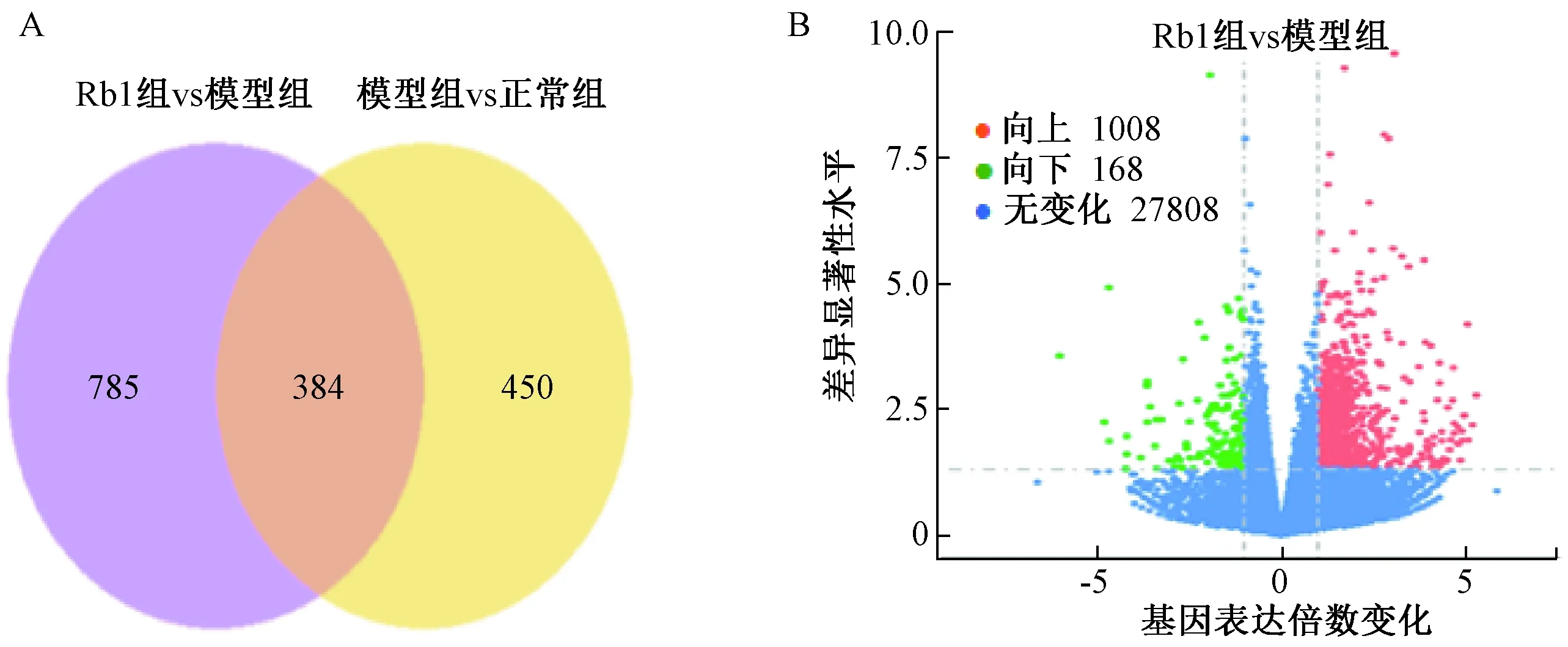
图4 差异基因韦恩图和火山图分析
2.3.4差异表达基因GO富集和KEGG分析
对Rb1干预前后结肠炎模型小鼠结肠组织差异基因进行GO显著性富集分析,结果如表1所示,共有10 450个差异表达基因得到GO注释。其中,MF(1 411)占总差异基因的13.50%、BP(7 182)占总差异基因的68.73%以及CC(1 857)占总差异基因的17.77%。为进一步分析Rb1转录组的unigenes功能,进行了KEGG通路富集分析,对基因组、化学和系统功能信息的综合性数据进行了整合。
结果如表2和图5所示,从KEEG富集结果中选取最显著的20个通路绘制成散点图,对转录组信息进行分析得出:30个基因与神经活动配体-受体相互作用通路(Neuroactive ligand-receptor interaction)有关,23个基因与钙离子信号通路有关以及21个基因与cAMP信号通路有关。
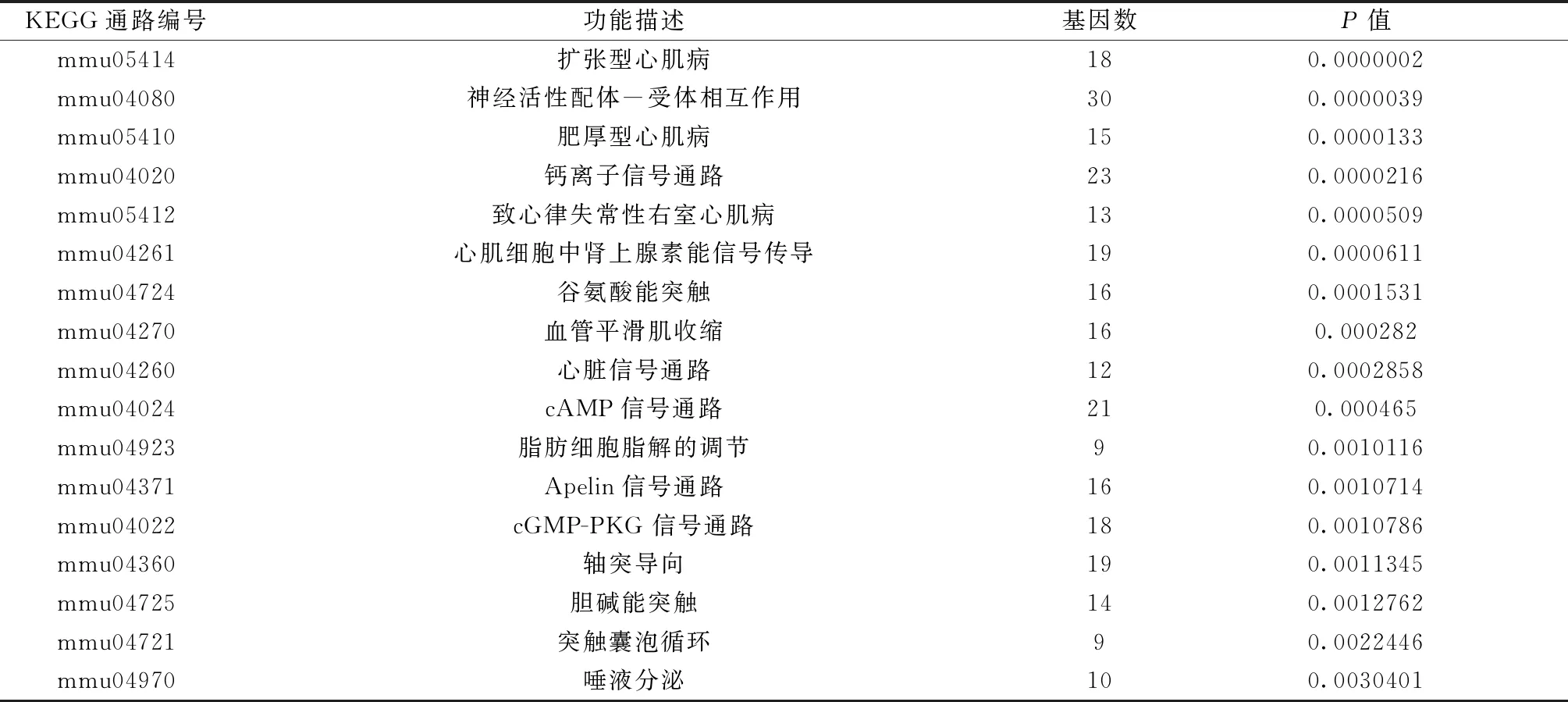
表2 差异表达基因KEGG功能分类

图5 KEGG 通路富集最显著前20个通路气泡图
3 讨论
人参皂苷Rb1能够缓解4%(m/v)DSS诱导结肠炎模型小鼠的症状。人参皂苷Rb1干预后显著抑制了IBD模型小鼠的体质量下降、DAI评分降低、结肠长度缩短以及较轻的黏膜下层炎症细胞浸润。以上研究结果说明:4%(m/v)DSS诱导IBD小鼠模型成功,并且人参皂苷Rb1对该小鼠模型具有保护作用,为高通量测序提供理想的检测样本。
本研究通过构建正常组小鼠、DSS诱导炎肠病模型小鼠及Rb1干预DSS诱导IBD模型小鼠的转录组文库,获得转录组测序分析使用数据clean reads。测序数据质量分析显示,各组Q20和Q30比例均高于92%,GC含量均在50%左右,以上结果表明测序数据完整性好,符合后续分析的要求。为检验实验可靠性以及样本选否合理,对样品间基因表达相关水平进行检测,皮尔逊相关系数的计算(R2)结果显示,三组样相关系数均大于0.9,说明了样本之间表达模式相似度高,选用的样本合理具有可靠性。
为了挖掘Rb1干预后DSS诱导IBD模型小鼠相关的目的基因,将正常组、模型组及Rb1组的基因进行重叠生物学信息分析,以及对Rb1组和模型组的上调基因和下调基因分析,这更好的挖掘到Rb1干预后的基因功能。
GO数据库对Rb1干预前后IBD模型小鼠结肠组织差异基因进行GO富集分析,共找出10 450个差异表达原基因,其中MF有1 411个基因占13.50%,CC有1 857个基因占17.77%,BP有7 128个基因占68.73%。KEGG富集结果中,选取最显著的20个通路进行分析得出,与Rb1干预后密切相关的通路为钙离子信号通路、神经活动配体-受体相互作用通路以及cAMP信号通路,以上结果更有利于明确差异表达基因在生物代谢中发挥的功能以及与其他基因的相互作用。

