Caveolin-1在肝纤维化中作用的研究*
张 洁 杨子衡 王 燕 孙 泉,
(1.首都医科大学实验动物部,北京 100069)(2.首都医科大学基础医学院实验动物学系,北京 100069)(3.首都医科大学宣武医院神经内科,北京 100053)
肝纤维化是机体对肝炎病毒、酒精、药物等致病因素所致慢性肝脏损伤后的一种修复反应,是各种慢性肝病发展为肝硬化的必经病理过程[1]。随着肝纤维化具有可逆性被证实,通过抗纤维化疗法来减轻肝纤维化程度,延缓早期肝硬化变得尤为重要[2]。
小窝蛋白-1(Caveolin-1)是一种整合膜蛋白,其在组织修复和纤维化中的重要性逐渐被证实。Tourkina等[3]研究显示,Caveolin-1在抑制纤维增生和组织重塑过程中发挥重要作用。在放射诱导的肺纤维化大鼠和小型猪中,诱导纤维化前在肺上皮细胞中观察到Caveolin-1表达下调。Wang等[4]证实,在博来霉素诱导的肺纤维化中,Caveolin-1表达水平也明显下调,而且Caveolin-1敲除小鼠出现明显肺纤维化。
Lu等[5]研究前期发现,肝纤维化模型小鼠肝组织中,Caveolin-1表达水平显著下调。因此,推测Caveolin-1可能与肝纤维化的形成有关,但其在肝纤维化中发挥何种作用仍不清楚。本实验拟通过建立10%四氯化碳(CCl4)橄榄油溶液诱导的野生型小鼠及Caveolin-1敲除小鼠肝纤维化模型,比较分析肝脏炎性损伤及肝脏胶原指标的差异,初步探讨Caveolin-1在肝纤维化中的作用。
1 材料和方法
1.1 实验动物
Caveolin-1敲除小鼠,购自美国The Jackson Laboratory,雌雄各2只,首都医科大学实验动物部隔离饲养,取哨兵鼠检测合格后,移至屏障环境内,体成熟后按近交系原则,1∶1配种扩繁至F2代。
SPF级C57BL/6雌鼠和129雄鼠各5只,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2021-0006,首都医科大学实验动物部屏障环境内饲养,体成熟后1∶1杂交配种,繁殖至F2代。
饲养间室温22~24 ℃,相对湿度40%~60%,保持光照和避光12 h/12 h,饲喂小鼠专用繁殖饲料,自由饮食饮水。
1.2 实验试剂
四氯化碳(CCl4)及化学纯橄榄油,购自国药集团化学试剂有限公司;α平滑肌肌动蛋白(α-SMA)一抗、Ⅰ型胶原(collagen-Ⅰ)一抗及Ⅲ型胶原(collagen-Ⅲ)一抗,购自Cell signaling technology;β-actin、TRIzol、RNA溶解液、Real-time PCR试剂盒及蛋白marker,购自北京全式金生物技术有限公司;DAB显色试剂盒,购自北京中杉金桥生物技术有限公司;PVDF膜,购自Millipore;引物由生工生物工程(上海)股份有限公司合成。
1.3 实验仪器
-80 ℃超低温冰箱,购自SANYO;普通荧光显微镜,购自奥林巴斯(深圳)工业有限公司;全自动多功能酶标仪,购自赛默飞世尔科技公司;凝胶成像分析仪,购自UVP;PCR仪及实时荧光定量PCR仪,购自Eppendorf;恒温摇床,购自New Brunswich Scientific;电泳仪,购自上海天能科技有限公司等。
1.4 实验方法
1.4.1动物分组及造模:实验通过首都医科大学福利伦理审查,动物实验伦理号:AEEI-2016-150。取体质量20~22 g,雄性,Caveolin-1敲除小鼠和C57BL/6与129只F2代小鼠,分别作为敲除组和野生组,用10% CCl4橄榄油溶液(CCl4∶橄榄油体积比=1∶9),1 μL/g,2次/周,腹腔注射。每组另各取5只小鼠,腹腔注射同等剂量的橄榄油,做0 d对照。
1.4.2样品采集与处理:每组动物分别于给药后1、3、7、14和28 d各取出5只(提前禁食8 h),心脏取血后,3 000 r/min离心15 min,分离血清,全自动生化分析仪检测血清谷丙转氨酶(ALT)和谷草转氨酶(AST)的含量。
对小鼠进行断颈处死后,打开腹腔,取出肝脏,去除胆囊,用PBS冲洗肝脏,摘取肝左叶,用4%多聚甲醛固定,经脱水、浸蜡、包埋、切片等步骤制成石蜡切片。每只小鼠制备两个包块,制成5~8张切片,分别进行苏木素-伊红(HE)染色,在普通显微镜100倍镜下,随机选取三个视野采集照片。采用Image-ProPlus彩色图像分析软件对炎症反应病灶区域进行图像分析,计算变性坏死细胞占整个视野的面积比及计算胶原纤维面积占整个视野的百分比,分别进行肝脏炎性损伤及纤维化程度分析。
剪取小块肝右叶组织,提取总RNA,进行RNA反转录及Real-time PCR,引物序列见表1:
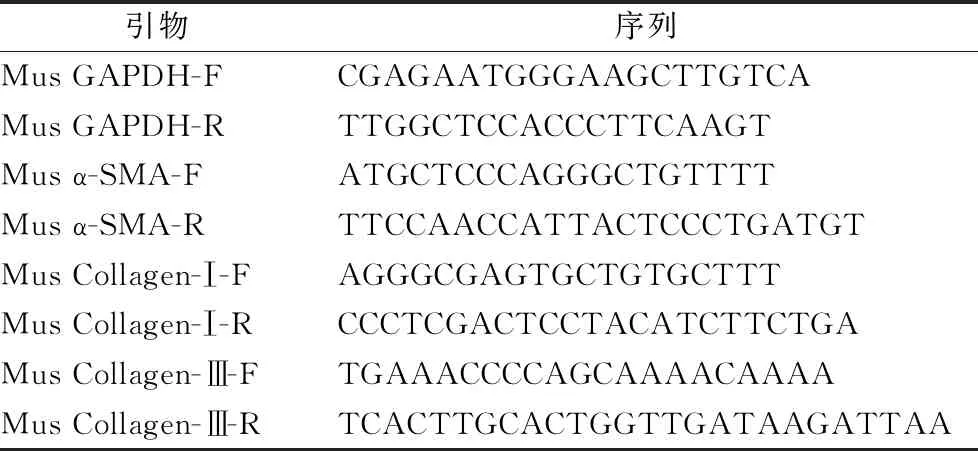
表1 引物序列表
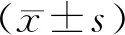
1.5 数据处理和统计学检验
采用SPSS17.0统计软件对实验结果进行分析,两组间比较采用t检验,P<0.05为差异显著,P<0.01为差异极显著,P>0.05为无统计学差异。采用GraphPad Prism作图。
2 结果
2.1 血清中ALT和AST含量检测
将相同组别的不同时间点分别与0 d比较,ALT含量均显著升高(P<0.01),提示注射CCl4橄榄油溶液1 d后,肝细胞即出现明显损伤。相同时间点,将两组对比后发现,0 d时,两组无显著性差异。给药后1 d,血清ALT含量迅速达到最高值,后降低,趋于平缓。1 d、3 d和7 d时,敲除组小鼠血清ALT含量明显高于野生组,其中3 d时差异极显著(P<0.01),而14 d和28 d时,敲除组小鼠血清的ALT含量低于野生组,其中14 d时差异显著(P<0.05),其它时间均无统计学差异(见表2)。

表2 小鼠血清ALT含量(U/L)
同一时间点的两组数据相比,1 d、3 d、7 d和28 d时,敲除组小鼠血清中AST含量明显高于野生组,尤以3 d时,差异极显著(P<0.01);14 d时,敲除组小鼠血清中AST含量略低于野生组,但无统计学差异(见表3)。

表3 小鼠血清AST含量(U/L)
2.2 HE染色结果
显微镜下观察肝脏组织HE染色,正常小鼠(0 d)时肝组织形态正常,肝细胞以中央静脉为中心,大致排列成板状,均匀、整齐并成放射状向外发散,肝细胞体积较大、胞浆丰富、边缘明显及细胞核位于中心且大致呈圆形。肝细胞无变性、坏死、炎性细胞浸润等病理性变化(见图1)。
造模后3 d时,中央静脉及汇管区均可见明显的淡染区,区域内无细胞结构,炎性细胞浸润明显,肝索和肝小叶结构消失。上述区域,敲除组较野生组坏死明显。7 d时,肝小叶结构仍紊乱、肝细胞明显变大肿胀、细胞核浓缩、小部分细胞破裂和失去正常细胞结构。中央静脉淤血并扩张,并伴随炎性细胞浸润。14 d时,中央静脉周围仍可见散在坏死区域,偶见少量淋巴细胞浸润。
肝纤维化是一个动态的病理变化过程。野生组与敲除组小鼠均具有相同的进行性变化,但在相同时间段,敲除组小鼠肝组织中炎性细胞的浸润更多,细胞变性、坏死的速度更快,坏死和纤维化面积更大(见图1)。
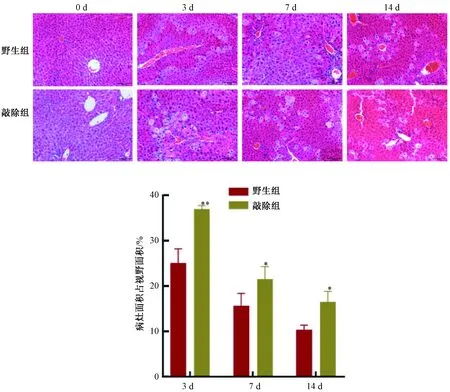
图1 小鼠肝组织HE染色及病灶面积占总视野的百分比
通过采用Image-Pro Plus彩色图像分析软件,对视野内的病灶面积进行分析;3 d时,敲除组小鼠肝组织的病灶面积明显大于野生组,差异极显著(P<0.01);7 d和14 d时,差异显著(P<0.05)。
2.3 天狼腥红染色结果
视野内明显的红染部分为胶原纤维,正常小鼠肝组织可见中央静脉及汇管区有少量胶原纤维。造模后,胶原纤维的分布明显增多,并沿着血管向周围散发;7 d时,渗入肝内实质,并逐渐向四周扩散;14 d和28 d时,胶原纤维分布逐渐汇集,最终连成线状或环状的纤维间隔。野生组和敲除组小鼠均呈现相同的变化趋势。同一时间点,与野生组相比,敲除组肝胶原纤维形成的范围更大,发展的速度更快(见图2)。
0 d时,两组肝组织的胶原含量无明显差异。随着造模时间的增加,肝纤维化不断加重,胶原纤维面积占总视野的百分比逐渐增加,后期增加迅速。与野生组小鼠相比,7 d、14 d和28 d,敲除组小鼠肝组织中胶原纤维占视野面积比明显升高,差异极显著(P<0.01),见图2。
图2 小鼠肝组织天狼猩红染色及胶原纤维面积占总视野的百分比
2.4 Real-time PCR结果
以0 d为参照,3 d和14 d时,敲除组小鼠肝组织中α-SMA mRNA的表达量均高于野生组,差异显著(P<0.05)。3 d时,敲除组collagen-ⅠmRNA的表达量低于野生组,但不具有统计学差异。14 d时,敲除组collagen-ⅠmRNA的表达量明显高于野生组,差异极显著(P<0.01)。3 d时,敲除组collagen-Ⅲ mRNA的表达量高于野生组,但差异不显著。14 d时,敲除组collagen-Ⅲ mRNA的表达量高于野生组,差异极显著(P<0.01),见图3。
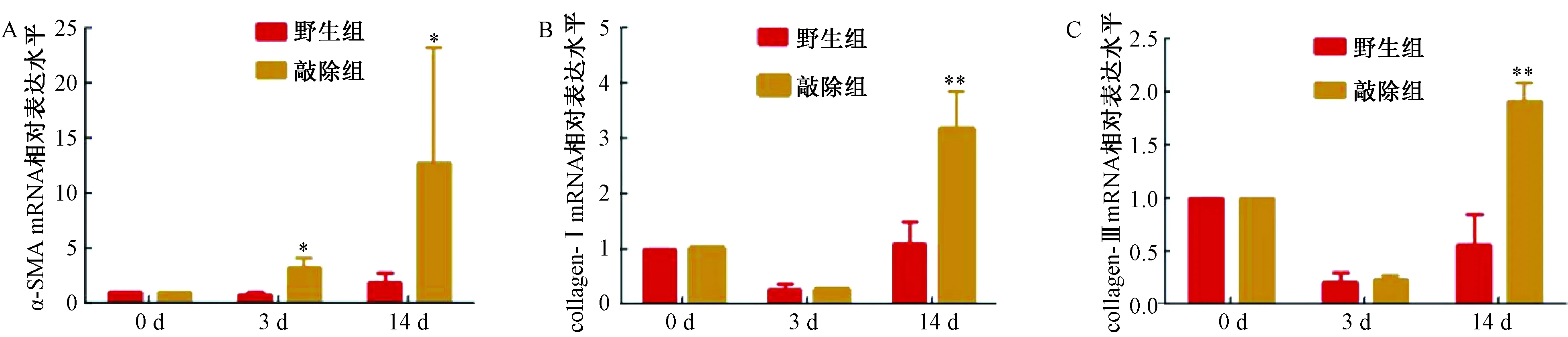
图3 Real-time PCR结果
2.5 Western blot结果
以β-actin为内参,各组与β-actin的比值为相对表达结果。14 d时,敲除组小鼠肝组织中α-SMA、collagen-Ⅰ和collagen-Ⅲ蛋白表达量均高于野生组,显色结果加深明显,差异显著(P<0.05),见图4。
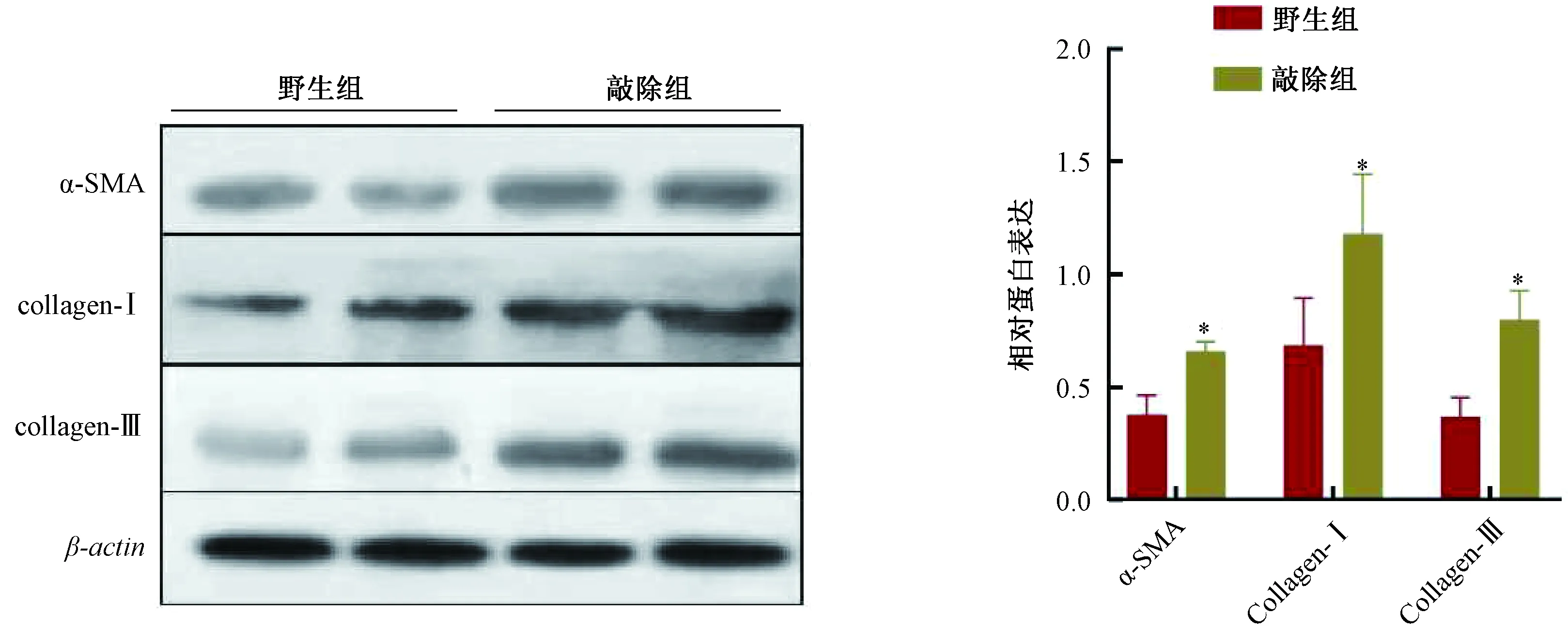
图4 肝组织α-SMA、collagen-Ⅰ和collagen-Ⅲ蛋白表达
3 讨论
吴兰婷等[6]报道,肝纤维化是指在肝脏受到各种损伤后,肝细胞发生反复而持续的炎症或坏死,大量纤维组织异常增生的同时伴随着纤维降解的相对不足,进而使细胞外基质增生与降解的失调与失衡,表现为肝内结缔组织的异常增生与过量沉积。肝纤维化也是慢性肝脏疾病重要的病理特征之一。如果不在疾病早期及时采取治疗措施,将会进一步恶化至肝硬化,甚至肝癌。肝纤维化的发展恶化已经引起了全社会的广泛关注,积极防治肝病,有效控制肝纤维化及肝硬化成为了急需解决的问题[7]。随着国内外临床研究的开展,在肝纤维化早期及时的采取治疗措施,纤维化是具有可逆性的[8],而肝硬化则不能[9],因而通过抗纤维化疗法来减轻肝纤维化程度,延缓早期肝硬化,延长寿命变得尤为重要[10]。
研究发现,Caveolin-1在多器官纤维化过程中发挥调控作用。Wang等[4]发现,Caveolin-1通过负调控应激活化蛋白激酶信号通路,可抑制TGF-β1诱导的肺成纤维细胞胶原分泌。Tourkina等[3]证实,通过敲减Caveolin-1表达,可以增强肺成纤维细胞丝裂原活化蛋白激酶(MEK)/细胞外调节蛋白激酶(ERK)通路的活化,促进胶原合成。干扰Caveolin-1表达可导致腹膜纤维化及MEK/ERK通路过度活化,而过表达Caveolin-1可使腹膜上皮细胞恢复至正常状态[11]。在肝脏疾病方面,研究显示,在非酒精性脂肪肝炎[12]、肝硬化、肝再生组织中[13]及原发性肝癌组织中[14],Caveolin-1表达上升,明显高于正常肝脏,但对于该蛋白是否参与调控肝纤维化的形成,目前国内外研究并不多见。
炎症反应是肝纤维化形成和发展的必经过程,Caveolin-1在减缓炎症的发生发展中发挥重要作用。王华等[15]研究发现,上调大鼠肺组织Caveolin-1表达,能有效抑制Toll样受体4(TLR4)/核因子-κB(NF-κB)信号通路,减少肿瘤坏死因子-α(TNF-α)等炎症因子释放,减轻肺部炎症水肿,从而保护机械通气相关肺损伤。Gao等[16]证实,Caveolin-1通过抑制表皮生长因子受体(EGFR)/转录因子(STAT3)/一氧化氮合酶(iNOS)信号通路活化,减缓肝损伤。Deng等[17]发现,Caveolin-1缺失加剧刀豆蛋白A(ConA)诱导的肝细胞死亡和过度氮应激反应引起的铁死亡,而上调肝脏Caveolin-1表达则抑制ConA诱导的铁中毒和硝化应激。通过10%CCl4橄榄油溶液诱导小鼠肝纤维化模型,对肝脏组织病理及血清肝功指标的检测,对比野生型小鼠和Caveolin-1敲除小鼠纤维化的多项指标。实验中,小鼠纤维化的发展规律,模型制备初期,药物经血液运送至肝脏,发生炎症反应,且反应强烈,细胞损伤发生,纤维化初步形成。ALT和AST是肝细胞损伤的诊断指标和辅助检测指标,敲除组小鼠的两项指标均显著高于野生组小鼠,表明Caveolin-1缺失,肝细胞损伤程度加重,推测该蛋白的表达与肝脏炎症反应有关,此结论在肝组织HE染色结果中得到了验证。随着病情的发展,肝细胞不断修复及再生,炎性反应趋于平缓,随着肝星状细胞的不断活化,促使胶原分泌,通过7、14和28 d肝组织的天狼腥红染色可以明显的观察到胶原不断增多,纤维化不断形成,敲除组小鼠的发展速度要明显快于野生组。α-SMA、collagen-Ⅰ和collagen-Ⅲ的表达同样显示,敲除组小鼠要显著高于野生组。与Tourkina等[3]在肺纤维化及Gao等[4]在酒精性肝损伤的研究相似,本研究结果表明Caveolin-1敲除小鼠肝脏炎性损伤更重,肝纤维化程度更高。因此,Caveolin-1是纤维化的重要抑制因子,其机制可能与抑制炎症反应相关。
细胞外基质的降解和重塑是慢性肝脏疾病进展中的重要病理生理现象。根据Roeb[18]及Duarte等[19]的研究发现,基质金属蛋白酶(matrix metalloproteinases, MMPs)不仅影响细胞外基质的降解和重塑,还可通过多种机制参与肝脏炎症及免疫反应的调控。Miyasato等[20]发现在心肌纤维化模型中,Caveolin-1敲除小鼠的胶原沉积进一步增强,并伴有MMP8和MMP13表达水平的显著减少。注射Caveolin-1脚手架区多肽CSD的Caveolin-1敲除小鼠胶原沉积减少了4倍,而接受CSD治疗的野生小鼠胶原沉积减少了2倍。因此,推测Caveolin-1可能通过上调MMPs的表达发挥抗肝纤维化的作用。在目前尚无有效方法根治肝纤维化的情况下,进一步阐明Caveolin-1调控肝纤维化的相关机制,开发针对Caveolin-1的治疗方法对改善甚至逆转肝纤维化和肝硬化具有潜在的应用价值[21]。

