小鼠电激怒实验中应用研制的智能化电刺激系统提高成模率的探索*
王秋静 鲁金凤 于小亚 李天舒 宋祥福 安 钢
(1.吉林大学基础医学院,长春 130021)(2.吉林市食品药品检验所,吉林 132000)(3.吉林大学公共卫生学院,长春 130021)(4.吉林省科技创新平台管理中心,吉林 130012)
电刺激是生理及药理最常用的实验方法之一,在实验中会经常使用到电刺激器。在药物研究的实验中,常用电刺激方法激怒实验动物产生激怒反应,以观察药物的作用效果,其中动物模型的制备是实验的基础[1]。然而,刺激器功能的强弱、方波设定范围的宽窄及波形的好坏往往成为实验成败的关键。乔少林等[2]报道,“氯丙嗪对小鼠激怒反应的拮抗作用实验”是药理学实验有关中枢系统药物抑制效应的经典验证性实验,以往使用的电刺激器由于输出的电压过低,无法完全达到小鼠激怒模型复制的预期效果,几乎观察不到典型的鼠间对峙等现象,制备小鼠激怒反应模型的成功率低,导致实验动物使用量较大,违背了实验动物福利的“3R”原则,也影响实验教学效果。另外,设备的改造和研发也是促进实验教学改革的有效措施[3]。为提高实验教学效果,符合实验动物福利基本要求,进行电刺激系统设备的研制和应用。本研究根据梁青等[4]采用STM32F103单片机为控制中心,利用计算机系统与单片机之间的RS232通讯,通过PC设置电刺激波形、频率、脉宽及强度控制电刺激器工作,成功达成“小鼠激怒模型”制备的预期效果,实现在新医科背景下医工结合,为电刺激器的设计提供了一个新的参考方向。
1 电刺激系统设计特点
电刺激系统分为硬件设计和软件设计两大部分。硬件设计包括5个部分:中央控制器、键盘输入电路、微机接口电路、高压控制和输出电路以及鼠笼电极装置。软件设计包括两部分:STM32F103单片机控制电路程序和计算机系统输入用户参数图形界面程序。其中STM32F103单片机控制电路程序用C语言编写,计算机系统输入用户参数图形界面程序用VB编程来实现[5-6]。
STM32F103单片机控制电路程序主要由主控程序、串口通信程序、定时器的PWM程序及输入输出程序共4个部分组成。在主控程序中,见图1所示,程序开始先对串口通信口、输入输出口和定时器进行初始化,然后执行键盘输入程序,循环程序等待键盘的按键,根据按键判断输入所需要的功能,通过多路分支程序再转到执行不同的功能程序。
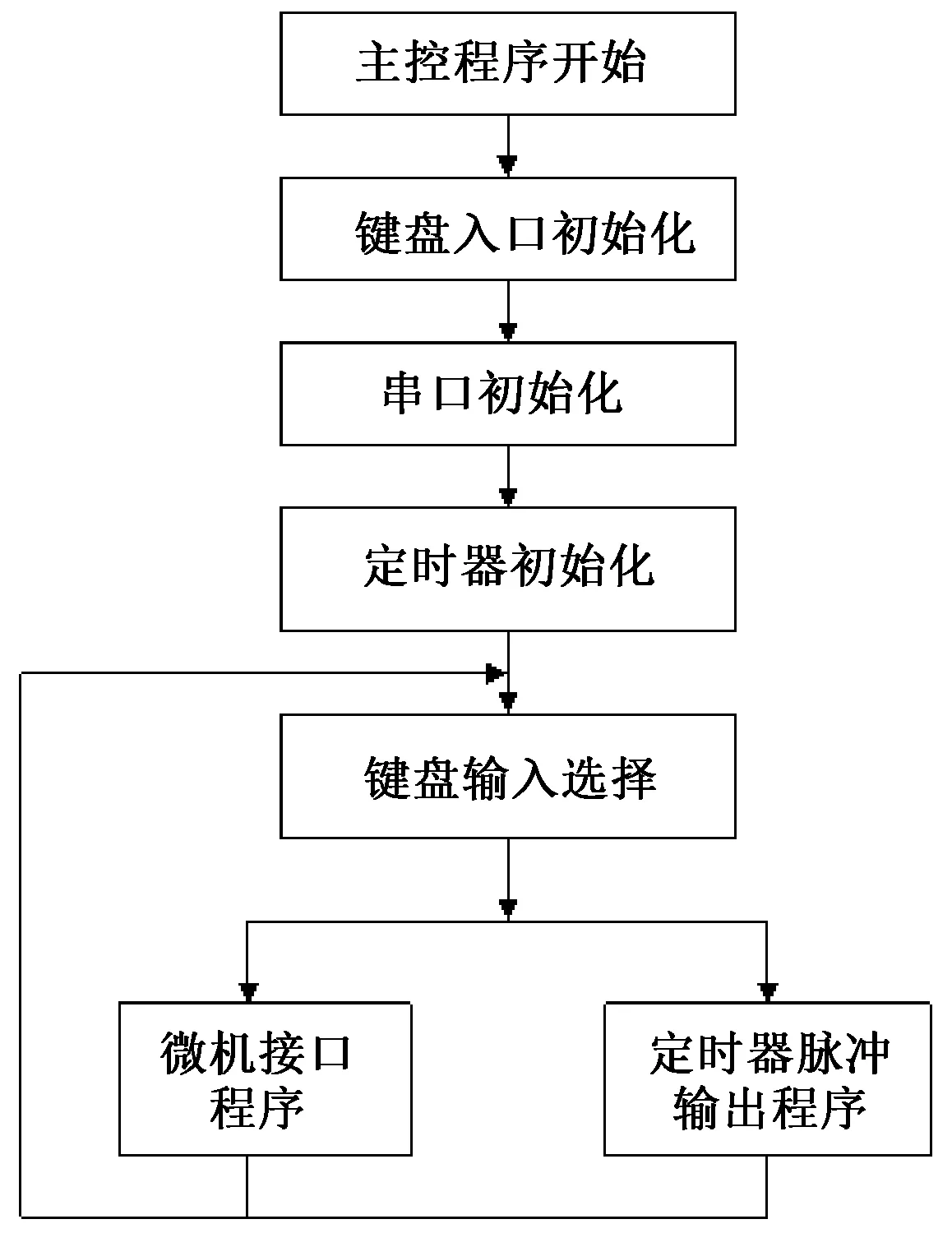
图1 主控程序的流程图
2 电刺激器操作系统功能
研制的电刺激器操作系统由计算机窗口界面输入用户的控制参数,通过计算机系统与STM32F103单片机之间的RS232通讯,将用户输入的控制参数传入单片机中,控制高压输出电路输出用户所需高压脉冲到鼠笼电极装置,以此激怒小鼠。其主要功能:(1)应用STM32F103单片机接口控制电路,控制电刺激器的输出以实现计算机对电刺激器刺激频率、脉宽、电压及电流强度控制的智能化;(2)具有高电压输出(1~200 V),技术性能可满足小鼠电激怒实验教学要求,能解决一些生物信号采集系统,刺激电压较低的问题;(3)软件操作简单、性能稳定、通用性好、安全可靠且成本低,具有应用和推广价值。
研制的电刺激系统立足于制备激怒反应模型,但又不仅限于此实验内容。此电刺激器操作系统还可用于对动物的强刺激,如惊厥及刺痛以及对大动物的刺激,如大鼠、兔等,进而推广应用于生理学、药理学、病理生理学等与医学相关的较强电刺激实验。
3 电刺激系统在动物实验中应用
3.1 材料和方法
3.1.1材料:SPF级ICR异笼喂养雄性小鼠80只,7周龄,体质量20~22 g,购自吉林大学基础医学院实验动物中心,实验动物生产许可证号:SCXK(吉)2018-0007,实验动物使用许可证号:SYXK(吉)2018-0001。氯丙嗪注射液购自江苏朗欧药业有限公司,批号:20160723。氯化钠注射液购自昆明南疆制药有限公司,批号:A180313D-1。实验动物饲养和处理严格遵循动物福利“3R”原则和吉林大学基础医学院伦理委员会相关条例要求[7],并已通过吉林大学基础医学院福利伦理审查,福利伦理审查编号:2019年研审第60号。
3.1.2方法:首先,选择计算机功能区开始栏中“刺激器”选择框可以打开刺激器参数设置视图,视图从左到右分为单脉冲和多脉冲参数调节区,从上到下依次为4个调节区,单脉冲参数设置区调节的基本参数包括:脉冲周期、延时时间、脉冲宽度和脉冲幅值。单击“输出”按钮可以按照刺激器当前设置参数启动系统,硬件向外输出刺激信号。
随后进行动物实验,将40小鼠随机分成研制电刺激器组和原有电刺激器组,每组20只,并每2只一对,分别放入连有刺激输出线的激怒装置中,按“输出”开始刺激,调节电压值,使电压由低逐渐升高,直至出现激怒反应(前肢离地站起、对峙及互相撕咬)为止。此时电压为该激怒反应的刺激阈电压,每次刺激间隔30 s,记下引起每组鼠出现激怒反应的刺激阈电压值,并计算出制备激怒反应模型成功率的百分比[8]。
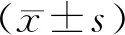
3.2 结果
使用原有电刺激器作为对照,实验结果显示:研制的电刺激器系统组制备小鼠“激怒反应模型”成功率显著高于对照组(P<0.01),刺激阈电压值(100~150 v)高于对照组(P<0.01);采用原有刺激器要想达到90%激怒模型成功率大约需要90只小鼠,而研制的刺激器只需20只,节省了小鼠,提示:研制电刺激器系统提高刺激阈电压,在此环境下可满足制备小鼠“激怒反应模型”的电压需要,从而提高了模型成功率,也节省了动物,见表1。

表1 两组引起小鼠激怒阈电压值和成功率比较
3.3 正式实验
按每实验室10小组计算,每小组4只,独立完成实验。最后将全实验室的实验结果汇总、计算、统计并得出结果。每小组实验操作方法:①抓取、称质量并分组:取体质量相近的小鼠4只,称质量后分为氯丙嗪组和对照组;②使用研制电刺激器,制备小鼠“激怒反应模型”求出刺激阈电压使用上述方法。每次刺激间隔30 s,可重复几次,如不出现激怒反应则需更换小鼠;③将氯丙嗪组小鼠腹腔注射0.05%氯丙嗪,剂量为0.1 mL/10 g;对照组小鼠注射相同容积的生理盐水。给药后20 min,重复上述实验,观察两组小鼠在给药前后的阈电压和潜伏期的不同点。结果:氯丙嗪组在制备激怒模型时有一小组没有成功,之后更换了两只小鼠;给药后,氯丙嗪组阈电压值和激怒潜伏期与对照组比较差异有统计学意义(P<0.05),验证了氯丙嗪对小鼠激怒反应有拮抗作用,见表2。

表2 氯丙嗪对引起小鼠激怒阈电压值和潜伏期的影响(n=20)
4 讨论
利用实验室现有的计算机,以STM32F103单片机为控制中心来设计新型电刺激器系统。该电刺激器系统通过计算机与STM32F103单片机之间的RS232通讯,输入所需控制参数并传输到STM32F103单片机中,控制输出电路来输出高压脉冲,以满足电刺激信号的幅度和强度要求[9],提高了制备小鼠激怒反应模型成功率,取得了良好的教学效果,保障了实验教学顺利进行,提高了医学本科实践教学质量[10]。同时,符合实验动物福利的“3R”原则,节省了实验动物。基于STM32F103的电刺激器系统的最大特点是实现了通过计算机来设置电刺激的波形、强度、频率、脉宽等,这就为实验动物研究电刺激的最佳频率、强度等不同参数组合方式提供了基础。下一步将结合教学和科研项目进行进一步探索,针对动物的强刺激,如惊厥、刺痛等以及对大动物的刺激,如大鼠、兔等,并通过适当更新仪器固件,优化和完善研发的电刺激器系统。不仅满足适合制备小鼠激怒反应模型实验教学需求,同时还可推广应用于对大动物较强电刺激的医学实验研究,特别适用于电刺激参数需要探索的科学研究场所。

