壳聚糖修饰黑磷纳米片的制备及体外光热抗肿瘤活性评价
张涵雪,阿依妮尕尔·艾力,张霄仪,陈文
(石河子大学药学院,新疆 石河子 832003)
二维材料由于其优异的光学、电学、热学和机械等性能,被广泛应用于光/电催化[1]、化学和生物传感[2]、场效应晶体管[3]、离子电池[4-5]、光伏器件[3,6]等领域。二维黑磷纳米片(BPNSs)作为非金属分层半导体,比表面积大,有利于载药,此外,具有优异的近红外光热性质[7],在较长的波长区域内显示出广泛的吸收,常被应用于光热治疗(Photothermal Therapy,PTT)[8],在肿瘤治疗中发挥重要作用。其制备方法主要有机械剥离、液相剥离、化学气相沉积法等[9]。然而在空气中极易氧化,且随着层数减少会在短时间内发生降解[10]的缺点限制了其应用。因此,将BPNSs用修饰、掺杂、涂覆、复合等方式钝化和功能化[11-12],可改变其各向异性[13]、电荷迁移率和能带间隙[14]等化学、电学和光学性质,同时起到防降解的效果。
与众多表面修饰剂相比,壳聚糖(CS)作为一种带正电的天然高分子多糖,具有原料来源广泛,价格便宜,操作简单和低耗能等优点。同时由于其具有良好的生物可降解性、生物相容性,成膜性、吸附性,以及易于化学修饰等特性,通常用作载药体的修饰、活化和偶联。壳聚糖包覆在载药体外面,可对载药体起到保护作用,减少磷脂氧化,增加传递体稳定性,提高了药物的缓释性[15]。
近年来,有研究表明,BPNSs在一定质量浓度范围内,具有低生物毒性的特征[16],并且通过壳聚糖修饰BPNSs形成稳定抗癌复合物的制备方法鲜有报道,为此本文通过液相剥离法制备BPNSs、表面化学修饰法将壳聚糖修饰于BPNSs表面,探究壳聚糖修饰BPNSs的制备方法及体外光热抗肿瘤活性。
1 材料与方法
1.1 材料
1.1.1 仪器
Eppendorf centrifuge 5430R高速离心机(上海心亮实业有限公司);KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司);DN-48A 氮吹仪(上海比朗仪器制造有限公司);DHG-9240电热恒温鼓风干燥箱;AR1140型电子天平(Ohaus Corp.Pine Brook,NJ,USA);Zetasizer Nano ZS90马尔文激光粒度仪(德芮克国际股份有限公司);流式细胞仪(美国,BD FACSCALIBUR);蔡司荧光正置显微镜(ZEISS AXIO IMAGER2);7010101016 200-1000 μL Dragon移液器(大龙兴创实验仪器有限公司)等。
1.1.2 样品与试剂
壳聚糖(上海蓝季科技发展有限公司,脱乙酰度≥90.0%,批号:151026;成都市科龙化工试剂厂,纯度≥85%,CAS 9012-76-4);黑磷(南京牧科纳米科技有限公司,纯度≥99.9%);N-甲基吡咯烷酮(上海麦克林生化科技有限公司,纯度≥99.5%,CAS 872-50-4);丙酮(天津市富宇精细化工有限公司,纯度≥99.5%,批号:181210);甲醇(天津市风船化学试剂科技有限公司,纯度≥99.7%、批号:20190820);冰乙酸(天津水晟精细化工有限公司,纯度≥99.5%,批号:20180820);无水乙醇(天津市风船化学试剂科技有限公司,纯度≥99.7%、批号:20180905);McCoy’s 5 A培养液(武汉普赛诺生物科技有限公司,批号:WH01132011XP01);Hoechst/PI双染试剂盒(日本联科生物,批号:20210104);其他试剂均为分析纯,水为去离子水。
细胞株Saos-2 人成骨肉瘤细胞,购自武汉普赛诺生物科技有限公司 CL-0202(STR鉴定正确)。
1.2 实验方法
1.2.1 二维黑磷纳米片的制备
将BP晶体放到 N-甲基吡咯烷酮(N-Methyl pyrrolidone,NMP)高功率超声分散 24 h。在原子力显微镜下测得BPNSs的尺寸最大可达到 200 nm左右,厚度在5 nm以内。超声分散方式通常为探头超声、水浴超声,本实验选择水浴超声与探头超声结合。如图1所示,从外观大小和分散度看,结合超声的结果更可观。
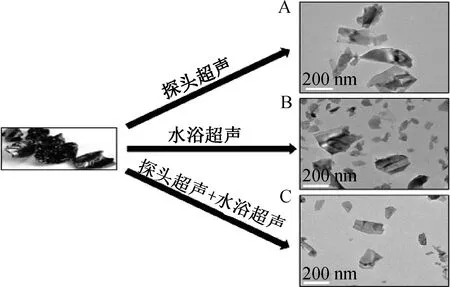
A:探头超声后的BPNSs TEM;B:水浴超声后的BPNSs TEM;C:探头超声和水浴超声交替进行后的BPNSs TEM
将1 000 mg BP块状晶体与10 mL NMP一起放入到清洗干净的玛瑙研磨钵中研磨3 h,研末至黑色块状固体粉碎至银黑色粉末,然后全部转移到100 mL棕色避光蜀牛瓶中,用NMP定容到90 mL,吹氮气隔绝空气,并用防水胶封口胶密封,冰箱冷藏保存;探头超声8 h(温度<30 ℃,功率10%,开/关脉冲设置:1、3 s),交替水浴超声10 h;离心除去大尺寸产物8 000 r·min-1,20 min,收集上清,梯度离心12 000 r·min-1,20 min,收集沉淀;丙酮和乙醇洗涤除去NMP,各3次,除去上清液,无水乙醇重新分散得到BPNSs-无水乙醇分散液,氮气排空密封,避光冷藏保存。
1.2.2 壳聚糖修饰二维黑磷纳米片的制备
1.2.2.1 壳聚糖的预处理
称取壳聚糖溶于冰醋酸溶液中,搅拌至充分溶解,无沉积物、不溶颗粒物或凝聚胶体。过滤除去不溶物质,滤液冷藏备用。
壳聚糖:①:分子量10 000~30 000;②:分子量70~80万,脱乙酰化≥90.0%,称取0.44,0.40,0.20 mg,准备溶解在20 mL冰醋酸溶液中,分别对应2.2%,2.0%,1.0%含量的壳聚糖溶液。室温磁力搅拌溶解;两种浓度冰醋酸,制备后室温磁力搅拌混匀:①1.0%冰醋酸150 mL:1.5 mL冰乙酸加去离子水至150 mL;②0.1 mol·L-1冰醋酸(17 mol·L-1)150 mL:0.88 mL冰乙酸加去离子水至150 mL。
设计平行定性对照试验,壳聚糖①、壳聚糖②分别配制2.2%,2.0%,1.0%含量溶液,平行配制两份,分别置于冰醋酸①、冰醋酸②中,共12组。室温磁力搅拌溶解后放置不同时间,观察溶解现象并测定相应表面电位值,综合筛选溶解情况最优的壳聚糖种类和冰醋酸浓度进行后续修饰实验。
1.2.2.2 二维黑磷纳米片的壳聚糖修饰
BPNSs的去离子水洗涤,将含有2 mg BPNSs的BPNSs-无水乙醇混悬液2 mL超声20 min使纳米片均匀分散,离心20 min,转速12 000 r·min-1,除去上清液,用去离子水洗涤,超声分散均匀,离心20 min,洗涤3次;将洗涤后的BPNSs除去上清液,加去离子水至1 mL,超声分散,加入到小西林瓶中,分别加入与BPNSs质量比为1,5,10的壳聚糖溶液。分别将混合物水浴超声30 min,50 Hz;除去混合物中未结合的壳聚糖,搅拌过夜,离心8 000 r·min-1,去离子水洗涤2次。除氧去离子水分散,吹氮气排空气封口,避光冷藏保存。
1.2.3 壳聚糖-二维黑磷纳米片的表征
1.2.3.1 透射电镜外观形貌考察(TEM)
TEM可以看到小于0.2 μm的在光学显微镜下无法看清的细微物质或结构,通过物质的化学特性、晶体方向、电子结构、样品造成的电子相移以及通常的对电子吸收等特征,使用TEM不同的模式对样品成像。将准备好的壳聚糖-BPNSs混合物水溶液滴在处理过的铜网上真空干燥2 h,烘干后放入0.5 mL EP管密封好,送样进行观察。通过透射电镜结果筛选出最佳配比以进行后续表征验证。
1.2.3.2 粒径测定
采用激光法测量粒度,对于不规则的颗粒物,可将与该颗粒有相同体积的某一球体直径作为该颗粒的等效直径。用马尔文粒度仪测量修饰和未修饰的BPNSs,观察粒径前后变化。
1.2.3.3 表面Zeta电位测定
通过靠近表面的抗衡离子的积聚屏蔽了表面电荷,故而会降低Zeta电位。用马尔文粒度仪测量修饰和未修饰的BPNSs及壳聚糖,观察Zeta电位前后变化,判断是否进行了表面修饰。
1.2.3.4 傅里叶红外光谱定性分析(IR)
利用IR法鉴定物质通常采用比较法,即与标准物质对照和查阅标准谱图的方法。IR定性分析有分析时间短、需要的样品量少、不破坏样品、特征性高、测定简便等优点。红外吸收峰的位置与强度反映了分子在结构上的特征,可以用来确定未知物的结构组成或鉴别其化学基团。分别将溴化钾和BPNSs、壳聚糖、壳聚糖修饰的BPNSs研磨混合均匀并压片,观察壳聚糖修饰后的BPNSs吸收峰是否具有壳聚糖谱图和BPNSs谱图的特点,以此来判断是否成功修饰。
1.2.4 壳聚糖-二维黑磷纳米片的稳定性考察
将制备出的BPNSs在装有相同体积不同溶液的西林瓶中分散均匀,室温不密封放置,观察放置不同天数其外观颜色的变化;同时同法对比壳聚糖修饰前后产物(100 μg·mL-1)室温放置0~30 d透光性及分散性的变化并进行紫外分光光度法测定300~800 nm的全波长吸收。
将上述制备得到的壳聚糖-BPNSs均匀分散于2 mL Saos-2细胞培养基中(100 μg·mL-1),放置0、5、7 d,观察培养基颜色变化,判断产物降解程度。
1.2.5 体外光热抗肿瘤活性评价
将Saos-2细胞与BPNSs壳聚糖修饰产物共同孵育,用功率密度为1.5 w·cm-2的808 nm近红外激光照射不同时间(0、10、20 min),孵育24 h后,采用TransDetect Annexin V-FITC/PI细胞凋亡检测试剂盒(MultiSciences Biotech)检测凋亡细胞。收集Saos-2细胞,洗涤后再用PBS悬浮,然后在500 μL的1×Binding Buffer缓冲液中(含5 μL的Annexin V-FITC和10 μL的PI)在室温黑暗中孵育5 min。流式细胞仪分析细胞凋亡。同时用Hoechst/碘化丙啶(蓝色荧光/红色荧光)通过共同标记细胞,荧光显微镜下观察细胞状态。
2 结果与分析
2.1 二维黑磷纳米片的制备
制备前的SEM图可以看到BP晶体表面粗糙不规则、边缘褶皱(图2A)。而由制备后的BPNSs可以看出BPNSs的边缘呈现棱角状,大小为200 nm左右(图2B)。在TEM(图2C)中可明显观察到,所制备的BPNSs大小适中,分散性良好,同样呈现薄纱状,片层越透明,暗示厚度越小;同时采用原子力显微镜(AFM)对BPNSs进行厚度测试,在AFM下对100个纳米片进行统计,BPNSs厚度均在5 nm以内(图3)。说明所制备的BPNSs厚度均匀适中;此外紫外全波长吸收结果表明所制备的BPNSs在整个紫外可见区间均具有良好的光吸收性能。综上所述说明BPNSs的成功制备(图4)。

A:黑磷块状晶体的SEM Bar=50.0 μm;B:BPNSs的SEM图 Bar=400 nm;C:BPNSs的高分辨透射电镜图(HR-TEM)Bar=200 nm。

图3 二维黑磷纳米片的AFM结果图
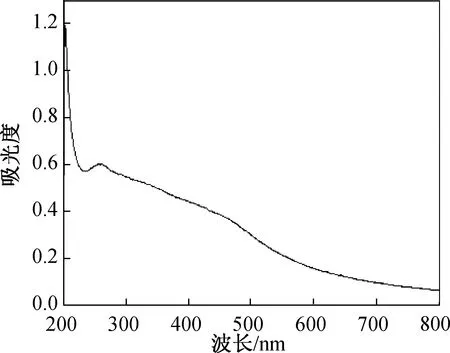
图4 二维黑磷纳米片的紫外-可见光谱图
2.2 壳聚糖-二维黑磷纳米片的制备
壳聚糖的预处理平行实验结果:由表1可明显看出,在1.0%的浓度下,不论是壳聚糖①还是壳聚糖②,在不同浓度醋酸中都有良好的溶解情况。由此可通过对比1.0%浓度壳聚糖的溶解情况选择合适分子量的壳聚糖和适宜浓度的冰醋酸;通过表2可判断,在同一浓度(1%)壳聚糖溶液中,壳聚糖②和冰醋酸②混合室温磁力搅拌放置后的溶解情况最好,同时由表3结果可知,同一条件下壳聚糖②和冰醋酸②组合的zeta电位值最高,可归因于壳聚糖溶于冰醋酸后,分子中氨基与质子相结合,从而使其自身带正电荷,溶解的壳聚糖越多则表面电位值越高,体系也越稳定,故选用壳聚糖②(分子量70~80万,脱乙酰化≥90.0%)溶解于冰醋酸②(0.1 mol·L-1冰醋酸)。
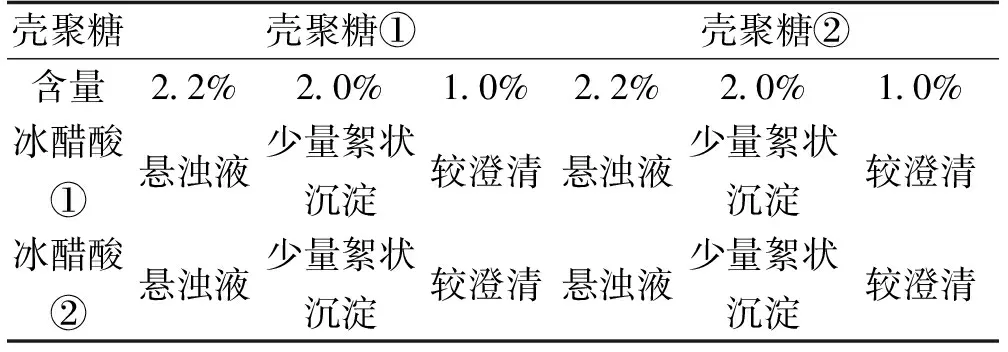
表1 不同分子量壳聚糖和不同浓度醋酸溶液混合1 h后溶解情况对比

表2 1%浓度下不同分子量壳聚糖在不同浓度醋酸下2 h后溶解情况对比
表3 不同壳聚糖-冰醋酸溶液的Zeta电位值
2.3 壳聚糖-二维黑磷纳米片的表征
2.3.1 透射电镜(TEM)外观形貌考察
经壳聚糖修饰后BPNSs的TEM成像见图5,由图5A,5B可看出当壳聚糖与BPNSs质量比为1或5时显然未见修饰完整,仍旧呈现出裸露的片状;相反当质量比扩至10时(图5C),与修饰前BPNSs TEM图2C对比可明显发现,原本棱角分明的BPNSs在修饰壳聚糖后产物呈现边缘光滑圆润,同时厚度增加,表明壳聚糖成功修饰于BPNSs表面。因此选择二者质量比为10的产物进行后续表征验证。

A:壳聚糖:BPNSs(w/w)=1;B:壳聚糖:BPNSs(w/w)=5;C:壳聚糖:BPNSs(w/w)=10。
2.3.2 粒径与电位
BPNSs修饰前后粒径数据变化结果见图6和表4,可以明显看到壳聚糖修饰后BPNSs的粒径有所增加;同时由表4中BPNSs修饰前后Zeta电位数据的变化可以清晰看到,修饰前壳聚糖中含质子化的氨基,带正电荷,显酸性,而BPNSs是带负电的,由于表面电荷极性相反的电荷离子(抗衡离子)会相互吸附,二者以静电结合的方式产生作用。故在壳聚糖成功修饰BPNSs后,其所带正电荷中和了BPNSs所携带的负电荷。与未修饰的BPNSs相比,Zeta电位有所上升。
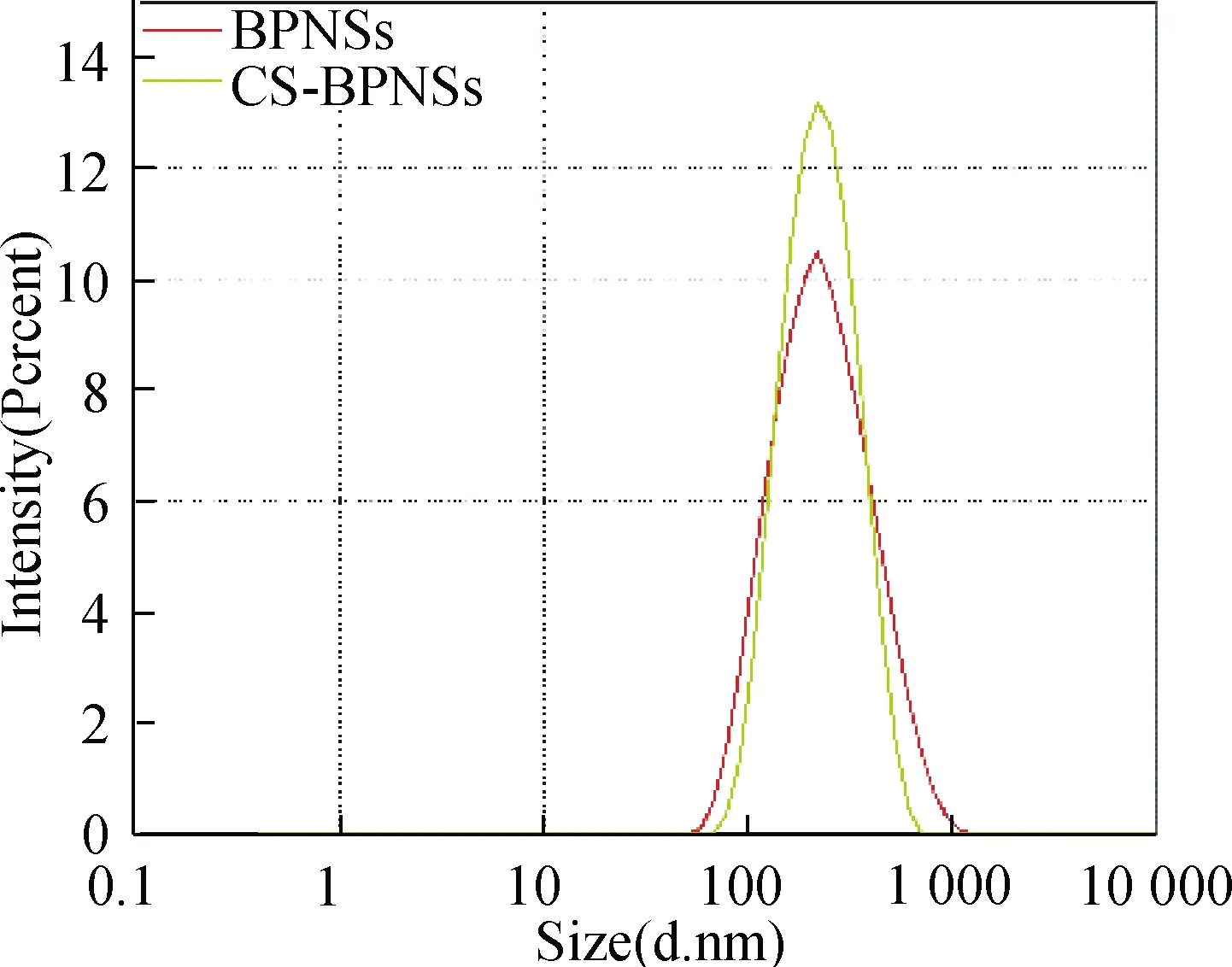
图6 壳聚糖修饰前后BPNSs的粒径图
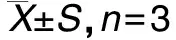
表4 修饰前后二维黑磷纳米片的粒径和Zeta电位值
2.3.3 红外光谱结构表征测定
采用FTIR表征BPNSs、壳聚糖修饰的BPNSs、壳聚糖三种物质的表面基团结构性质,验证壳聚糖是否成功修饰于BPNSs表面。如图7结果所示,裸露的BPNSs只有磷酸根官能团,故在IR图谱上红外波较为平缓,只显示出P-O振动吸收峰。壳聚糖修饰后,出现了几个较为明显的特征峰。3 400 cm-1左右,是壳聚糖形成氢键缔合的多重吸收峰,包括-OH伸缩振动吸收峰与-NH2的伸缩振动吸收峰,如图对比可见,修饰后的吸收峰发生了红移,原因是量子尺寸效应,由于N-H键变长,颗粒尺寸增大能隙变宽,已被电子占据的分子轨道能级与未被占据分子轨道能级之间的宽度随颗粒直径增大而减小,单键力常数K变小,波数v变小;在2 908.7~2 912.3 cm-1和2 840.5~2 851.8 cm-1处的两个峰是由C-H伸缩振动吸收引起的;1 655.9~1 657.4 cm-1和1 603.5~1 612.8 cm-1处分别为酰胺 I吸收峰和酰胺II吸收峰,证明了壳聚糖的成功修饰;1 410.8 cm-1处较强的峰为-CH2弯曲振动吸收和-CH3变形吸收峰进一步证明BPNSs被壳聚糖成功修饰。
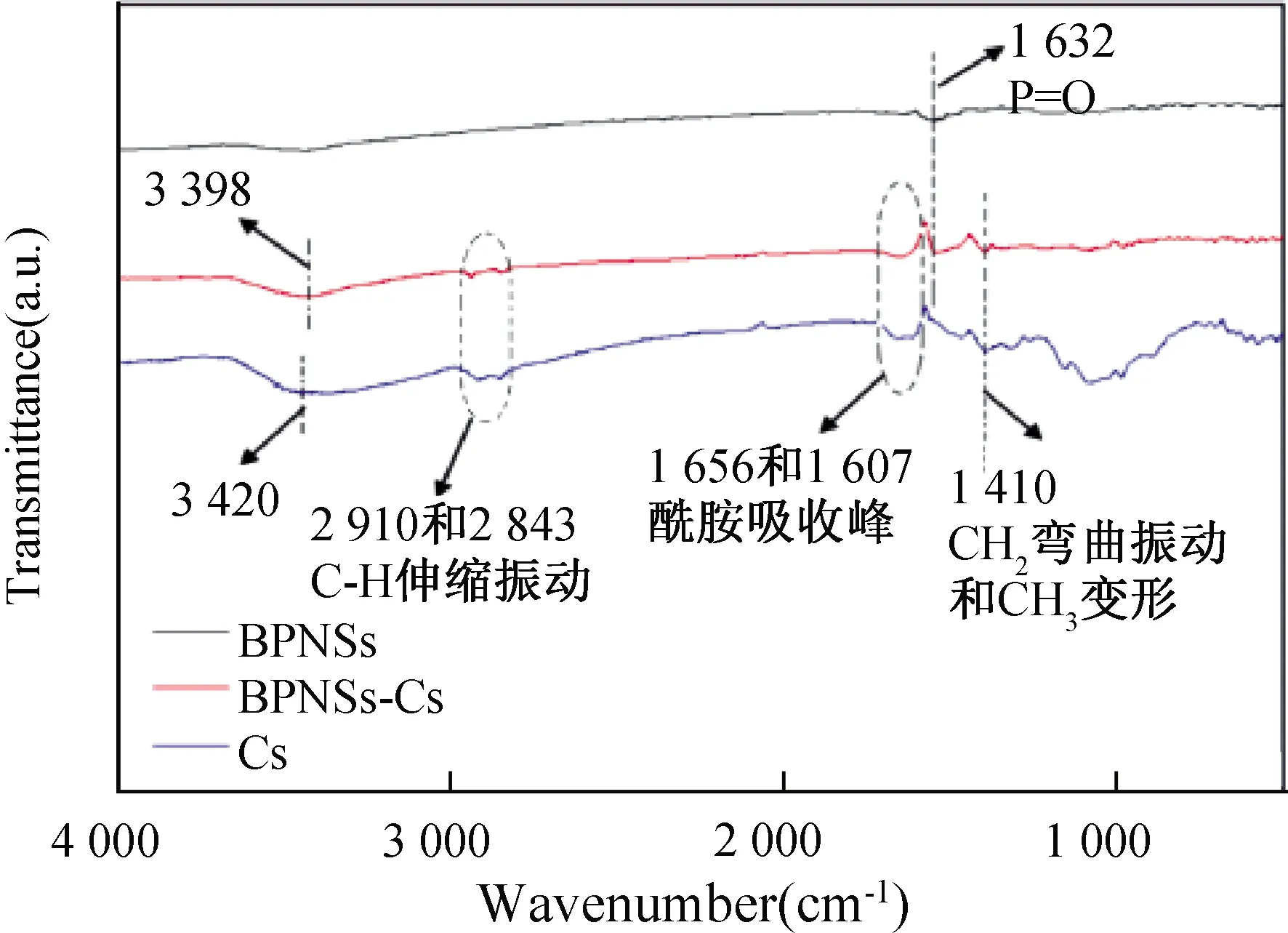
图7 BPNSs、壳聚糖修饰-BPNSs、纯品壳聚糖的IR图谱
2.4 壳聚糖-二维黑磷纳米片的稳定性考察
2.4.1 二维黑磷纳米片的放置稳定性考察
如图8所示,将制备出的等量BPNSs于相同体积的去离子水和无水乙醇的西林瓶中均匀分散,外观呈黄褐色,于室温阴凉处放置,可显著发现,去离子水中的BPNSs在5 d后被氧化为淡黄色;相同条件下,无水乙醇中的BPNSs在10 d后才变为同样程度的淡黄色。说明BPNSs置于无水乙醇中比在去离子水中被氧化的程度小,说明BPNSs置于有机溶剂中不易被氧化,稳定性较好。

图8 等量BPNSs均匀分散于同体积去离子水与无水乙醇的稳定性实验
2.4.2 壳聚糖-二维黑磷纳米片的稳定性考察
如图9所示,相比于未修饰的BPNSs,壳聚糖修饰后分散更加均匀稳定,透光性更好,更加接近于胶体溶液;同时由图10可以看出在同一浓度条件下静置(自然沉降)30 d后BPNSs几乎完全沉降,而修饰后产物壳聚糖-BPNSs依旧具有良好的水分散性;同时由朗伯比尔定律可知,溶液的浓度越大,透射率越低,从而吸收度越大,由图11的吸收光谱图可以看出在去离子水中修饰后的产物壳聚糖-BPNSs分散液静置3 d后依然有较优良的稳定性,且分散液吸收度降低的程度较小。此外,由图12可看出在放置0、5、7 d后培养基的颜色逐渐变浅,说明所制备的壳聚糖-BPNSs在细胞培养基中具有良好的降解特性。

图9 同一浓度下壳聚糖修饰前后BPNSs的透光性及分散性考察

图10 同一浓度下去离子水中BPNSs和壳聚糖-BPNSs的放置稳定性
图11 同一浓度下去离子水中BPNSs(左)和壳聚糖- BPNSs(右)的放置0~3 d的紫外光谱图

图12 壳聚糖-BPNSs的降解示意图
2.5 体外光热抗肿瘤活性评价
在不同时间的近红外线激光作用下,壳聚糖-BPNSs产生光热作用逐渐杀死肿瘤细胞。流式细胞仪分析壳聚糖-BPNSs在近红外激光照射的情况下,Annexin V阳性-PI阴性细胞发生早期凋亡,Annexin V阳性-PI阳性细胞发生晚期凋亡/坏死,结果如图13所示,随着照射时间的增加Saos-2细胞凋亡/坏死的程度逐渐加深;同时图14结果显示Hoechst/PI双染活细胞(弱红色荧光+弱蓝色荧光)逐渐减少,而凋亡细胞(弱红色荧光+强蓝色荧光)与坏死细胞(强红色荧光+强蓝色荧光)则逐渐增多,二者结果一致,证实照射可显著促进肿瘤细胞凋亡/坏死,这可归因于光热毒性。同时证明,壳聚糖-BPNSs能够产生良好的光热治疗效果。
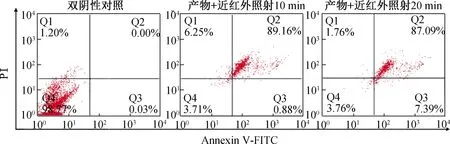
图13 流式细胞术分析不同近红外照射时间下壳聚糖-BPNSs孵育细胞的散点图
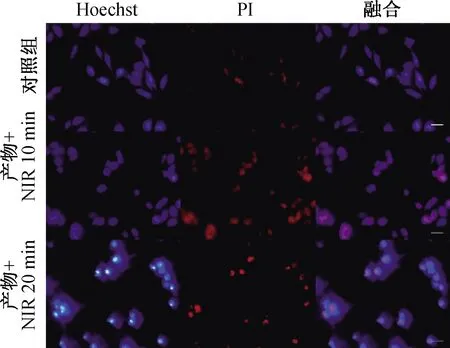
图14 壳聚糖-BPNSs处理后不同照射时间荧光共染色的细胞显微镜图(标尺:100 μm)
3 讨论
目前,二维黑磷纳米片的制备方法主要包括:机械剥离法、液相剥离法以及基于金属基底的化学气相沉积法。但机械剥离法具有尺寸不易控制、难以大规模制造等缺点,仅适用实验室制备以满足各项测试,并且剥离出的少层黑磷极不稳定,需要在无水无氧的环境下进行剥离操作。同时目前基于金属基底的化学气相沉积法制备少层黑磷还鲜有报道。原因可能是黑磷表面的化学活性很强,当其暴露在空气中时易和氧气发生反应,导致黑磷的表面很脆弱,不利于黑磷的生长;此外目前还未寻找到适合黑磷生长的基底。相反液相剥离作为制备各种二维材料纳米片的常用方法,具有尺寸易控、产率高、可满足大规模生产制备以及无需直接暴露于空气等优势,因此本实验采用液相剥离法剥离得到二维黑磷纳米片,并通过具有高度生物相容性的壳聚糖进行二维黑磷纳米片修饰,成功地制备获得了一种稳定且具有良好光热抗肿瘤活性的纳米材料。不仅能够为壳聚糖修饰二维黑磷纳米片的制备提供切实可靠的实验依据,同时为后续的生物学应用也奠定相应的基础。此外通过本实验研究,我们认为壳聚糖修饰的黑磷纳米片的载药能力及其他在生物医学尤其是肿瘤方面值得进一步进行更多的实验和临床研究。

