原代SD仔鼠心肌成纤维细胞分离与培养方法的改进
张平,谭延振,张冰,赵荣,金振晓,易定华,孙阳,易蔚,李香敏
1.空军军医大学第一附属医院心血管外科,陕西 西安 710032;2.空军军医大学第一附属医院老年病科,陕西 西安 710032;3.空军军医大学第二附属医院肾脏内科,陕西 西安 710038
心肌纤维化是一种发生在损伤后和衰老过程中的病理状态。目前,有效减少或逆转纤维化的手段有限。找到抑制细胞外基质过度沉积的方法的关键是更好地了解负责胶原生成的心肌成纤维细胞[1]。心肌成纤维细胞、心肌细胞、内皮细胞和血管平滑肌细胞是心脏的主要细胞成分[2-3]。由于成纤维细胞特殊的生物学表现[4],迄今仍未建立成熟的细胞系,分离建立高质量的心肌成纤维细胞细胞系成为了抗心肌纤维化研究的关键。
1 材料与方法
1.1 材料
1.1.1 实验动物 10只SD仔鼠(1~3 d龄,雄性,体质量5~7 g)由空军军医大学实验动物中心提供,实验条件严格按照国家科学技术委员会颁布的《实验动物管理条例》[5]进行。
1.1.2 实验试剂 Anti-CD31 antibody、Anti-Vimentin antibody、Anti-alpha smooth muscle Actin antibody购于Abcam公司,DMEM低糖液体培养基购于HyClone公司,Fetal bovine serum、FBS购于Gibco公司,Ⅱ型胶原酶购于Solarbio公司。
1.1.3 实验仪器 Centrifuge 5424R(Eppendorf,5404F1221612)、彩盘面磁力搅拌器(德国IKA,S025)、Thermo Forma 3111 CO2培养 箱(Thermo Scientific,312748-11212)、超净工作台(美国,Thermo Scientific)、倒置荧光显微镜LX51S8F-3(Olympus Corporation,LK49655)、微量电子天平(德国赛多利斯,CPA225D)、FV10C-W3激光共聚焦显微镜(Olympus Corporation,1M35212)、台式低速自动平衡离心机(Aence湘仪,L420)。
1.2 方法
1.2.1 实验物品准备 眼科直剪、眼科弯剪、眼科弯镊、大镊子、1×磷酸盐缓冲液(PBS)、10 cm培养皿、吸管、酒精灯、无菌青霉素瓶、磁力搅拌器和搅拌子、口罩、帽子、无菌手套等;用1×PBS液为母液配置质量浓度为0.4%的胰酶溶液及0.1%的Ⅱ型胶原酶消化液,过滤除菌,室温备用。
1.2.2 心脏组织取材 将SD仔鼠用75%乙醇消毒液Ⅰ浸泡15 s更换75%乙醇消毒液Ⅱ浸泡15 s消毒;左手固定SD仔鼠,弯剪斜行剪开左下胸部皮肤并向两侧分离,更换为直剪沿第4肋间剪开胸壁并向两侧撑开胸壁,左手配合挤压胸腔将心脏挤出胸腔,沿心脏中部横行将SD仔鼠心室部分剪下,置于冰浴的1×PBS中;更换剪刀,将SD仔鼠心脏组织周边的纤维组织剪除并清洗血凝块,放入另一个冰浴培养皿1×PBS中再次清洗;将修剪清洗好的SD仔鼠心脏组织移入无菌玻璃瓶中,换用另外一把眼科弯剪将心脏组织剪成1 mm×1 mm×1 mm组织碎块。
1.2.3 消化 加入4~6 mL 0.4%的胰酶消化液混匀后室温静置消化3 min,吸弃上清液,加入约4 mL 0.1%Ⅱ型胶原酶消化液,置入搅拌子,加盖橡皮塞后置入37℃孵箱100 r/min搅拌消化10 min(图1),室温静置3 min,吸出上清液至10%胎牛血清(FBS)培养液中,重复加入4 mL 0.1%Ⅱ型胶原酶消化液搅拌消化5~6次直至剩余少许组织块为止;800 r/min 5 min离心,弃上清。

图1 磁力搅拌器搅拌混匀胶原酶消化液消化SD仔鼠心肌组织
1.2.4 差速贴壁分离细胞 加入约10 mL 10%FBS培养液重悬细胞,接种到一个75 cm2的培养瓶中,放置在37℃、5%CO2培养箱中贴壁约90 min,吸出未贴壁细胞(主要为心肌细胞)作其他试验用,1×PBS洗贴壁细胞(大部分为成纤维细胞)3次后,加入含10%FBS的DMEM低糖培养液,置入培养箱中,约24 h后即可长满。
1.2.5 纯化心肌成纤维细胞 内皮细胞成簇生长,贴壁较成纤维细胞紧,不易从培养瓶底消化;心肌细胞生长条件要求高,传代后不易存活,传代提高成纤维细胞纯度。
1.2.6 心肌成纤维细胞纯度鉴定
1.2.6.1 光镜观察 倒置显微镜观察成纤维细胞形态、均一性,进行拍照。
1.2.6.2 免疫荧光染色激光共聚焦显微镜观察 将P2心肌成纤维细胞接种激光共聚焦皿,进行Vimentin及CD-31染色,激光共聚焦显微镜观察、拍照,Vimentin+/CD31-鉴定为心肌成纤维细胞。
1.2.7 心肌成纤维细胞激活实验 应用TGF-β1诱导P2心肌成纤维细胞α-SMA(α-Smooth muscle actin,α-平滑肌肌动蛋白)表达变化,评估成纤维细胞活化能力,检测评估分离的心肌成纤维细胞质量。
2 结果
2.1 心肌成纤维细胞贴壁时间 心肌成纤维细胞20 min已有贴壁,90 min贴壁完全。
2.2 细胞纯度鉴定
2.2.1 光镜观察鉴定 如图2所示:A图可见未传代心肌成纤维细胞伸展成梭形,胞核清晰且较大,呈椭圆形,分布较均匀,散在生长,不聚集成团,细胞排列紧密,24 h即铺满整个培养瓶底80%~90%;B图可见第1次传代心肌成纤维细胞呈突起的扁平的纺锤形或星形,均匀分布,有的交叉重叠生长呈融合状态,并彼此连接成网状。光镜下观察原代培养的心肌成纤维细胞可见混有少量成簇生长的多边形内皮细胞及可搏动的心肌细胞,由于内皮细胞贴壁较成纤维细胞紧密及心肌细胞传代不易成活,传代后可提高心肌成纤维细胞纯度。
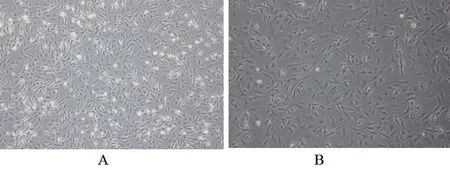
图2 光镜下心肌成纤维细胞图片(×100)
2.2.2 免疫荧光染色鉴定 图3为第2次传代心肌成纤维细胞免疫荧光染色鉴定图片:其中A为心肌成纤维细胞Vimentin免疫荧光染色表达图片,心肌成纤维细胞为Vimentin阳性表达;B为肌成纤维细胞CD-31免疫荧光染色图片,心肌成纤维细胞为CD-31阴性表达。经过鉴定P2代成纤维细胞纯度可达95%以上。

图3 P2代心肌成纤维细胞免疫荧光染色鉴定图片
2.3 心肌成纤维细胞α-SMA表达检测 图4为P2代心肌成纤维细胞α-SMA表达免疫荧光染色图片:A表示分离所得的P2心肌成纤维细胞已开始少量表达α-SMA,但未被组装成动力肌丝形式;B表示,应用TGF-β1诱导心肌成纤维细胞后α-SMA大量表达,且被组装成动力肌丝形式,心肌成纤维细胞转化成激活状态的肌成纤维细胞。

图4 心肌成纤维细胞α-SMA表达
3 讨论
心肌成纤维细胞、心肌细胞、内皮细胞和血管平滑肌细胞是心脏的主要细胞成分[2-3],其中心肌成纤维细胞是心肌纤维化主要参与细胞类型[6],原代心肌成纤维细胞的分离纯化建立高质量的细胞系是心脏病理生理学研究中至关重要的基础。
虽然大多实验室都是应用酶消化联合差速贴壁分离方法将心肌成纤维细胞分离,但具体的细节不尽相同,具体在于酶的种类、使用方法、差速贴壁时间不同[7-8]。本实验采用胰酶破壁消化+Ⅱ型胶原酶消化,在消化过程中应用磁力搅拌器搅拌使Ⅱ型胶原酶与组织块混匀促进消化,避免了在消化过程中吸管吹打产生的机械剪切力对细胞的损伤,从而减低心肌成纤维细激活胞转化为肌成纤维细胞,由于不同细胞贴壁时间不同,成纤维细胞较早贴壁,将消化好的细胞混液接种至75 cm2培养瓶后,贴壁90 min,轻摇培养瓶,吸出未贴壁细胞悬液(心肌细胞),1×PBS洗贴壁细胞3次,去除部分非成纤维细胞成分,提高成纤维细胞纯度。在传代时,胰酶消化后震荡培养瓶,吸管轻轻吹打培养瓶底,吸出细胞悬液,遗留部分贴壁更紧的内皮细胞,通过传代再次提高成纤维细胞纯度。通过光学显微镜观察细胞形态的均一性及应用免疫荧光染色检测第2次传代成纤维细胞Vimentin+/CD-31-表达,成纤维细胞达纯度可达95%以上。
在细胞模型上研究纤维化,细胞的基础状态至关重要,在成纤维细胞的分离过程中很多因素都可引起细胞的激活,表达α-SMA,转化为肌成纤维细胞,如果在细胞分离过程中不能有效控制这些因素,在下一步的实验中处理组与对照组之间细胞的生物学特征的差异将缩小,甚至无法得出统计学差异。首先取心脏的操作要迅速,减少热缺血时间;其次控制好心脏剪碎程度,组织块过大不易消化,组织块过小造成受损伤细胞数量增加,1 mm×1 mm×1 mm左右大小较合适;本实验中首先应用胰酶消化心肌组织块外结缔组织,使细胞暴露,再应用Ⅱ型胶原酶消化细胞间的连接使细胞分散,避免了胰酶消化力强对细胞造成损伤,同时也缩短了Ⅱ型胶原酶的消化时间,减轻了细胞长时间暴露于Ⅱ型胶原酶造成的损伤。在细胞分离过程中,机械力对细胞造成的损伤至关重要,本实验在消化过程中应用磁力搅拌器代替滴管吹打,有效地减小了组织块混合液高速通过滴管口的剪切力造成的细胞损伤。应用免疫荧光染色检测第2次传代后成纤维细胞α-SMA表达情况,分离的P2成纤维细胞α-SMA表达水平很低,且对TGF-β1诱导刺激反应良好,刺激后大量表达α-SMA,证明本方法分离的成纤维细胞损伤小,功能好。
综上,应用胰酶初步消化,磁力搅拌器代替滴管吹打混匀Ⅱ型胶原酶消化液与心肌组织块,促进胶原酶消化顺利进行该的方法可成功分离并建立高质量的心肌成纤维细胞系。

