基于pH 梯度法的盐酸普萘洛尔立方液晶纳米粒的制备
曾令军,陈 旭,张灵娜,张佳良,宋洪涛,周 欣 (中国人民解放军联勤保障部队第九〇〇医院药剂科,福建 福州 350025)
盐酸普萘洛尔(propranolol hydrochloride,PPL)是治疗婴幼儿血管瘤的一线和首选药物[1]。口服盐酸普萘洛尔疗效确切,但其存在首过效应强、生物利用度低、半衰期短等问题,且不良反应发生率高[2]。普通盐酸普萘洛尔外用制剂只对浅表型血管瘤有效,对深部型和复合型血管瘤的治疗仍需结合口服给药。诸多研究表明,立方液晶(cubosomes,Cubs)可显著提高经皮给药制剂的皮肤渗透性,且能提高其在皮肤尤其是皮肤真皮层的药物滞留量,有望能提高盐酸普萘洛尔外用制剂对深部型和复合型血管瘤的疗效[3~5]。因此,课题组拟基于立方液晶载药技术将盐酸普萘洛尔制备成一种纳米经皮给药制剂,以期能降低或避免口服给药带来的高不良反应发生率,提高盐酸普萘洛尔的治疗效果和患者依从性。前期实验中,课题组筛选了盐酸普萘洛尔立方液晶纳米粒(PPL-Cubs)的制备方法,并通过单因素考察结合星点设计效应面法优化了其最佳处方和制备工艺,结果制得的PPL-Cubs 包封率低(约50%),远低于药典规定的80%。立方液晶为多层囊泡结构,类似于多囊脂质体,其可能与脂质体同样存在对水溶性化合物包封率较低的问题。鉴于前期研究表明,盐酸普萘洛尔在不同pH 磷酸盐缓冲液下的溶解度存在极大差异,因此,本研究拟在立方液晶常规制备的基础上,引入“pH 梯度法”的载药思路,制备PPL-Cubs,以期提高其包封率。
1 仪器与试药
1.1 仪器
岛津LC-20AD 型高效液相色谱仪(日本岛津公司);DV215CD 型分析天平(美国奥豪斯公司);AL204 型电子天平[梅特勒-托利多仪器(上海)有限公司];DF-101B 集热式恒温加热磁力搅拌器(郑州长城科工贸有限公司);高压均质机(意大利NIRO-SAVI S.P.A.公司);NICOMP 380 ZLS 激光粒度测定仪(美国PSS 粒度仪公司);超滤离心管(100KD,Millipore)。
1.2 试药
盐酸普萘洛尔(含量99.9%,常州亚邦制药有限公司);单油酸甘油酯(法国GATTEFOSSé公司);泊洛沙姆407(德国BASF 公司);甲醇、乙腈为色谱纯,水为超纯水,其余试剂为分析纯。
2 方法与结果
2.1 包封率的测定
取PPL-Cubs 适量,装入超滤离心管中,于4 000 r/min 离心10 min,收集离心液,采用课题组前期建立的盐酸普萘洛尔含量测定方法测定离心液中游离药物浓度C游离;取未透析的PPL-Cubs,测定药物浓度C总;根据公式EE(%)=[(C总-C游离)/ C总]×100%计算PPL-Cubs 的包封率。
2.2 PPL-Cubs 的制备
2.2.1 注入法
精密称取单油酸甘油酯9 g 和泊洛沙姆407 1.5 g,加入10 ml 无水乙醇,20 ℃水浴下搅拌溶解,为A 相;精密称取盐酸普萘洛尔3.5 g,加入86 g纯化水,20 ℃水浴下搅拌溶解,为B 相。于20 ℃水浴及600 r/min 搅拌速度下,将A 相缓慢地滴加至B 相中,待磁力搅拌1 h 后加入适量纯化水使总质量为100 g,再在800 bar 压力下高压均质7 次,得PPL-Cubs。
2.2.2 pH 梯度法
精密称取单油酸甘油酯适量,40 ℃水浴加热使融化,为A 相;精密称取泊洛沙姆407 适量,加入适量纯化水,40 ℃水浴加热使溶解,并用1%磷酸溶液调节pH 至酸性,为B 相;于40 ℃水浴及600 r/min搅拌速度下,将A 相缓慢滴加到B 相中,待磁力搅拌30 min 后,得空白立方液晶纳米粒粗品;取空白立方液晶纳米粒粗品,高压均质数次,得空白立方液晶纳米粒(B-Cubs)。取盐酸普萘洛尔溶解于适量纯化水中,得盐酸普萘洛尔水溶液;将盐酸普萘洛尔水溶液加入一定比例的B-Cubs 中,搅拌均匀,并用氢氧化钠溶液调节pH 至一定值,于一定温度下持续搅拌一定时间,再放置至室温,即得PPLCubs。
2.3 B-Cubs 的制备工艺优化
前期试验结果表明,磁力搅拌速度、时间、温度、内水相pH 值对B-Cubs 的粒径基本无影响,高压均质压力及均质次数是影响其粒径的主要因素,故拟进一步优化高压均质压力和均质次数。
2.3.1 高压均质压力的考察
按照“2.2.2”项下方法,取空白立方液晶纳米粒粗品,分别在400、600、800、900、1 000 bar 下高压均质7 次,测定制得B-Cubs 的粒径及多分散指数(见表1)。结果表明,随高压均质压力的提高,制得B-Cubs 的粒径和多分散指数均逐渐减小,当均质压力≥900 bar 时,B-Cubs 的粒径和多分散指数变化较小,故确定高压均质压力为900 bar。
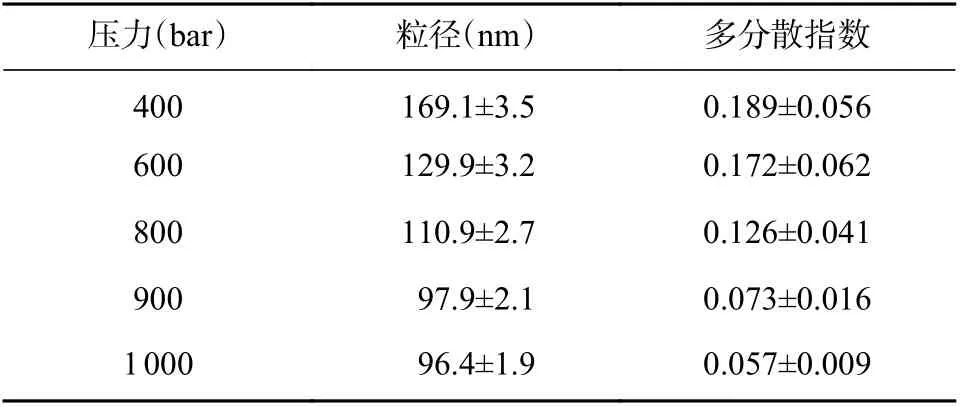
表1 高压均质压力的考察(n=3)
2.3.2 高压均质次数的考察
按照“2.2.2”项下方法,取空白立方液晶纳米粒粗品,分别在900 bar 下高压均质3、5、7、9 次,测定制得B-Cubs 的粒径及多分散指数(见表2)。结果表明,随高压均质次数的增加,制得B-Cubs 的粒径和多分散指数均逐渐减小,当均质次数≥7 次时,B-Cubs 的粒径和多分散指数变化较小,故确定高压均质次数为7 次。

表2 高压均质次数的考察(n=3)
2.4 B-Cubs 的处方优化
2.4.1 单油酸甘油酯用量的考察
基于优化的B-Cubs 最佳制备工艺,按照“2.2.2”项下方法,固定泊洛沙姆407 用量为5%,内水相pH 为3.0,考察单油酸甘油酯用量(15%、20%、25%、30%、35%)对制得B-Cubs 粒径及多分散指数的影响(见表3)。结果表明,随单油酸甘油酯用量的增加,制得的B-Cubs 粒径呈先减小后增大趋势,多分散指数则不断降低,当单油酸甘油酯用量为25%时,制得的B-Cubs 具有最小的粒径和较适宜的多分散指数,故确定单油酸甘油酯用量为25%。
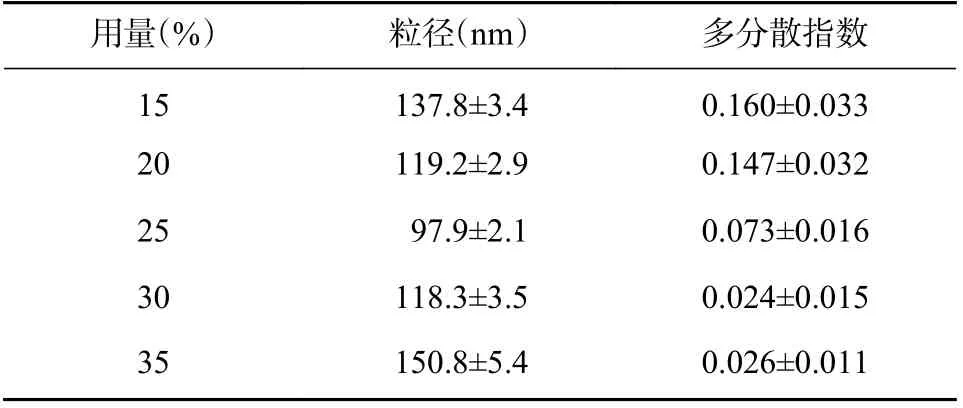
表3 单油酸甘油酯用量的考察(n=3)
2.4.2 泊洛沙姆407 用量的考察
基于优化的B-Cubs 最佳制备工艺,按照“2.2.2”项下方法,固定单油酸甘油酯用量为25%,内水相pH 为3.0,考察泊洛沙姆407 用量(3%、4%、5%、6%、7%)对制得B-Cubs 粒径及多分散指数的影响(见表4)。结果表明,制得的B-Cubs 粒径随泊洛沙姆407 用量的增加逐渐降低,多分散指数变化无明显规律,但均较小(<0.1);当泊洛沙姆407 用量≥5%时,粒径变化幅度降低,故确定泊洛沙姆407 用量为5%。
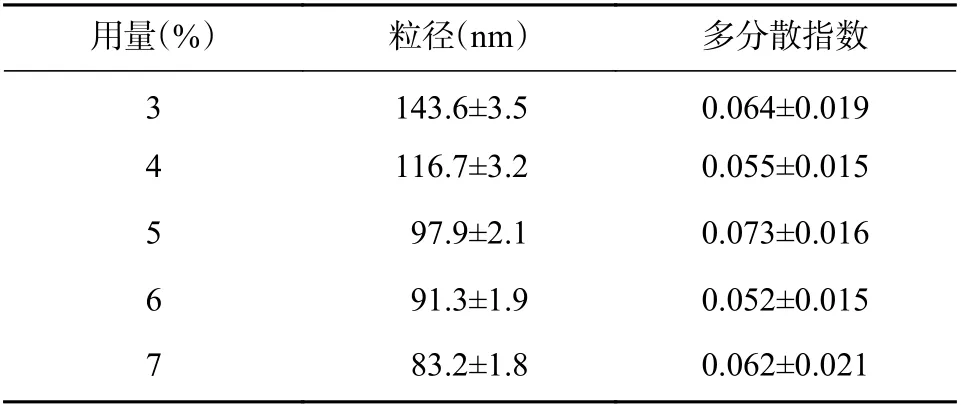
表4 泊洛沙姆407 用量的考察(n=3)
2.5 PPL-Cubs 的包封率影响因素考察
2.5.1 外水相pH 值的考察
根据前期盐酸普萘洛尔在不同pH 的PBS 中溶解度测定结果可知(见表5),盐酸普萘洛尔在pH≥8.5 时溶解度显著下降。按照“2.2.2”项下方法,制备内水相pH 为3.0 的B-Cubs,并按载体/药物比(以单油酸甘油酯/盐酸普萘洛尔计)为6∶1的比例与B-Cubs 和盐酸普萘洛尔水溶液进行混合,以10%氢氧化钠溶液分别调节外水相pH 至7.5、8.0、8.5、9.0,于20 ℃水浴(载药温度)下600 r/min磁力搅拌15 min(载药时间),制得PPL-Cubs 中药物浓度为1%,测定对包封率等参数影响(见表6)。结果表明,PPL-Cubs 的包封率随外水相pH 值的提高逐渐增加,当外水相pH 值≥8.5 时,包封率增加趋势渐小;外水相pH 值对PPL-Cubs 的粒径和多分散指数无明显影响。
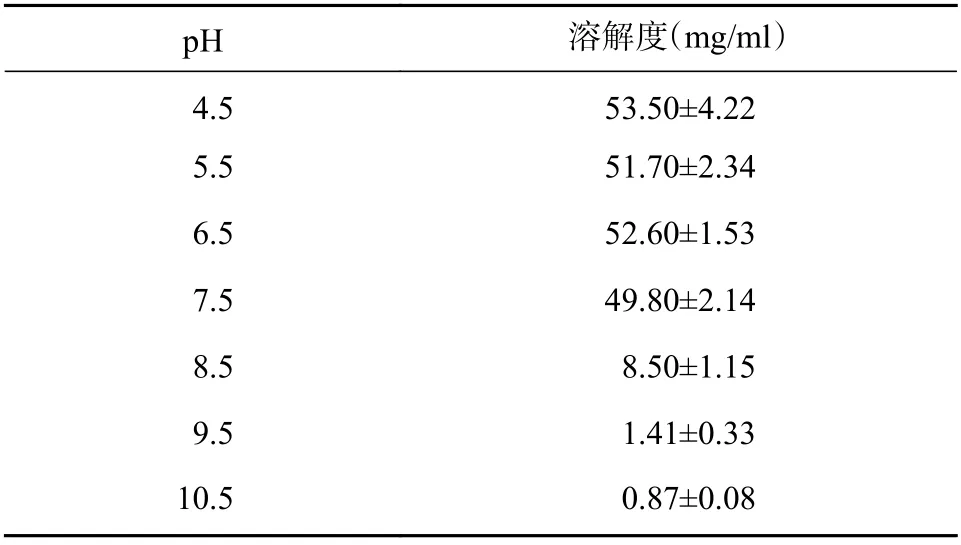
表5 盐酸普萘洛尔在不同pH PBS 中的溶解度(n=3)
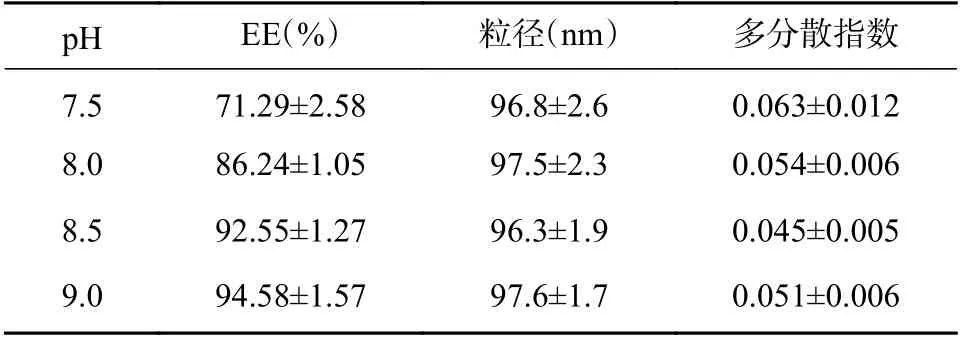
表6 外水相pH 值的考察(n=3)
2.5.2 内水相pH 值的考察
按照“2.5.1”项下方法,固定外水相pH 为8.5 时,分别考察内水相pH(3.0、4.0、5.0、6.0)对制得PPL-Cubs 包封率等参数的影响(见表7)。结果表明,不同内水相pH 的B-Cubs 对制得的PPL-Cubs包封率无明显差异,对PPL-Cubs 的粒径和多分散指数亦无明显影响。

表7 内水相pH 值的考察(n=3)
2.5.3 载体/药物的考察
按照“2.5.1”项下方法,固定外水相pH 为8.5 时,分别考察载体/药物(5∶1、6∶1、7∶1、8∶1)对制得PPL-Cubs 包封率等参数的影响(见表8)。结果表明,当载体/药物≥6 时,PPL-Cubs 的包封率不再增加;载体/药物比值对PPL-Cubs 的粒径和多分散指数无明显影响。

表8 载体/药物的考察(n=3)
2.5.4 载药温度的考察
按照“2.5.1”项下方法,固定外水相pH 为8.5 时,分别考察载药温度(20、30、40、50 ℃)对制得PPLCubs 包封率等参数的影响(见表9)。结果表明,载药温度对PPL-Cubs 的包封率、粒径和多分散指数无明显影响。

表9 载药温度的考察(n=3)
2.5.5 载药时间的考察
按照“2.5.1”项下方法,固定外水相pH 为8.5 时,分别考察载药时间(15、30、45、60 min)对制得PPL-Cubs 包封率等参数的影响(见表10)。结果表明,载药时间对PPL-Cubs 的粒径和多分散指数无明显影响。
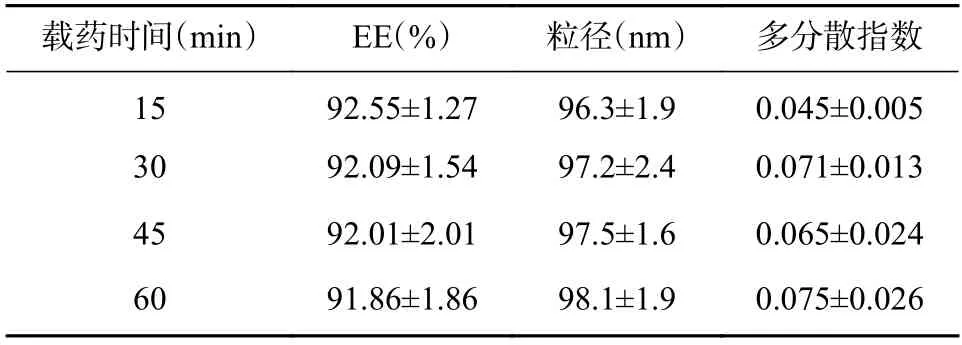
表10 载药时间的考察(n=3)
2.5.6 B-Cubs 粒径和多分散指数的考察
通过调整高压均质压力,制备不同粒径B-Cubs。按照“2.5.1”项下方法,固定外水相pH 为8.5,分别考察B-Cubs 粒径和多分散指数对制得PPL-Cubs包封率等参数的影响(见表11)。结果表明,BCubs 的粒径和多分散指数不影响所制得PPLCubs 的包封率,但B-Cubs 的粒径和多分散指数基本决定了制得PPL-Cubs 的粒径和多分散指数。

表11 B-Cubs 粒径和多分散指数的考察(n=3)
2.5.7 PPL-Cubs 药物浓度的考察
按照“2.5.1”项下方法,固定外水相pH 为8.5,分别考察药物浓度(0.1%、0.5%、1.0%、2.0%、3.0%)对制得PPL-Cubs 包封率等参数的影响(见表12)。结果表明,随着PPL-Cubs 中药物浓度的提高,包封率呈逐渐增加趋势,当药物浓度≥1%时,包封率增加趋势变慢。
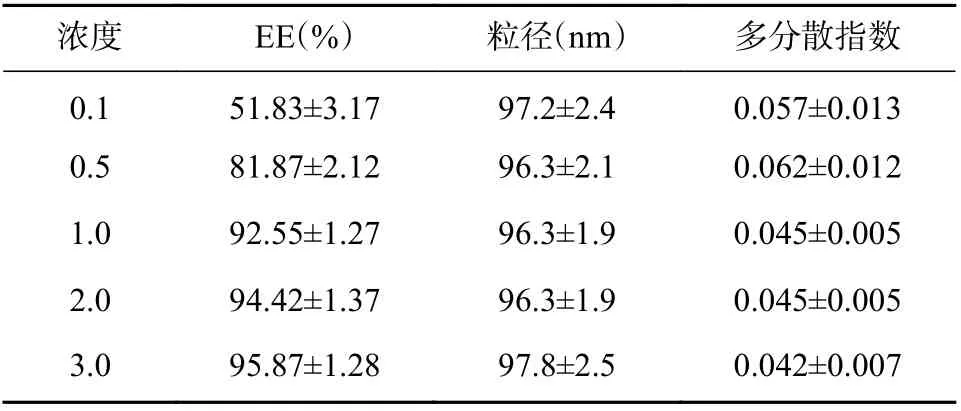
表12 PPL-Cubs 中药物浓度的考察(n=3)
2.6 pH 梯度法制备PPL-Cubs 的最优处方及制备工艺
精密称取单油酸甘油酯25.0 g,40 ℃水浴加热使融化,为A 相;精密称取泊洛沙姆407 5.0 g,加入70 g 纯化水,40 ℃水浴加热使溶解,并用1%磷酸溶液调节pH 至3.0,为B 相;于40 ℃水浴及600 r/min 搅拌速度下,将A 相缓慢滴加到B 相中,待磁力搅拌30 min 后,再在900 bar 下高压均质7 次,得B-Cubs。取盐酸普萘洛尔1 g,溶解于适量纯化水中,得盐酸普萘洛尔水溶液;将盐酸普萘洛尔水溶液加入24 g B-Cubs 中,搅拌均匀,用10%氢氧化钠溶液调节pH 至8.5,于20 ℃水浴持续搅拌15 min,再放置至室温,即得PPL-Cubs
3 讨论
立方液晶纳米粒常用的制备方法包括注入法、熔融-分散法、热处理法、喷雾干燥法等[6]。试验前期以粒径、包封率等为评价指标筛选了最佳制备方法为注入法,并优化了其最佳处方制备工艺,结果制得的载药立方液晶纳米粒包封率较低(约50%)[7]。立方液晶是两亲性脂质分子分散在过量水中形成的含双连续水区和闭合脂质双分子层的蜂窝状液晶结构;水溶性分子被包封于立方液晶水道中,脂溶性分子被包封于脂质双层膜中,两亲性分子则贯穿其中。盐酸普萘洛尔在酸性环境下具有较高的溶解性,常规方法制得的盐酸普萘洛尔立方液晶纳米粒pH 约为3.5,如何让其具有进入立方液晶载体内相的“动力”是提高载药立方液晶纳米粒包封率的关键。因此,本研究引入“pH 梯度法”,通过创造高溶解度内环境(低pH 值内水相)和低溶解度外环境(高pH 值外水相),给盐酸普萘洛尔提供进入立方液晶载体内相的“动力”。离子化的盐酸普萘洛尔在调节pH 的过程中逐渐变为分子形态的普萘洛尔而进入脂质区,脂质区的普萘洛尔分子接触内水相酸性环境而被离子化,内水相中离子化的盐酸普萘洛尔无法再通过脂质区而被捕获于内水相。结果表明,pH 梯度法显著提高了PPL-Cubs 的包封率,包封率达到90%。

