脓毒症生物标志物的最新进展
赵景昕,缪朝玉,徐添颖,b (海军军医大学:. 药理学教研室, b. 麻醉药理学教研室,上海 200433)
脓毒症是因感染反应失调而导致的危及生命的器官功能障碍,其发病率和死亡率很高。根据柳叶刀杂志最新报道,2017 年全球记录的脓毒症病例为4 890 万例,与脓毒症相关的死亡为1 100 万例,约占全球所有死亡病例的20%[1]。发达国家如美国每年脓毒症病例约为170 万例,与脓毒症相关的死亡约27 万例[2]。在低收入及中等收入的国家,脓毒症更是重症监护病房(ICU)患者的主要死亡原因,死亡率高达80%[3]。世界卫生组织已经认识到脓毒症对全球健康的重大威胁,并加强了对脓毒症的预防、诊断和治疗[4]。尽管如此,脓毒症的死亡率依然很高,主要原因之一是目前并没有诊断脓毒症的金标准,临床缺乏早期诊断和病情预测的手段。传统的标准微生物培养方法非常耗时,且有相当比例的假阴性结果。降钙素原(PCT)是唯一写进临床指南的脓毒症标志物,可用于指导抗生素的使用,但并不具有独立诊断的能力。C 反应蛋白(CRP)作为传统的炎性指标,其诊断特异性较差。为了给临床提供准确及时的诊断及预后标准,脓毒症标志物一直是研究热点。本文对近年来关注度较高的、新的脓毒症候选生物标志物进行了综述,主要包括急性期蛋白、可溶性受体、非编码RNA和其他候选标志物。
1 急性期蛋白
1.1 正五聚蛋白-3(pentraxin-3,PTX-3)
PTX-3 作为正五聚蛋白(pentraxins,PTX)长五肽亚家族的一员,由脂多糖(LPS)等微生物成分或炎性细胞因子刺激分泌,可以参与髓系细胞对病原体的识别,通过产生抗微生物微环境发挥抵抗作用[5]。
PTX-3 的产生不依赖肝脏,在反映快速炎症过程方面优于传统的生物标志物。多项研究已经证明其较好的诊断价值[6-8],认为其诊断能力并不弱于PCT 和CRP 。
PTX-3 还被认为可以作为脓毒症的预后标志物,既是28 d 死亡率的独立相关因素[9],也可以预测脓毒症休克[10]。除此之外,Hu 等[11]的研究认为PTX-3(AUC=0.78)在预测28 d 死亡率方面优于PCT 和乳酸,并提出将PTX-3、PCT 和乳酸作为一组标志物能更好的预测死亡率(AUC=0.90,95%CI 0.83~0.94),这也为多种生物标志物的联合应用指明了方向。
1.2 肾上腺髓质素(ADM)与中区肾上腺髓质素(MR-proADM)
肾上腺髓质素(ADM)来源于更大的前体肽(Pro-ADM),MR-proADM 是其活性形式。LPS、细胞因子和缺氧刺激导致的感染会促进ADM 的合成和分泌。在脓毒症过程中,ADM 既可以通过cAMP 介导血管扩张作用,也具有稳定内皮屏障和抗菌抗炎的作用。在脓毒症休克时ADM 水平可上升20~30 倍。脓毒症患者初诊ADM 浓度升高与血管活性药物需求增加、器官衰竭恶化和死亡率增加有关。值得注意的是,内源性ADM 水平在高血压、缺血、内分泌和代谢紊乱等情况下也会增加。
有研究表明,在贯序器官衰竭评估(SOFA)评分阴性的情况下,MR-proADM 同样具有重要的诊断意义,且与器官衰竭和28 d 死亡率显著相关[12-13]。值得注意的是,Buendgens 等[14]发现了ADM 在长达26 个月的随访中仍具有死亡率预测价值。
Daga 等[15]发现女性脓毒症患者血清ADM 水平升高更为明显,且女性患者的死亡率更低,认为主要原因是ADM 发挥了作为神经激素的正面保护作用。而后Ajith[16]对此文章发表了评论,虽然肯定了初诊ADM 水平对血管活性药物需求、恶化的器官功能障碍和死亡率的预测能力,但ADM 与脓毒症的利害关系尚需继续研究。有趣的是Daga等[17]也对此评论做出了回复,进一步解释并坚持其原有看法。
2 可溶性受体
2.1 可溶性白细胞分化抗原14 亚型(sCD14- ST,Presepsin)
CD14 是单核细胞和巨噬细胞等免疫细胞表面的LPS 受体,Presepsin 是机体感染后产生的可溶性CD14 亚型。多项研究已经表明Presepsin 具有诊断脓毒症的能力[18],但关于Presepsin 对预后的预测能力尚有争议。有研究称Presepsin 与免疫功能低下的脓毒症患者的预后相关,而PCT 与不良预后无明显相关性,究其原因,可能是生物标志物产生机制的不同,PCT 是由LPS 和某些细胞因子诱导的,而Presepsin 的产生则并不依赖LPS 和细胞因子,这也解释了一些研究者发现Presepsin 在小鼠盲肠结扎穿孔(CLP)模型中升高,而在LPS 模型中无明显变化[19]。有趣的是,Kaplan 等[20]提出Presepsin 与白蛋白的比值具有更好的脓毒症预后的预测能力。在预测脓毒症并发症方面,除了脓毒症休克, Presepsin 还可预测脓毒症急性肾损伤、急性呼吸窘迫综合征、弥散性血管内凝血[21]。另外,Presepsin 是革兰阴性菌细胞壁中LPS 的受体之一,全血与细菌共培养结果表明革兰阴性菌诱导的Presepsin 水平高于革兰阳性菌,说明Presepsin具有鉴别细菌感染种类的潜能[22]。
2.2 可溶性髓样细胞触发受体-1(sTREM-1)
髓样细胞触发受体-1(TREM-1)表达于髓系细胞表面,在细菌和真菌感染时表达显著增加,具有炎症放大器的作用。sTREM-1 作为TREM-1 的可溶性形式,可以代表TREM-1 的激活情况,被认为是脓毒症的诊断和预测的候选生物标志物。
多项研究认为sTREM-1 具有诊断脓毒症的作用,但诊断能力仍有争议[23-24]。荟萃分析显示sTREM-1 对脓毒症的诊断能力中等,需要更多的大规模研究来进一步评估sTREM-1 的诊断准确性[25]。除此之外,sTREM-1 还被发现表达于内皮细胞和血小板,在非感染性炎症中以及心血管手术后甚至非病理状态下也会升高[26]。因此,血浆sTREM-1作为脓毒症诊断标志物仍需继续研究。
sTREM-1 作为脓毒症的预后标志物似乎更有希望,Gibot 等[27]认为sTREM-1 是与预后相关的独立因素。多项研究描述了类似的结果,并且Zhang等[28]认为血清sTREM-1 浓度比CRP 和PCT 更准确地反映脓毒症的严重程度,对脓毒症预后的动态评估更敏感。Charles 等[29]的一篇高质量研究也提供了有力证据,认为与PCT 和CD64 相比,sTREM-1是更为理想的预后标志物。
2.3 可溶性尿激酶型纤溶酶原激活物受体(SuPAR)
尿激酶型纤溶酶原激活物受体(uPAR)是尿激酶型纤溶酶原激活物的膜结合型受体。SuPAR 是其可溶性形式,广泛存在于体液中。当身体处于炎症或其他疾病状态时,激活的免疫细胞尤其是中性粒细胞使SuPAR 水平显著上调,其浓度与免疫系统活动呈正相关[30]。
在鉴别脓毒症和全身炎症反应综合征(SIRS)方面,SuPAR 表现出了比PCT 更好的鉴别能力(AUC 0.89 vs 0.82),但在预测脓毒症患者死亡率方面PCT更具优势[31]。
SuPAR 的预后价值研究更为广泛。希腊的脓毒症研究小组在2020 年报道,SuPAR<4 ng/ml 被认为可以安全出院,SuPAR>6 ng/ml 是不良结果的警示信号,SuPAR>12 ng/ml 的患者28 d 死亡率在17%~50%[32]。一项法国学者[33]的前瞻性、多中心的国际研究表明,SuPAR 联合可溶性血管内皮生长因子受体-2(sVEGFR2)对早期病情恶化有较好的预测能力(AUC=0.70)。Pregernig 等[34]的一项纳入44 项研究的荟萃分析肯定了SuPAR 预测死亡率的作用,得出临界值为5.2 ng/ml (95% CI 4.5~6.0,P<0.01)。2020 年的一篇综述,系统地回顾分析了SuPAR 的脓毒症诊断和预后价值,共纳入30 项研究的6 906 名患者,认为SuPAR 具有诊断脓毒症(AUC=0.83)、预测死亡率(AUC=0.78)以及鉴别脓毒症与SIRS 的作用(AUC=0.81)。与以往Meta 分析确定的PCT 有效性相比,SuPAR 具有相似的临床指导价值,但SuPAR 表现出更高的特异性,有助于弥补PCT 的不足[30]。
3 非编码RNA
3.1 微小核苷酸(MicroRNA,miRNA)
miRNA 是由20 到24 个核苷酸组成的非编码RNA,可与靶mRNA 结合减少蛋白质表达甚至导致转录沉默。在应激条件下,miRNAs 可通过对多个靶标的协同效应来改变细胞反应,精细调节基因表达的模式[35]。近年来陆续有学者发现了miRNAs的脓毒症诊断和预测作用。
在诊断方面,miR-16a 作为新生儿败血症的诊断标志物,可抑制IL-6 和TNF-α 等促炎因子的mRNA表达,并促进IL-10 等抗炎因子mRNA 表达[36]。miR-328 也表现出了较好的诊断潜能(AUC=0.926),抑制miR-328 的表达水平可以改善脓毒症患者的心功能障碍和心脏炎症[37]。Hermann 等[38]的研究表明,miR-193a-5p 和miR-542-3p 可用于鉴别非感染性疾病和感染性疾病(社区获得性肺炎或脓毒症),miR-1 246 的表达水平随着疾病严重程度的增加而发生显著变化,从而鉴别健康人群、社区获得性肺炎和脓毒症。
在预测方面,循环miR-10a 水平可以区分脓毒症和感染,并预测28 d 的死亡率。脓毒症患者miR-223 的表达与APACHE II 评分(P<0.001,r=0.526)和SOFA 评分(P<0.001,r=0.390)呈正相关。脓毒症患者外周血单个核细胞miR-10a 水平降低,且与病情严重程度呈负相关[39]。另外,在28 d 内死亡的患者中,miR-223 的表达高于28 d 的幸存者[40]。
此外,miRNAs 在预测脓毒症并发急性肾损伤方面具有独特作用。脓毒症患者其血、尿miR-22-3p 水平都会降低,可预测急性肾损伤和28 d 生存率[41]。血清 miR-21-3p 联合实验室指标对脓毒症并发急性肾损伤具有较高的预测价值(AUC=0.962)[42]。
Chen 等[43]综述了miR-155 与脓毒症的相关性,对比多项研究,肯定了循环miR-155 作为诊断标志物和预后标志物的作用,但入院后48 h 循环miR-155 明显下降,表明miR-155 的上调仅存在于脓毒症早期。需要注意的是,Link 等[44]提出了不同意见,在对miR-26b-5p、miR-122-5p、miR-143-3p、miR-146a-5p、miR-193-3p、miR-223-3p 研究之后,并没有发现独立的miRNAs 能够明确区分脓毒症和非脓毒症ICU 患者,认为miRNAs 的诊断能力并不优于现行评分系统。
3.2 长链非编码RNA(lncRNA)
lncRNA 是一类超过200 个核苷酸的RNA,通过调控靶基因的表达广泛参与细胞的增殖、分化和凋亡[42]。有结果显示脓毒症患者的血浆中多种lncRNA表达增加至28~70 倍,单纯的LPS 诱导也有相同的结果[45]。
lncRNA 肺腺癌转移相关转录因子1( MALAT1)已被证明通过抑制NF-кB 活性来调节LPS 刺激的促炎细胞因子TNF-α 和IL-6 的表达[46]。一项对120 名脓毒症患者进行的前瞻性队列研究显示,lncRNA MALAT1 具有诊断脓毒症的价值(AUC=0.910),对脓毒症休克和死亡率也有较好的预测能力[47]。 lncRNA 锌指蛋白反义链1(zinc finger antisense 1,ZFAS1)被认为与类风湿性关节炎和急性心肌梗死等炎症性疾病有关,Xu 等[48]发现lncRNA ZFAS1对脓毒症也有较好的诊断(AUC=0.814)和预测死亡率(AUC=0.628)的能力。
其余lncRNA 多在预后方面起预测作用。lncRNA富含丰富的转录本1 (nuclear-enriched abundant transcript 1,NEAT1)是核体类斑点结构的重要组成部分,调节IL-8 等抗病毒基因的表达,在先天免疫反应中发挥重要作用。脓毒症患者中lncRNA NEAT1水平的升高与APACHE II 和SOFA 评分呈正相关,并与不良预后相关[49-50]。lnc 母系表达基因3 (maternally expressed gene 3 ,MEG3)的水平也与炎症反应和器官损伤程度正相关,通过作为多种miRNAs 的分子海绵即长效竞争性抑制剂发挥作用,如miR-21。近期一项纳入219 名脓毒症患者和219 名健康对照者的研究中,对入院后24 h 内采集的血浆样本中lnc-MEG3 和miR-21 含量进行分析,发现lnc-MEG3(AUC=0.887)和 lnc-MEG3/miR-21 比值 (AUC=0.934)对预测脓毒症风险升高有较好的预测价值,而miR-21(AUC=0.801)对脓毒症风险降低有较好的预测价值[51]。与之相反,脓毒症患者lncRNA 牛磺酸上调基因1 (taurine up-regulated 1,TUG1)的表达与急性生理与慢性健康评分(APACHE II)和序贯器官衰竭评分(SOFA)呈负相关,28 d 死亡组的lncRNA TUG1 表达低于28 d 存活组[40]。
4 其他生物标志物
4.1 钙保护素
钙保护素是一种异源二聚体钙结合蛋白,高表达于髓系细胞的胞浆中。近期的两项研究[52-53]都认为钙保护素对脓毒症有较好的诊断效能。有趣的是,Wirtz 等[54]提出初诊钙保护素高水平可能与死亡风险相关,而入院后钙保护素水平的升高则与长期良好结局相关。
4.2 中性粒细胞白细胞分化抗原64(nCD64)
nCD64 又称高亲和力Fcγ 受体I,在中性粒细胞中静息状态下水平很低,在感染过程中被炎性因子上调。近期一篇纳入133 名患者的研究[55]表明,nCD64 对诊断新生儿脓毒症的敏感度为94.7%,特异度为93.6%,AUC 值为0.925。Hashem 等[56]关于诊断作用也得出了类似的结论(AUC=0.922)。我国学者2020 年的一项研究[57]同样表明nCD64在诊断和预测死亡率方面均优于PCT。
4.3 肠道微生物群
肠道是所有人体部位中微生物分布最密集和异质性最强的部位,肠道微生物群被认为是糖尿病、肝硬化、癌症和动脉粥样硬化等疾病发生发展的生物标志物。脓毒症会损害肠道微生物群的完整性,肠道微生物群也会影响脓毒症和器官衰竭的进程。根据El MEHS 等[58]的报道,肠道微生物群检测可在发病前1 天预测迟发性脓毒症的发生(AUC=0.78)。Agudelo 等[59]发现脓毒症患者的肠道微生物群特征为副杆菌属、梭杆菌属和嗜血杆菌属等炎症相关微生物的增加,认为其可以预测脓毒症的发展,尤其是肠球菌种类的丰富度可能是脓毒症潜在的预后生物标志物。遗憾的是,近期的一项纳入150 名患者的前瞻性队列研究[60]表明微生物多样性降低与死亡率的增加无关。而且饮食、抗生素和其他治疗手段都会引起肠道微生物群的变化,肠道微生物群作为脓毒症的生物标志物前景并不乐观。
4.4 血管生成素
血管生成素(Angpt)是血管生成生长因子家族中的一员,由血管内皮细胞在炎症等应激条件下分泌。Angpt-1 发挥稳定血管内皮和抗炎的正面作用,而Angpt-2 对Angpt-1 产生竞争性拮抗作用[61]。Angpt-2 可能具有预测脓毒症休克的能力(AUC=0.631)[10]。Angpt-2/Angpt-1 的比值也具有预测作用,据韩国的一项报道[62],Angpt-2/1 预测28 d 死亡率的能力与SOFA 评分无显著差异(AUC 0.736 vs 0.745 )。
5 小结
本文综述的急性期蛋白、可溶性受体、非编码RNA 和其他的标志物的作用及效能如表1 所示。早期诊断和正确治疗是降低脓毒症病死率的关键。但由于脓毒症病理生理机制复杂,个体差异较大,体征和症状无特异性,早期诊断极为困难。目前被研究的诊断标志物主要参与先天免疫反应的初始发病机制,预后标志物通常与脓毒症引起的器官功能障碍有关。这些候选标志物在脓毒症发病机制中的作用以及最佳联合使用策略,都需要进一步的研究,以供将来的临床使用。
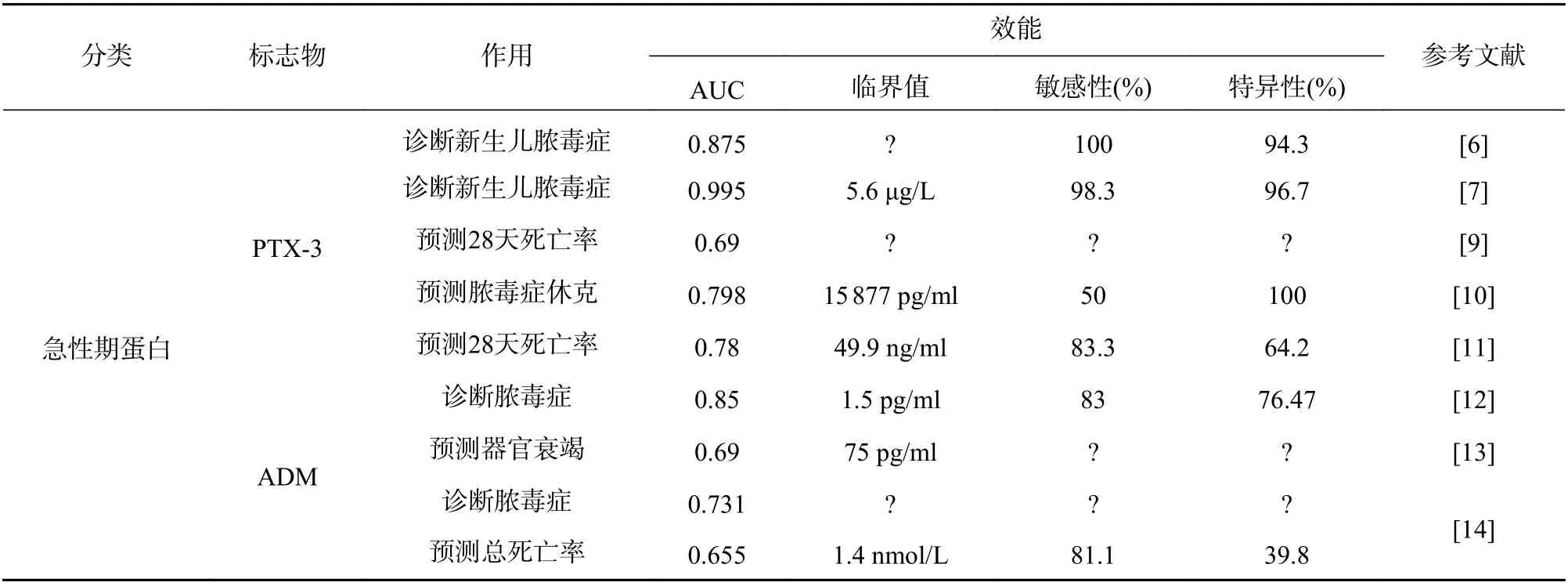
表1 脓毒症生物标志物作用及效能比较
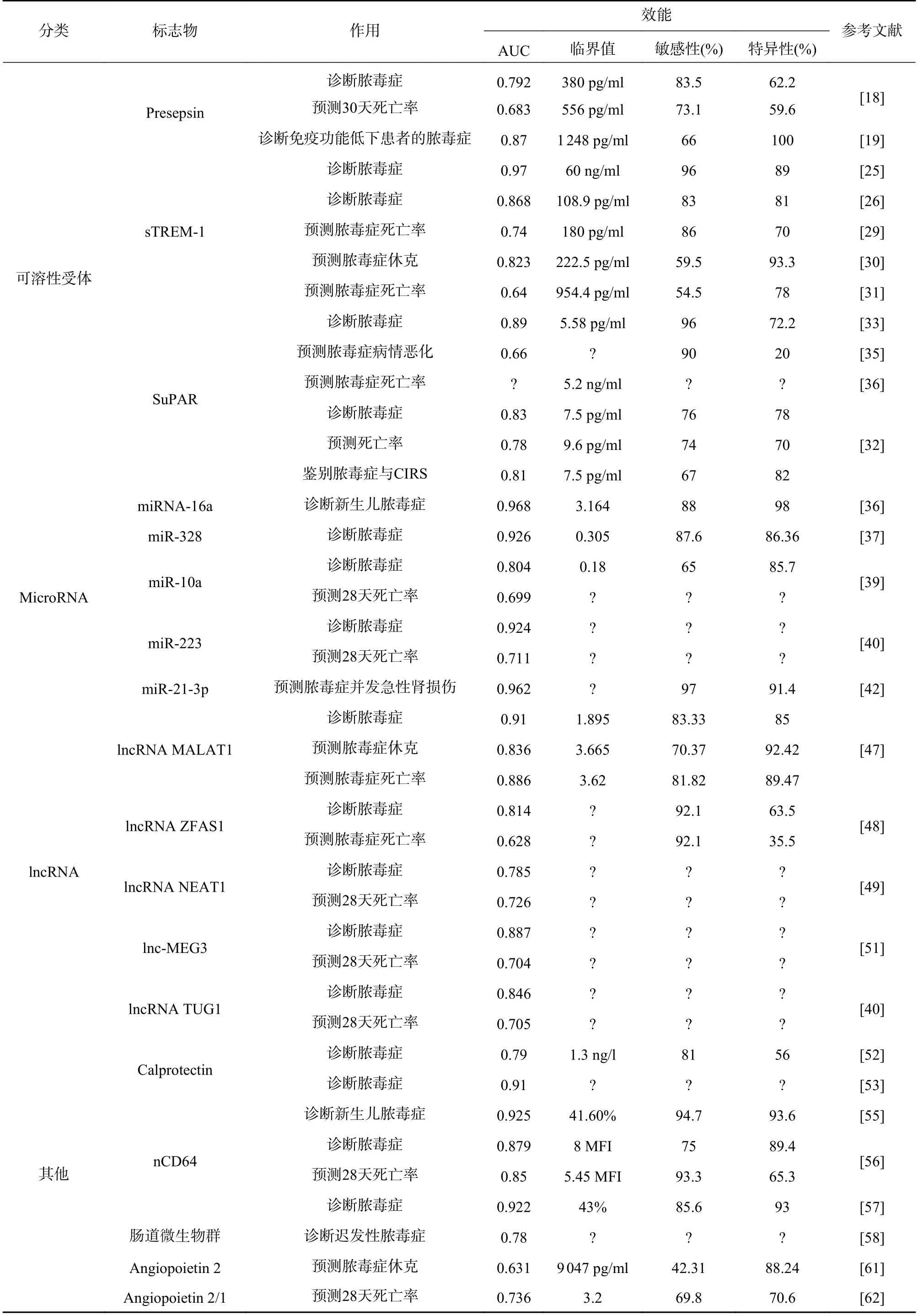
(续表1)

