Fe3O4@SiO2@mSiO2介孔磁性纳米材料的制备及其氨氮吸附性能
万秋月,杜康婷,苏鹏鑫,霍婷婷,2,刘孟清,张津语
(1. 西南科技大学 环境与资源学院,四川 绵阳 621010;2. 固体废物处理与资源化教育部重点实验室,四川 绵阳 621010)
随着工农业的大力发展,越来越多未经处理的含氮废水直接排入河道、湖泊甚至海洋,促使水中藻类及其他微生物大量繁殖,导致水中溶解氧下降,加剧了水体富营养化进程,并危害人类生存及健康[1-5]。因此,如何去除废水中的氨氮,已成为亟待解决的问题。目前,处理氨氮废水的主要方法有物化法和生物法两大类。物化法包括氧化法、空气吹出法、膜处理法、折点氯化法、化学沉淀法及选择性离子交换法等[6-11]。其中:折点氯化法处理效率高,效果稳定,不受温度影响,但氯费用较高,只适用于处理低浓度氨氮废水[12-13];化学沉淀法反应速率快,但沉淀剂价格昂贵且可能引入二次污染[14-15];膜析法处理效果佳,但高浓度氨氮易造成膜堵塞,费用较高[16-17]。而生物法可去除多种含氮化合物,二次污染小且比较经济,但其工艺占地面积大,对碳源要求高,低温时去除效率较低[18-19]。
为了克服上述问题,引入吸附能力强、可回收的工程纳米材料被认为是一个很有前途的解决方案。磁性纳米材料因其体积小、比表面积大、活性中心多、易分离等优点被广泛用于重金属吸附等研究,逐渐成为新一代环境污染控制材料[20-27]。相对于传统吸附剂而言,有序的介孔材料具有高比表面积、可控的介观结构、均一可调的大孔径等特性,被认定为新一代优良吸附剂。根据国际纯粹与应用化学协会(IUPAC)的定义,微孔孔径为小于2 nm,介孔孔径为2~50 nm[28-29]。但目前关于介孔磁性纳米材料吸附处理氨氮的研究还鲜有报道。
本工作制备了Fe3O4@SiO2@mSiO2介孔磁性纳米材料,运用多种手段对其进行了表征,探讨了废水pH、初始氨氮浓度、吸附时间和吸附剂用量等环境条件对氨氮吸附的影响,并对其吸附动力学和热力学进行了研究,以评价该材料吸附和去除水中氨氮的潜力,探索有效去除水体中氨氮的高效便捷方法。
1 实验部分
1.1 试剂和仪器
实验所用试剂均为分析纯,实验用水为去离子水。
可见光分光光度计(722s型,上海棱光技术有限公司);实验室pH计(PHSJ-3F型,上海仪电科学仪器股份有限公司);扫描电子显微镜(S4800型,日本日立公司)、傅里叶变换红外光谱仪(Magna 550II型,美国Nicolet公司);X射线衍射仪(XRD-6000型,日本岛津公司)、场发射透射电子显微镜(Tecnai G2 F20/F30型,美国FEI公司);振动样品磁强计(BKT-4500Z型,北京泽天伟业科技有限公司);比表面及孔径分析仪(JW-BK112,北京精微高博科学技术有限公司)。
1.2 复合纳米材料的制备
采用水热法及改良Stöber法制备Fe3O4@SiO2@mSiO2介孔磁性纳米材料[30-32]。
1.2.1 Fe3O4磁性纳米球的制备
将3.799 g FeCl2·4H2O和7.028 g FeCl3·6H2O加入150 mL去离子水中,在1000 r/min磁力搅拌下均匀混合。向其中缓慢滴入1 mol/L NaOH溶液,待完全变黑后调节pH为11,在70 ℃水浴条件下反应4 h。自然冷却至室温后利用磁铁进行分离,用去离子水和无水乙醇交替洗涤3次,再置于60 ℃烘箱中干燥12 h,研磨即得Fe3O4磁性纳米球。
1.2.2 Fe3O4@SiO2磁性纳米球的制备
将4.000 g Fe3O4磁性纳米球在100 mL 0.l mol/L HCl溶液中超声分散15 min,固液分离后用去离子水洗涤3次,再利用超声手段使其均匀分散在160 mL无水乙醇、40 mL去离子水和5 mL 28%(w)氨水的混合溶液中。剧烈搅拌,并逐滴滴入10 mL正硅酸乙酯(TEOS),在50 ℃水浴条件下反应6 h。利用磁铁进行分离,用去离子水和无水乙醇交替洗涤3次,再置于60 ℃烘箱中干燥12 h,研磨即得Fe3O4@SiO2磁性纳米球。
1.2.3 Fe3O4@SiO2@mSiO2介孔磁性纳米球的制备
以十六烷基三甲基溴化铵(CTAB)作为碱性体系中的表面活性剂模板,采用油水两相分层的方法,在Fe3O4@SiO2纳米球表面包覆介孔硅壳(mSiO2)。首先,将制得的0.150 g Fe3O4@SiO2磁性纳米球置于三口烧瓶中,加入36 mL H2O、24 mL 25%(w)CTAB水溶液和0.18 mL三乙醇胺,超声处理0.5 h,并于60 ℃水浴中搅拌1 h。然后,将20 mL TEOS与200 mL环己烷制成的混合溶液轻轻滴入上层溶液中,并用冷凝管覆盖,在回流条件下60 ℃水浴机械搅拌(200 r/min)反应12 h,利用磁选法收集产物,用去离子水和无水乙醇先后反复洗涤3次,置于60 ℃烘箱干燥12 h,取出研磨。最后,采用离子交换法去除模板剂CTAB:将所得产物超声分散于6.0 g/L硝酸铵-乙醇溶液中,60 ℃水浴搅拌2 h,重复5次;磁铁分离,用去离子水和无水乙醇交替洗涤3次,60 ℃真空干燥6 h,即得Fe3O4@SiO2@mSiO2介孔磁性纳米球。
1.3 吸附实验方法
取一定浓度的氨氮溶液(NH4Cl和去离子水配置)50 mL于锥形瓶中,用0.1 mol/L HCl溶液和NaOH溶液调节pH至设定值,投加一定量的Fe3O4@SiO2@mSiO2介孔磁性纳米材料,在一定温度下以170 r/min转速振荡吸附一段时间,磁力分离后取上清液待测。
1.3 分析方法
采用纳氏试剂分光光度法[33],于420 nm波长下用可见光分光光度计测定溶液的氨氮浓度,根据吸附前后的氨氮浓度计算其去除率。
运用SEM,TEM,FTIR,XRD,VSM,BET等手段对复合材料进行表面形貌、官能团、物相结构、磁性能、孔结构等的表征。
2 结果与讨论
2.1 材料的表征结果
2.1.1 SEM和TEM
图1a~c分别为制备所得Fe3O4,Fe3O4@SiO2,Fe3O4@SiO2@mSiO2的SEM照片。由图1a可知,水热法制备的Fe3O4呈均匀球状,粒径分布均一,但呈现明显团聚现象,单颗粒的尺寸约为30 nm。由图1b可知,包覆SiO2后,纳米复合材料Fe3O4@SiO2呈现均匀球状,硅层约为90 nm厚,表面呈现小孔隙结构,分散性良好。由图1c可知,本实验在以CTAB作为活性剂模板,以TEOS为反应原料,通过其在油水两相界面的水解反应,成功合成介孔硅球,使得纳米球粒径明显增大,通过外层SiO2壳厚度均匀增加,形成更规则的球状复合纳米材料,平均直径约为200 nm[34]。
TEM照片如图1d~f所示。由图1d~f可清晰观察到Fe3O4@SiO2@mSiO2的内部结构,黑色部分为Fe3O4核,灰色部分为SiO2壳层,可见黑色的Fe3O4核被灰色的SiO2壳层所包覆,且核壳纳米球界面清晰,复合纳米粒子呈现明显的核壳结构。磁性内部结构与多个壳层相结合,提供了多个微环境,以防止结构坍塌,并增加反应接触面积。

图1 制备材料的SEM(a~c)和TEM(d~f)照片
2.1.2 FTIR、XRD、BET和VSM
制备材料的FTIR谱图如图2所示。在Fe3O4的谱图中,3383 cm-1处的特征吸收峰为颗粒表面水分的伸缩振动峰,1636 cm-1及560 cm-1分别对应—OH的弯曲振动及Fe—O的伸缩移动。当Fe3O4表面包覆了SiO2后,Fe—O的特征峰由560 cm-1移至550 cm-1处,发生了“红移”。此外,959 cm-1的振动峰归因于层间≡Si—OH振动,在1167 cm-1处的强吸收峰为Si—O—Si的反对称伸缩振动吸收峰,798 cm-1处的吸收峰归属于Si—O—Si的对称伸缩振动和弯曲振动,说明SiO2壳成功包覆在了Fe3O4表面。

图2 制备材料的FTIR谱图
图3为制备材料的XRD谱图。从图中可以看出,Fe3O4,Fe3O4@SiO2,Fe3O4@SiO2@mSiO2在2θ为30.2°、35.6°、43.2°、53.4°、57.1°和62.7°处均出现特征衍射峰,通过与标准卡片PDF#88-0866的比较,发现这些峰分别对应反尖晶石型纳米Fe3O4的(220)、(311)、(440)、(331)、(422)和(511)晶面的特征衍射峰。Fe3O4@SiO2和Fe3O4@SiO2@mSiO2在2θ为20°~30°之间有一明显的非晶衍射峰,说明SiO2壳成功包覆在了Fe3O4表面。

图3 制备材料的XRD谱图
图4为制备材料的N2吸附-脱附等温线。根据IUPAC分类3种材料的等温线均可归类为Ⅱ型,Fe3O4的等温线具有H3型回滞环,而Fe3O4@SiO2和Fe3O4@SiO2@mSiO2的等温线具有H4型回滞环,表明3种材料中的孔为狭缝状孔[35]。相对压力低于0.40时,3种材料的等温线重叠,表明存在少量微孔和单层吸附。N2吸附量在相对压力高于0.40后迅速增加,且在相对较高压力下观察到H3(Fe3O4)和H4(Fe3O4@SiO2和Fe3O4@SiO2@mSiO2)型滞后,这是因为在Fe3O4中存在大孔和介孔的多层吸附作用,而在Fe3O4@SiO2和Fe3O4@SiO2@mSiO2中存在介孔和微孔的多层吸附作用,且3种材料中均存在毛细作用[36]。制备材料的比表面积和孔径如表1所示,随着复合材料的层数增加,材料的比表面积逐渐增大,为氨氮的吸附提供了更多的吸附位点,材料的孔径随复合层数增加而变小。
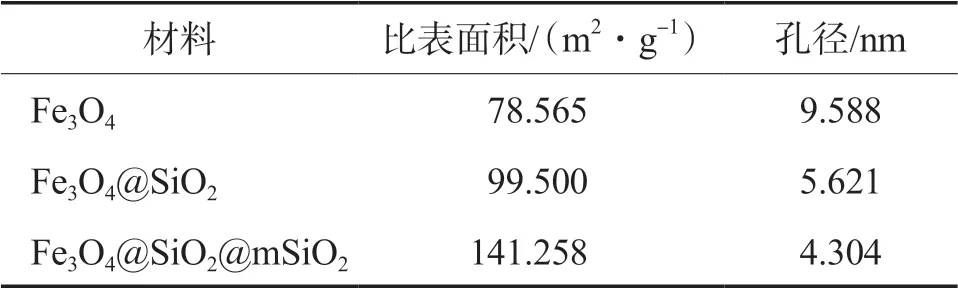
表1 制备材料的比表面积和孔径
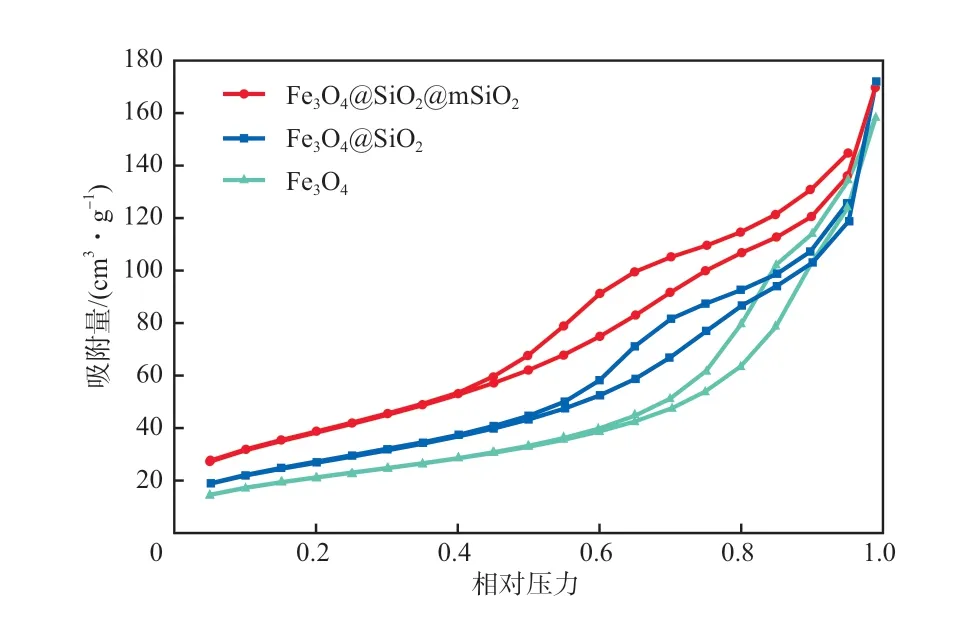
图4 制备材料的N2吸附-脱附等温线
制备材料的磁滞回线如图5所示。Fe3O4,Fe3O4@SiO2,Fe3O4@SiO2@mSiO2纳米材料的饱和磁化强度分别为0.481,0.217,0.466(104·A·m2/kg)。当没有外磁场时,宏观磁化强度为零,磁性纳米材料几乎没有磁滞现象,这表明球体是超顺磁的。当Fe3O4@SiO2@mSiO2介孔磁性纳米材料在氨氮溶液中分散后,在烧杯旁放置磁铁,发现在较短的时间内材料全部聚集在烧杯近磁铁旁,证明该材料可以通过磁场进行彻底分离。SiO2包覆在Fe3O4球表面上后,磁性Fe3O4球占比下降,使得复合粒子的饱和磁化强度下降。随着第3层大分子介孔SiO2的包覆,介孔孔隙打开,样品的饱和磁化强度回升,可见包覆后的复合材料仍具有良好的超顺磁性。当磁性物质尺寸较小,且受到热骚动影响时,这些纳米粒子会随机地改变方向。由于本材料具有超顺磁性,且饱和磁感化强度为0.466(104·A·m2/kg),故随着磁场的增强,材料的磁性可随之增强。该特性可使得材料在较弱的磁场条件下实现材料从废水中移除,避免了材料对水体的污染,便于后续材料的再生处理,以实现材料的可重复利用。
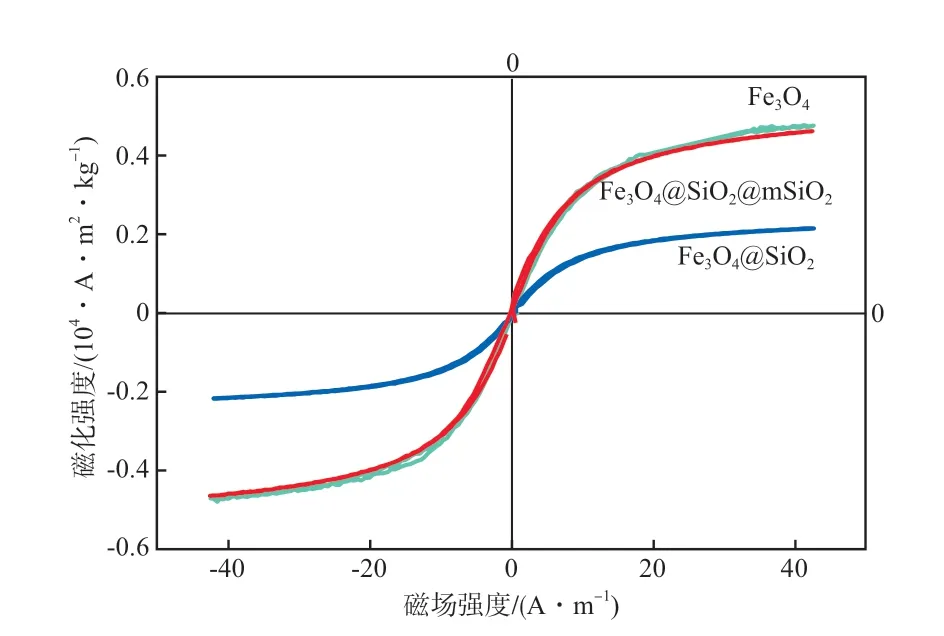
图5 制备材料的磁滞回线
2.2 氨氮吸附效果的影响因素
2.2.1 吸附剂投加量
投加Fe3O4@SiO2@mSiO2至30 mg/L氨氮溶液中,室温下(30 ℃)吸附120 min,吸附剂投加量对氨氮吸附效果的影响如图6所示。随着吸附剂投加量从0.1 g/L增至0.6 g/L,纳米复合材料对水中氨氮的去除率增加,氨氮去除率由35.88%增至83.24%,而吸附量从107.65 mg/g逐渐减至45.39 mg/g。这是因为随着投加量的增加可供吸附的活性点位增加,被吸附的吸附质总量随之增加;与此同时,载体数目的增多会增加吸附反应的位置,在短时间内更易达到吸附平衡,形成竞争吸附,使得吸附量逐步降低。为了同时保持较高吸附量和去除率,后续实验选择吸附剂投加量为0.4 g/L。

图6 吸附剂投加量对氨氮吸附效果的影响
2.2.2 溶液pH
溶液pH可改变吸附剂表面的电荷和吸附质在水中的形态,从而影响吸附剂在水中的吸附能力,不同溶液pH条件下(30 mg/L氨氮溶液,室温下吸附120 min),Fe3O4@SiO2@mSiO2介孔磁性纳米材料对氨氮的吸附如图7所示。随着溶液pH的增加,氨氮的去除率和吸附量均先快速上升再缓慢下降,最后保持稳定。当溶液pH为4时,氨氮去除率增至最大值84.43%,吸附量增至最大值63.32 mg/g。
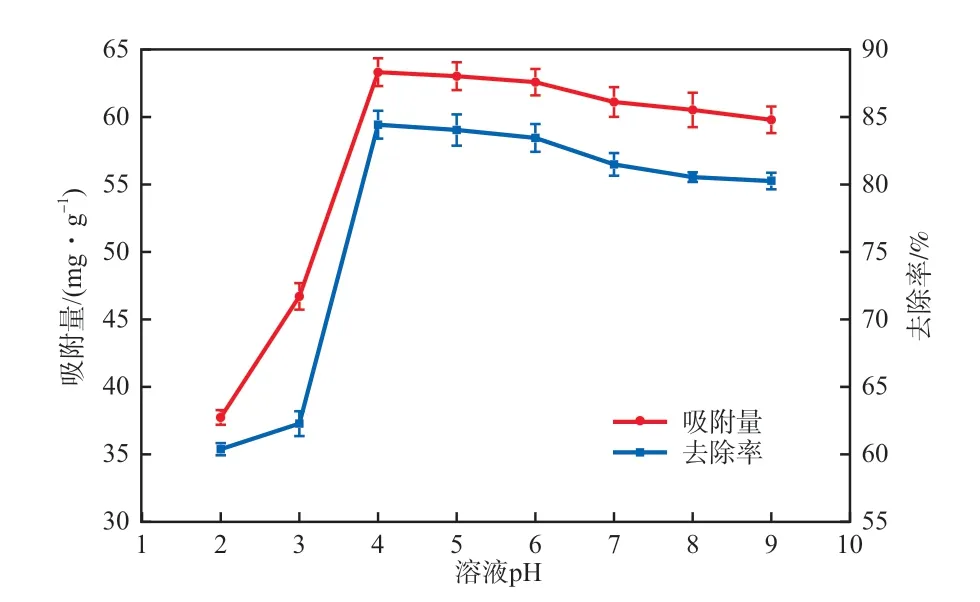
图7 溶液pH对氨氮吸附效果的影响
在不同pH条件下,氨氮的存在形式及Fe3O4@SiO2@mSiO2介孔磁性纳米材料表面基团的吸附作用均存在差异性。当pH在2~6时,溶液中的氨氮存在形式主要为,溶液中的H+与竞争吸附剂表面的吸附位点,随着pH的增大的竞争优势逐渐增强,导致氨氮的吸附量增加[37]。当pH在6~9时,随着pH的增大,吸附量出现缓慢下降的趋势,这是由于溶液中OH-的含量增加,促使反应→ NH3·H2O的正向进行,以NH3·H2O形式存在的氨氮不断增加,从而导致氨氮分子吸附量的降低。为了同时保持较高吸附量和吸附率,后续实验选择pH=4,此时氨氮去除率为84.43%,吸附量为63.32 mg/g。
2.3 吸附动力学
室温下,研究了30 mg/L氨氮溶液的氨氮吸附效果随吸附时间的变化,结果如图8所示。从图8可以看出,Fe3O4@SiO2@mSiO2介孔磁性纳米材料吸附氨氮的速率在反应初期较快,吸附量随时间的延长而增加。10 min后,氨氮的吸附过程较平缓,吸附速率降低,40 min后达到吸附平衡。反应初期吸附剂上存在大量的吸附位点,吸附剂与氨氮溶液的界面浓度梯度较大,传质驱动力促进氨氮在吸附剂表面和孔隙内的吸附。随着吸附的进行,大量吸附位点被占据,孔隙的吸附量逐渐接近饱和,与溶液浓度梯度逐渐减小,直至进入以扩散为主的动态吸附平衡过程,吸附速率趋于零。
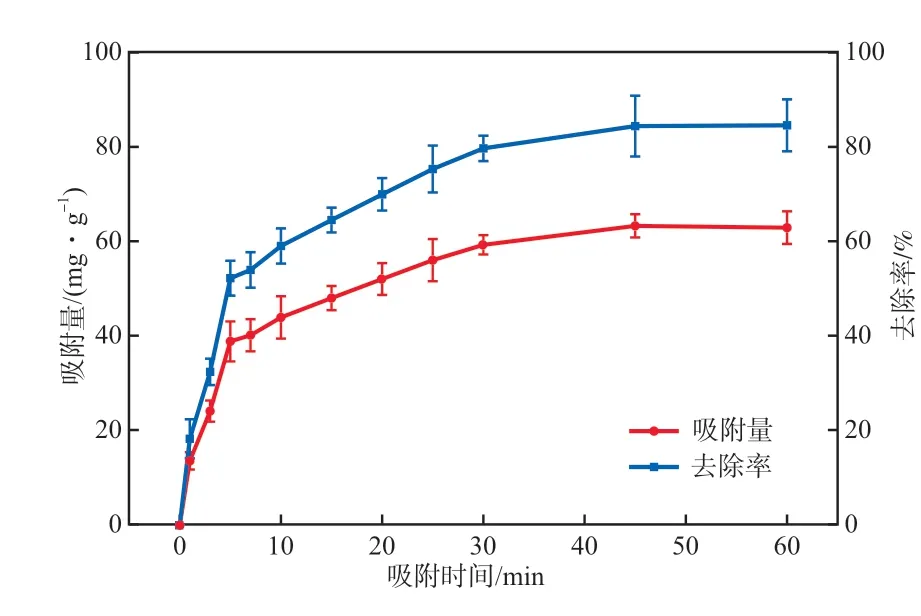
图8 氨氮吸附效果随吸附时间的变化
分别采用拉格朗日准一级动力学方程(见式(1))和准二级动力学方程(见式(2))对图8的实验数据进行拟合,拟合结果见表2。由表2可知,准二级动力学方程拟合的R2值整体比准一级动力学方程拟合的更高,说明准二级动力学模型能更好地描述Fe3O4@SiO2@mSiO2对氨氮的吸附过程。

表2 动力学方程的拟合结果

式中:t为吸附时间,min;qt为t时刻的吸附量,mg/g;qe为平衡吸附量,mg/g;k1为准一级吸附速率常数,min-1;k2为准二级吸附速率常数,g/(mg·min)。
2.4 吸附等温线
室温下吸附120 min,Fe3O4@SiO2@mSiO2介孔磁性纳米材料对水中氨氮的吸附等温线如图9所示。
分别采用Langmuir和Freundlich等温吸附模型(分别见式(3)和式(4))对图9的实验数据进行拟合,拟合结果见表3。
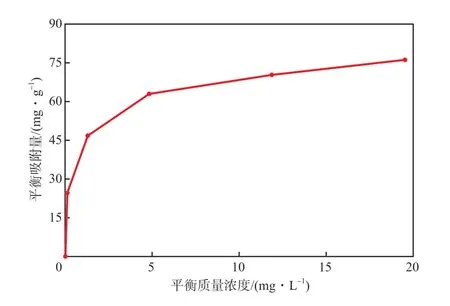
图9 氨氮吸附等温线
由表3可见,Fe3O4@SiO2@mSiO2对氨氮的饱和吸附量可达71.54 mg/g。在Freundlich吸附模型中,1/n小于1,说明Fe3O4@SiO2@mSiO2对氨氮的吸附较易进行。Langmuir和Freundlich吸附模型的R2值分别为0.8951和0.9801,即Fe3O4@SiO2@mSiO2吸附氨氮更符合Freundlich模型,说明吸附材料表面在不同的吸附位置具有不同的吸附能量,且该吸附属于多分子层吸附。

表3 等温吸附模型的拟合结果

式中:ρe为吸附平衡时的氨氮质量浓度,mg/L;qsat为饱和吸附量,mg/g;KL为Langmuir吸附常数,L/mg;KF为Freundlich吸附常数,n为与吸附强度相关的参数。
2.5 吸附氨氮的热力学
利用式(5)~(6),根据Fe3O4@SiO2@mSiO2吸附氨氮的lnK与1/T的关系可得出相应的热力参数,如表4(30 mg/L氨氮溶液,吸附120 min)所示。

表4 氨氮吸附的热力学参数

式中:K为吸附平衡常数,K=qe/ρe,L/g;R为摩尔气体常数,8.314 J/(mol·K);T为吸附温度,K;ΔG为吸附自由能变,J/mol;ΔH为吸附焓变,J/mol;ΔS为吸附熵变,J/(mol·K)。
在实验温度范围内,K值随温度的升高而降低,吸附过程的焓变ΔH>0,表明吸附过程为吸热过程。ΔG小于0,表明吸附过程是自发的,ΔG随温度升高而减小,说明升温有利于吸附过程的自发进行。ΔS>0,证明在吸附过程中体系的自由度增加。
2.6 吸附剂的重复使用性能
在实际应用中提高材料的吸附效率,同时提高材料的重复使用次数对降低废水处理运行成本至关重要。室温下,Fe3O4@SiO2@mSiO2在30 mg/L氨氮溶液中吸附120 min后,将其分别置于5%硫酸溶液和1%氯化钠溶液中超声处理30 min,然后用无水乙醇和去离子水交替洗涤3次,烘干再生后重复吸附实验,结果如图10所示。可以看出,随着使用次数的增加,Fe3O4@SiO2@mSiO2对氨氮的吸附量呈下降趋势。但该材料在第4次使用中对氨氮的吸附量仍保持在初始吸附量的65%以上,说明其具有良好的再生利用性和稳定性。

图10 Fe3O4@SiO2@mSiO2的重复使用性能
3 结论
a)制备所得的Fe3O4@SiO2@mSiO2为规则球状,由三层结构组成,中心为Fe3O4核,中间为SiO2包裹,最外层为介孔SiO2。材料为介孔磁性纳米材料,呈现良好的超顺磁性。
b)Fe3O4@SiO2@mSiO2对水中氨氮的去除率随投加量的增加而增大,投加量增至0.4 g/L后基本保持不变,吸附量随投加量的增加而减小;氨氮的去除率和吸附量随溶液pH的增大均呈现先升后降的趋势,最适溶液pH为4。
c)Fe3O4@SiO2@mSiO2对水中氨氮的吸附符合拉格朗日准二级动力学模型,匹配Freundlich等温吸附模型,吸附过程为自发吸热过程。
d)该材料在第4次使用中对氨氮的吸附量仍保持在初始吸附量的65%以上,具有良好的再生利用性和稳定性。

