拟水平均匀设计法优化超声辐照微泡促人骨髓间充质干细胞分泌SDF-1的实验研究
李 露 何 芬 杨凤武 古 静 徐亚丽
近年来,干细胞疗法作为新型治疗手段逐渐应用于多种疾病。其中,骨髓来源的间充质干细胞(mesenchymal stem cells,MSCs)由于其取材较为容易、免疫原性较弱且具有分化为多种细胞的能力,成为研究的热点之一[1],其治疗效果与移植入体内后到达靶组织的效率密切相关。基质细胞衍生因子1(stromal cell-derived factor-1,SDF-1)是最重要的趋化与归巢相关分子之一[2],与其受体CXC趋化因子受体4一起作用,有助于MSCs向靶组织迁移归巢[3],而提高靶区SDF-1浓度可促进更多的MSCs归巢。前期研究[4]表明,超声辐照微泡可提高MSCs的移植效率及归巢能力,其机制可能为微泡增强的超声生物学效应可促使MSCs旁分泌SDF-1,使靶区组织SDF-1含量增高[5]。但关于超声辐照微泡促MSCs分泌SDF-1的参数优化方面的研究较少。本研究采用拟水平均匀实验设计法,选取超声辐照强度、超声辐照时间及微泡浓度3个实验参数,各设5个水平以筛选影响MSCs分泌SDF-1的最优因素组合。
材料与方法
一、主要材料与仪器
人骨髓MSCs细胞株(美国Sciencell公司);干细胞完全培养基(广州赛业生物科技公司);0.25%EDTA-胰蛋白酶(美国Hyclone公司);人SDF-1 ELISA试剂盒(美国R&D公司);CCK-8溶液(北京碧云天生物技术公司);造影剂“脂氟显”(陆军军医大学第二附属医院超声科实验室自制)为脂质膜包裹全氟丙烷气体的微泡,粒径2~10μm,其中98%小于8μm,微泡平均浓度约为(7~8)×109个/ml,使用前用生理盐水稀释至相应浓度;酶联免疫分析仪(F039300,澳大利亚Tecan公司);超声治疗仪(Accusonic Plus,澳大利亚Metro Medical公司),除辐照强度和辐照时间随实验调整外,超声发射频率固定为1 MHz,占空比设为10%。
二、主要实验方法
1.细胞培养:将人骨髓MSCs细胞株用含10%胎牛血清的干细胞完全培养基在37℃、5%CO2孵箱中培养,每4~6天传代1次。取对数生长期的细胞用0.25%EDTA-胰蛋白酶消化,制成单细胞悬液后以每孔1×106的密度接种于六孔板中,每孔细胞悬液量约2 ml,放于孵箱静置6~8 h,待细胞完全贴壁后即可用于不同影响因素条件下的超声辐照。
2.实验设计与分组:采用双均数拟水平均匀实验设计,选定超声辐照强度、超声辐照时间、微泡浓度3个常见影响因素,每因素设5个水平,分别为:①超声辐照强度,即0(对照)、0.2、0.4、0.6、0.8 W/cm2;②超声辐照时间,即0(对照)、20、30、40、60 s;③微泡浓度,即0(对照)、102、104、106、108个/ml。根据均匀设计表U15(155)安排的实验分组进行超声辐照,应用多元线性回归及逐步回归统计学方法分析,并综合考虑各因素间的关系,以相对高的SDF-1分泌量(上清液中SDF-1浓度)和相对低的细胞死亡率(MSCs存活率)为目标,确定最优影响因素组合。然后分别按照超声辐照时间、超声辐照强度、微泡浓度3个因素进行验证,具体:①考察超声辐照强度,分为0(对照)、0.2、0.4、0.6、0.8 W/cm2,此时超声辐照时间30 s,微泡浓度106个/ml;②考察超声辐照时间,分为0(对照)、20、30、40、60 s,此时超声辐照强度0.6 W/cm2,微泡浓度106个/ml;③考察微泡浓度,分为0(对照)、102、104、106、108个/ml,此时超声辐照时间30 s,超声辐照强度0.6 W/cm2。
3.ELISA法检测SDF-1含量:将人骨髓MSCs经超声辐照并继续培养24 h后,分别吸取每孔上清液作为样品。将不同浓度的SDF-1标准品和稀释后的各个样品加入酶标板内,按照人SDF-1 ELISA试剂盒说明书步骤依次操作,最后使用酶联免疫分析仪测定样品于450 nm光谱处的吸光度值,根据样品的吸光度值和稀释倍数检测样品浓度。
4.CCK-8法评估细胞活性:将人骨髓MSCs经超声辐照并继续培养24 h后,收集各组人骨髓MSCs制成单细胞悬液,以每孔2×103的密度接种于96孔板中,每孔100μl,将未被超声辐照的人骨髓MSCs设为对照。将96孔板于孵箱静置6~12 h待细胞全部贴壁后,每孔加入10μl CCK-8溶液。孵箱继续放置2 h后,设仅含有100μl单纯细胞培养基的孔为空白对照孔,采用酶联免疫分析仪测量每个样品孔于450 nm光谱处的吸光度值,细胞存活率(%)=样品孔吸光度值/空白对照孔的吸光度值×100%。
三、统计学处理
应用SPSS 13.0统计软件,参数筛选采用双指标拟水平均匀设计,应用多元线性回归分析及逐步回归分析筛选最优影响因素组合。P<0.05为差异有统计学意义。
结果
一、优化SDF-1分泌的最优影响因素组合
通过双指标拟水平均匀实验设计优化超声辐照微泡促人骨髓MSCs分泌SDF-1的因素,按U15(155)均匀实验设计表设计,见表1。
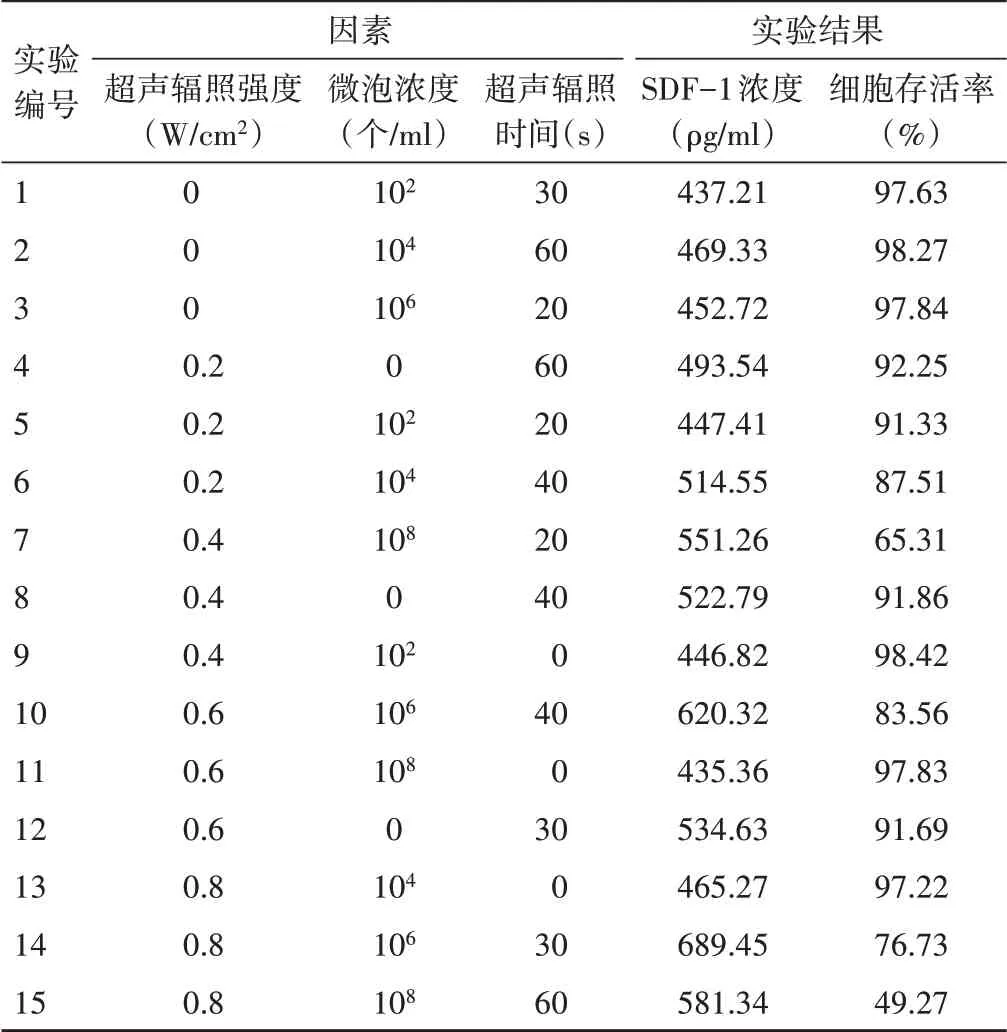
表1 超声辐照参数筛选实验拟水平均匀设计表及实验结果
应用多元线性回归分析,得到双指标的回归方程为:


两个回归方程对应的概率值P=0.003、0.014,均小于0.05,总回归效果显著。偏回归效果检验显示,因素B(微泡浓度)对SDF-1分泌量的偏回归贡献不显著(P<0.05),说明其对SDF-1分泌量的作用可由其他因素代替,故需进一步行逐步回归分析,得逐步回归方程为:

方程对应的概率值P<0.05,总回归效果显著。采用方程(2)、(3)对实验影响因素进行优化,并综合考虑各因素间关系后,最终确定最优影响因素组合为超声辐照强度0.6 W/cm2,超声辐照时间30 s,微泡浓度106个/ml。
二、不同参数条件下SDF-1分泌量和人骨髓MSCs细胞存活率结果
1.超声辐照后即刻,光镜下可见贴壁的人骨髓MSCs胞质回缩,细胞折光率增强,超声辐照强度加大时部分细胞甚至漂浮起来。放于孵箱静置培养24 h后,绝大部分人骨髓MSCs会重新贴壁生长,形态与正常细胞相比无明显差别。见图1。随着超声辐照强度增加,存活下来贴壁生长的人骨髓MSCs越来越少。

图1 人骨髓MSCs在微泡浓度106个/ml、超声辐照时间30 s即刻及辐照后24 h不同超声辐照强度下的光镜图(×100)
2.对优化筛选后的影响因素进行验证,超声辐照强度、微泡浓度和超声辐照时间3个因素对SDF-1分泌量和人骨髓MSCs细胞存活率的影响见图2。图2A显示,随着超声辐照强度的增强,SDF-1浓度逐渐增大,辐照强度为0.6 W/cm2时,SDF-1浓度达到峰值(551.67±40.88)ρg/ml,当辐照强度继续增大至0.8 W/cm2,SDF-1浓度反而下降;同时,细胞存活率随着超声辐照强度的增加显著降低,辐照强度为0.6 W/cm2时,细胞存活率为(88.51±4.03)%,辐照强度继续增加至0.8 W/cm2时,细胞存活率下降至(71.02±7.97)%。图2B显示,SDF-1浓度随超声辐照时间增加而增加,超声辐照强度为0.6 W/cm2时SDF-1浓度达到峰值,超声辐照时间>30 s时,SDF-1浓度即开始下降,辐照时间为60 s时,SDF-1浓度降至(492.47±19.64)ρg/ml;另外,超声辐照时间越长,细胞存活率越低,辐照时间为60 s时降至(65.67±6.04)%。图2C显示,随着微泡浓度的增大,SDF-1浓度也逐渐增大,于微泡浓度为106个/ml时达到峰值,当微泡浓度增大至108个/ml,SDF-1浓度下降至(468.16±49.91)ρg/ml,同时细胞存活率也显著下降至(62.26±7.27)%。结果显示,当超声辐照强度为0.6 W/cm2、超声辐照时间为30 s、微泡浓度为106个/ml时,SDF-1分泌量和人骨髓MSCs细胞存活率可达到相对匹配的数值。

图2 不同影响因素条件下超声辐照微泡促人骨髓MSCs分泌SDF-1和细胞存活情况
讨论
在医院临床和基础研究中经常接触到包含多因素、多水平双指标的实验,如交叉匹配各个因素和水平进行全面实验,不仅要花费大量的人力、物力,还需相当长的时间,显然是不实际的。正交设计法和均匀设计法均能在不影响实验效果的前提下,尽可能减少实验次数,前者的实验次数是后者实验次数的整数倍,故均匀设计法是一种更加高效、快速、经济的实验设计方法。本研究采用拟水平均匀设计超声辐照微泡后人骨髓MSCs SDF-1分泌量和MSCs细胞存活率的双指标实验,旨在探讨超声辐照微泡促人骨髓MSCs分泌SDF-1的最优条件。
方程(2)中,因素A(超声辐照强度)、B(微泡浓度)、C(超声辐照时间)系数均为负值,具有阻碍细胞存活的作用,说明取低值有利于细胞存活,适宜范围内应取下限值;方程(3)中,因素A、C系数均为正值,具有促进SDF-1分泌的作用,说明高值有利于SDF-1分泌,适宜范围内应取上限值,因素B不包含于方程(3)中,说明不同的因素B取值对SDF-1分泌无明显的影响作用,可作为常量。综合分析,因素A对促SDF-1分泌与细胞存活率有相反作用的影响,且对促SDF-1分泌的影响更大,故取较中间值大一点的数值,即0.6 W/cm2;因素C对促SDF-1分泌与细胞存活率也有相反作用的影响且影响力类似,故取中间值30 s;因素B对促SDF-1分泌无影响,对细胞存活率有影响,宜取低值,但由于方程(2)中因素B的系数为-1.791E-7,B的取值范围为0~106个/ml,实际上对细胞存活的影响均微小,仅当因素B的取值达到108个/ml时,对细胞存活率才有显著的阻碍作用,考虑到实际操作的准确性(微泡浓度越低操作误差越大),因素B取106个/ml。所以,根据方程(2)、(3),综合考虑促SDF-1分泌量和高的细胞存活率的最优影响因素组合为:超声辐照强度0.6 W/cm2,微泡浓度106个/ml,超声辐照时间30 s。
研究[6-7]表明,超声辐照微泡虽可促使人骨髓MSCs分泌SDF-1,但随着超声辐照强度、辐照时间的增加,其辐照能量也不断增强,超过一定阈值后,细胞就会溶解和死亡。超声微泡造影剂注入体内后,作为空化核可以大大降低超声生物学效应(主要是空化效应)的阈值,使空化效应强度显著增加。在离体实验[8]中,当细胞周围存在大量空化核(如微泡造影剂)时,微泡增强的超声空化效应也可对被辐照细胞造成不可逆的损伤。所以,需要找到超声辐照时间、辐照强度和微泡数量/浓度的最优组合,希望在保证较多的MSCs存活的前提下,超声辐照微泡能有效促进其分泌更多的SDF-1。本研究结果提示,超声辐照强度、超声辐照时间或微泡浓度超过一定阈值后,大量的人骨髓MSCs会因辐照能量过高或空化核浓度过大而死亡,导致相应的SDF-1分泌量也减少。本研究采用均匀设计法和回归分析的统计学方法筛选出体外超声辐照微泡促人骨髓MSCs分泌SDF-1的最优影响因素组合,即超声辐照强度0.6 W/cm2,超声辐照时间30 s,微泡浓度106个/ml。使用该最优组合时人骨髓MSCs的存活率为(88.51±4.03)%,同时SDF-1分泌量显著增加,达(551.67±40.88)ρg/ml。当然,超声辐照微泡作用于动物或人体时,涉及的相关超声作用因素更多,优化筛选过程也会更加复杂,需后续实验研究的进一步探讨。
综上所述,采用拟水平均匀设计法筛选出超声辐照微泡促人骨髓MSCs分泌SDF-1和细胞存活率达到相对匹配的最优影响因素组合为:超声辐照强度0.6 W/cm2,超声辐照时间30 s,微泡浓度106个/ml。

