肾上腺醛固酮腺瘤术后血压影响因素分析
陈纯娴, 许 宁, 潘 忞, 魏 勇
原发性醛固酮增多症(primary aldosteronism,PA)是1955年由Conn首次发现并描述,是继发性高血压中最常见的病因之一,又称Conn综合征,约占高血压病患者的5%~25%。该病的特征在于独立于肾素的醛固酮自主分泌,导致盐皮质激素受体(mineralocorticoid receptors,MR)的过度活化,常表现为高血压、低血钾症及失钾性肾病等[1-3]。肾上腺醛固酮腺瘤(aldosterone-producing adenoma, APA)是PA中最常见的一种类型,约占35%。目前,腹腔镜下肾上腺切除术是APA首选的治疗方法,可改善患者的高血压、低血钾及心血管疾病问题。但部分患者术后出现持续性高血压而严重影响预后。影响APA患者术后血压治愈相关的因素可能包括:年龄、术前血压水平、高血压病病程、降压药种类及血浆醛固酮浓度等[4-6]。本研究回顾性分析109例APA患者的临床资料,探讨影响APA术后血压恢复的预测因素,报道如下。
1 对象与方法
1.1 对象 收集2014 年1 月—2017 年1 月笔者医院收治的109例APA患者的病例资料,均由同一位医师完成腹腔镜下患侧肾上腺切除。纳入标准:(1)符合APA诊断标准,血浆醛固酮/肾素活性比值>30,且血浆醛固酮浓度≥150 pg/mL,至少完成生理盐水负荷试验或卡托普利试验两者之一,且结果呈阳性[7];(2)术前3个月内行肾上腺CT平扫+增强确定单侧肾上腺占位且排除转移瘤;(3)术后病理证实为皮质腺瘤。排除标准:(1)非腺瘤型PA或因其他原因行肾上腺切除术者;(2)临床资料不全、相关病理诊断不明确者及无肾上腺CT图像者;(3)曾接受对侧肾上腺手术治疗者;(4)失访或随访时间少于6个月者。
1.2 方法
1.2.1 评价指标 收集患者的资料,包括年龄、性别、体质量指数(body mass index,BMI)、术前收缩压、术前舒张压、高血压病家族史、高血压病病程、术前服用降压药数量、肿瘤体积、安体舒通反应、手术方式、术后病理及术前实验室指标(血钾浓度、血浆醛固酮浓度、血浆肾素活性浓度)。术后病理由笔者医院2位病理科医师进行评估。
1.2.2 术式选择 所有患者行腹腔镜下患侧肾上腺切除术。其中,35例患者完善肾上腺CT平扫+增强检查后高度怀疑多发性醛固酮瘤或伴有结节样增生可能,采用单侧肾上腺全切术;其余51例患者CT结果提示单发醛固酮瘤且包膜完整,采取肾上腺肿瘤+肾上腺部分切除术[7]。
1.3 相关定义
1.3.1 高血压病家族史 至少1位一级亲属诊断为高血压病。
1.3.2 BMI BMI=体质量(kg)/身高2(m2)。根据BMI水平分为3组:低BMI组(BMI<18.5 kg/m2),标准BMI组(18.5 kg/m2 1.3.3 安体舒通反应 安体舒通反应阳性指使用安体舒通7 d后,血压达到正常(血压<140/90 mmHg, 1 mmHg=133.3 Pa)或收缩压降低>20 mmHg和(或)舒张压降低>10 mmHg。未达到上述标准者为安体舒通反应阴性[8]。 1.4 术后随访 采用电话随访和门诊随访。术后1、6及12个月评估患者血压,记录患者血压治愈的时间。高血压病治愈定义为术后血压恢复正常(血压<140/90 mmHg,且不需要服用降压药物);除上述之外情况定义为高血压病未治愈[4]。血压随访时间至少为6个月,随访截止2018 年1 月。根据术后6个月血压控制水平分为两组:将术后6个月高血压治愈定义为治愈组,未治愈定义为非治愈组。 2.1 人口学资料 109例中,2例因临床资料不全排除,1例因随访中失访排除。106例中,男性38例,女性68例。患者就诊时年龄(45.2±11.5)岁(22~69岁),高血压病家族史占20.8%,术前平均收缩压为(155.7±17.4)mmHg,舒张压为(92.3±12.7)mmHg,BMI为(22.99±3.47) kg/m2,肾上腺体积为(2.49±2.30) cm3,血浆醛固酮浓度为(121.59±36.12) pg/mL。 2.2 术后血压随访情况 腹腔镜下肾上腺部分或全切除术后1个月,高血压病治愈73 例(68.9%);术后6个月,高血压病治愈70 例(66.0%)。 2.3 APA患者术后血压水平的影响因素 术后非治愈组的年龄、收缩压、舒张压、高血压病病程、术前醛固酮浓度明显高于治愈组,有高血压病家族史及安体舒通试验阳性患者明显多于治愈组,术前使用降压药数量明显多于治愈组(P<0.05)。两组间BMI、肿瘤体积、肿瘤位置、手术方式、术前血钾水平、术前血浆肾素活性比较,差别无统计学意义(P>0.05,表1)。 将临床资料纳入单因素logistic回归分析,结果显示:年龄(P<0.001)、性别(P=0.014)、术前收缩压(P=0.001)、术前舒张压(P=0.011)、高血压病家族史(P<0.001)、高血压病病程(P<0.001)、术前服用降压药数量(P<0.001)、安体舒通反应(P=0.021)和术前血浆醛固酮浓度(P<0.001)可能是肾上腺切除术后血压治愈的影响因素(表2)。 将年龄、性别、术前收缩压、术前舒张压、高血压病家族史、高血压病病程、安体舒通反应、使用降压药物数量、术前血浆醛固酮浓度纳入多因素非条件logistic回归分析,采取输入法进行筛选,结果显示,术前年龄较低或血浆醛固酮浓度较低的APA患者,术后血压更易控制(表3)。 2.4 腹腔镜下肾上腺切除术后血压治愈的预测因素 分别将年龄与术前血浆醛固酮浓度进入ROC曲线分析,结果显示,年龄和血浆醛固酮浓度的AUC分别为0.871和0.950。由ROC曲线计算对应的临界值分别为44.5岁和121.5 pg/mL(表4,图1)。 PA最多见的亚型为APA和特发性肾上腺增生(idiopathic adrenal hyperplasia,IAH)。IHA患者首选药物治疗,APA患者首选手术治疗。研究表明,约35%的PA由APA引起,APA以单一腺瘤多见,肿瘤直径较小(0.5~2.5 cm),很少出现恶变[1,3,9]。腹腔镜下患侧肾上腺切除术是APA手术治疗的首选方法,显著降低心血管和肾脏功能衰竭等并发症的发生[7]。目前,不同文献报道中APA术后血压的治愈率差别很大。同时,与原发性高血压比较,APA患者术后持续高血压导致的心脑血管意外和肾功能衰竭的风险更大[9-10]。因此,本研究比较术后血压不同治愈情况患者的临床相关因素,旨在探讨影响APA术后血压治愈的相关因素。 APA的临床表现为高血压、低血钾及非肾素依赖性高醛固酮等。绝大部分APA患者通过切除患侧肾上腺,可以改善低血钾、高血浆醛固酮浓度。据统计,90%以上的APA患者行患侧肾上腺切除可以纠正低钾血症[11]。相比于血钾、血浆醛固酮浓度,APA患者肾上腺切除术后血压治愈率差别较大,血压恢复所需时间较长,部分患者甚至表现为持续高血压,原因在于手术切除APA可以减少醛固酮分泌,但机体肾素-血管紧张素-醛固酮系统仍需要一定的调节时间才能恢复正常(1~6个月)。与以往研究结果类似,本研究结果表明,APA患者术后1、6个月的血压治愈率分别为68.9%和66.0%。 临床上,预测肾上腺切除术后APA的高血压病治愈因素的结果存在差别,确切的因素仍未知。Kim等[4]的研究表明,血浆醛固酮浓度是术后血压恢复的独立预测指标。Utsumi等[12]研究110例接受单侧腹腔镜肾上腺切除术的PA患者,发现高龄、女性、高血压病病程较长和使用降压药物种类多者,术后血压不易治愈。国内学者比较腹腔镜下肾上腺部分切除与全部切除治疗APA的疗效,发现不同术式对APA患者术后血压恢复无影响[13-14]。农礼铭等[15]发现,APA患者术后持续性高血压与靶器官结构性改变及基因突变有关。最近一项研究表明,NADPH氧化酶2(NADPH oxidase 2,Nox2)和P22phox亚基大量存在于APA患者,与术后血压治愈密切相关,Nox2越高,术后高血压病治愈率越低[16]。而本研究发现,术前临床因素包括年龄、术前降压药物数量和血浆醛固酮浓度是预测肾上腺切除术后血压恢复的独立影响因素,而与手术方式、肿瘤大小与位置无关。因此,对于APA患者,术前评估年龄、血浆醛固酮浓度及降压药物数量将可能成为评估APA术后患者预后的有效指标。 本研究中,术后6个月66.0%患者高血压病治愈。目前,对于APA患者术后持续性高血压的具体机制尚不清楚。Fujita等[17]认为,肾上腺手术虽然消除醛固酮过量产生,但长期过量醛固酮抑制NO形成和增加活性氧自由基,对心血管系统造成不可逆损害,导致术后持续性高血压。此外,APA患者过高的醛固酮水平和高钠血症可导致广泛的肾损害,降低肾小球滤过率,导致肾性高血压形成,在促进持续性高血压的发生和发展中起关键作用[4-6]。部分APA患者术前可能伴有原发性高血压病,手术并不能治愈原发性高血压病,这可能是增加患者术后持续性高血压的一个原因。本研究结果显示,年龄、术前降压药物数量和血浆醛固酮浓度与术后血压是否治愈密切相关,有助于进一步筛选出术后持续性高血压高危患者。术前需特别注意与高危患者及家属沟通可能出现术后持续高血压,对高危患者可推荐醛固酮受体拮抗剂等药物治疗方案。 本研究存在一定的局限性。首先,影响肾上腺切除术后血压治愈的因素很多,本研究样本量较小,无法进一步分层分析,无法纳入影响肾上腺切除术后血压改变的其他危险因素,因此可能存在一定选择偏移;其次,血压存在一定的波动性,无法排除不同次血压测量间的变化所引起的干扰因素;最后,本研究为单中心回顾性研究,结论受限于统计时间及统计样本量等因素,仍需由大规模、多中心临床随机对照试验进一步验证。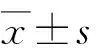
2 结 果
3 讨 论

